高中化学必修二第一章第一节第二节精品课件
- 格式:ppt
- 大小:3.59 MB
- 文档页数:111



元素周期律教学目标1、了解主要化合价与元素金属性、非金属性的周期性变化。
2、了解元素周期表和元素周期律的意义。
3、认识事物变化由量变引起质变的规律。
重点难点元素周期表和元素周期律的意义 教学过程[复习]1、回忆有关元素原子核外电子的排布规律;2、填写1——18号元素符号以及它们的原子结构示意图。
[学生活动][投影展示]1~18号元素原子结构示意图。
[提问]请大家总结一下,随着原子序数的递增,原子核外电子层排布有何规律性变化。
[板书]二、元素周期律 [学生活动][投影展示] 随着原子序数的递增,原子核外电子层排布变化的规律性[讲述]从上表可以看出:随着原子序数的递增,每隔一定数目的元素,会重复出现原子最外层电子从1个递增到8个的情况(H 、He 除外),这种周而复始的重现(但并不是简单的重复)的现象,我们称之为周期性。
这就如同我们一年一年的四季更替及学生活中的每天都是24小时一样。
因此,原子核外电子层排布的这种规律性变化,我们便称之为周期性变化。
由此,可得出如下[讲述并板书][过渡]元素的性质是由元素的原子结构决定的,那么,随着原子序数的递增,元素的性质是否也会像元素原子最外层电子排布一样呈现周期性变化?我们从元素的化合价和元素的金属性与非金学反应,因此,把它们的化合价看作0。
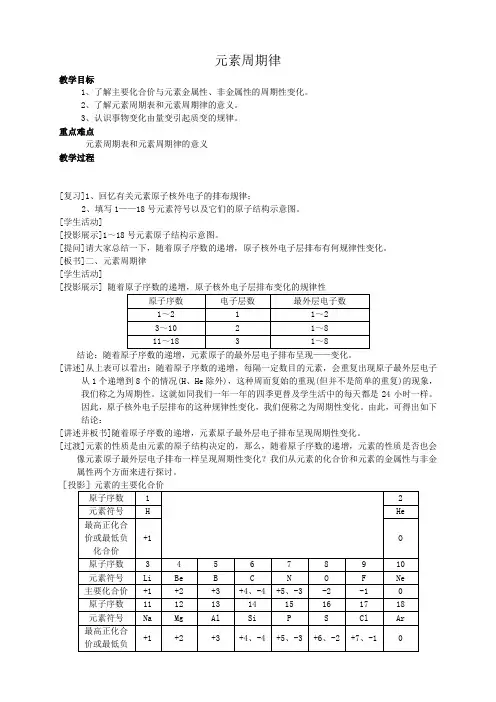
[学生]原子序数为1~2时,化合价从+1下降到0;原子序数为3~9时,随着原子序数的递增,最高正价从+1到+5,最低负价从-4到-1;原子序数为11~17时,随着原子序数的递增,最高正价从+1到+7,最低负价从-4到-1。
稀有气体元素的化合价均为0。
[教师]很好!那么,能不能由此说明:随着原子序数的递增,元素的化合价也呈周期性变化呢?[过渡]下面我们通过第三周期元素的一些化学性质来探讨元素的金属性与非金属性有何变化。
[提问]假如我们要用实验来验证这个结论,又应从哪些方面着手呢?[学生回答,教教师板书]1.单质跟水(或酸)2.最高价氧化物的水化物——1.2.[教师]一般,对于金属元素我们主要研究其金属性,对于非金属元素我们主要研究其非金属性。





化学必修二讲义普通高中课程标准实验教科书化学必修2第一章物质结构元素周期律第一节元素周期表第二节元素周期律第三节化学键归纳与整理第二章化学反应与能量第一节化学能与热能第二节化学能与电能第三节化学反应的速率和限度归纳与整理第三章有机化合物第一节最简单的有机化合物----甲烷第二节来自石油和煤的两种基本化工原料第三节生活中两种常见的有机物归纳与整理第四章化学与可持续发展第一节开发利用金属矿物和海水资源第二节化学与资源综合利用、环境保护归纳与整理结束语附录Ⅰ相对原子质量表附录Ⅱ部分酸、碱和盐的溶解性表(20℃)附录Ⅲ一些常见元素中英文名称对照表第一章物质结构元素周期律第一节元素周期表(一)核素1、原子结构:原子由原子核和核外电子构成,原子核在原子的中心,由带正电的质子与不带电的中子构成,带负电的电子绕核作高速运动。
也就是说,质子、中子和电子是构成原子的三种微粒。
在原子中,原子核带正电荷,其正电荷数由所含质子数决定。
(1)原子的电性关系:核电荷数 = 质子数 = 核外电子数 (2)质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。
质量数(A )= 质子数(Z )+ 中子数(N )(3)离子指的是带电的原子或原子团。
带正电荷的粒子叫阳离子,带负电荷的粒子叫阴离子。
当质子数(核电荷数)>核外电子数时,该粒子是阳离子,带正电荷; 当质子数(核电核数<核外电子数时,该粒子是阴离子,带负电荷。
(4)原子组成的表示方法2、核素和同位素(1)核素:具有一定数目的质子和一定数目的中子的原子叫核素。
如如氢元素有11H 、21H 、31H 三种不同核素。
(2)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
①同位素中“同位”的含义:指在元素周期表中占据同一个位置的意思。
如氕、氘、氚,即同一元素的不同核素之间互称为同位素。
②同位素的性质:在天然存在的某种元素中,各种同位素原子个数百分含量一般是不变的;同一种元素的各种不同的同位素化学性质几乎完全相同,因为各同位素原子结构几乎相同(除中子数)。