高中化学必修一人教版第一节铁的单质教学课件
- 格式:pptx
- 大小:33.38 MB
- 文档页数:27
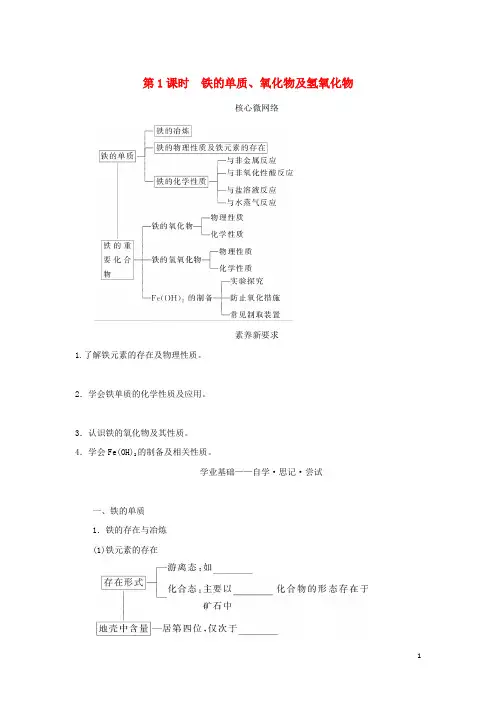
第1课时铁的单质、氧化物及氢氧化物核心微网络素养新要求1.了解铁元素的存在及物理性质。
2.学会铁单质的化学性质及应用。
3.认识铁的氧化物及其性质。
4.学会Fe(OH)2的制备及相关性质。
学业基础——自学·思记·尝试一、铁的单质1.铁的存在与冶炼(1)铁元素的存在(2)铁的冶炼①我国在西周晚期就掌握了冶铁的技术。
战国中期以后,铁制工具在社会生产中发挥了巨大的作用。
②工业炼铁的原理是用________的方法把铁从铁矿石中提炼出来。
2.铁的性质(1)物理性质纯净的铁是光亮的________色金属,密度较大,熔点较高。
具有________性、________性、________性,能被________吸引。
(2)化学性质①铁与非金属单质、酸、盐溶液的反应②实验探究铁粉与水蒸气的反应3.写出下列反应的化学方程式或离子方程式(1)与非金属单质(2)与水(常温不反应、高温与水蒸气反应)________________________________________________________________________ (3)与稀盐酸、稀H2SO4反应(离子方程式)________________________________________________________________________ (4)与某些盐(离子方程式)二、铁的氧化物均可与Al、CO、H2等反应,如3Fe x O y+2y Al3x Fe+y Al2O3特别提醒1.FeO、Fe2O3是碱性氧化物。
Fe3O4有固定的组成,属于纯净物,不是混合物,由于其与非氧化性酸反应生成铁盐和亚铁盐,故不属于碱性氧化物。
2.Fe3O4可看成FeO·Fe2O3,所以在书写Fe3O4与盐酸反应的方程式时,可将其看作FeO、Fe2O3分别与盐酸反应,然后把两个反应相加。
3.在高温条件下,Fe与Fe2O3可以发生反应,当铁足量时:Fe+Fe2O33FeO,当铁不足时:Fe+4Fe2O33Fe3O4。









