第三节 确定滴定终点的方法
- 格式:ppt
- 大小:80.00 KB
- 文档页数:23


化学实验教案氧化还原滴定误差与校正实验在化学实验中,氧化还原滴定是一种常用的分析方法。
然而,氧化还原滴定过程中可能会出现误差,因此需要进行校正实验。
本文将探讨氧化还原滴定误差的原因,介绍校正实验的方法与步骤。
一、氧化还原滴定误差的原因在进行氧化还原滴定实验时,可能会出现以下几种误差:1. 仪器误差:实验中使用的玻璃仪器可能存在刻度不准确、涂层老化等问题,导致读数不准确。
2. 滴定试剂纯度不高:滴定试剂的纯度不高会导致计算浓度时计算出现误差。
3. 滴定终点判定不准确:滴定过程中,终点的判定可能会受到人眼的主观判断影响,导致读数不准确。
4. 滴定剂的保存和使用:滴定剂的保存条件和使用方法不当可能影响滴定结果的准确性。
二、校正实验的方法与步骤为了解决氧化还原滴定误差的问题,可以进行校正实验来提高实验结果的准确性。
下面是校正实验的方法与步骤:1. 校正滴定试剂的浓度:a. 准备一个已知浓度的标准试剂溶液,比如硫酸铁(II)溶液。
b. 使用标准试剂溶液对滴定试剂进行滴定,记录所需滴定体积。
c. 根据已知浓度的标准试剂溶液和所需滴定体积,计算出滴定试剂的准确浓度。
2. 检查滴定仪器的准确性:a. 使用标准试剂溶液对滴定仪器进行滴定,记录所需滴定体积。
b. 根据已知浓度的标准试剂溶液和所需滴定体积,计算出滴定仪器的准确性。
3. 确定滴定终点判定方法:a. 使用标准试剂溶液进行滴定,寻找到明确的滴定终点。
b. 尝试不同的滴定指示剂或改变滴定条件,找到更准确的滴定终点判定方法。
4. 优化滴定剂的保存和使用方法:a. 学习滴定剂的保存方法,避免暴露在光线、空气或高温环境中。
b. 注意滴定剂的使用方法,如避免受到空气氧化等。
通过以上的校正实验,可以减小氧化还原滴定实验中的误差,提高实验结果的准确性与可靠性。
结语:在化学实验中,氧化还原滴定是一种常用的分析方法,但其结果可能受到误差的影响。
通过进行校正实验,可以解决滴定误差的问题,提高实验结果的准确性。

电位滴定法确定滴定终点的方法简介电位滴定法是一种常用的化学分析方法,用于确定溶液中某种物质的浓度。
它基于电位变化来判断滴定终点,通过测量溶液中的电位变化来确定反应的终点。
本文将详细介绍电位滴定法确定滴定终点的方法。
原理在电位滴定法中,我们通常使用指示剂和参比电极来监测溶液中的电位变化。
指示剂是一种能够在特定条件下改变颜色的物质,当反应达到滴定终点时,指示剂会发生颜色变化。
参比电极则用于提供一个稳定的参考电势,以便准确测量溶液中的电位。
在进行电位滴定时,我们首先需要根据所研究物质的性质选择合适的指示剂和参比电极。
然后,将待测溶液与标准溶液逐渐混合,并同时记录下测量得到的电位值。
当溶液中出现明显颜色变化时,并且伴随着突变式的电位变化时,可以判断滴定反应已经达到终点。
实验步骤以下是进行电位滴定法确定滴定终点的一般实验步骤:1.准备工作:选择合适的指示剂和参比电极,并进行校准,确保测量结果准确可靠。
2.准备标准溶液:根据所需测定物质的浓度,配制出一定浓度的标准溶液。
3.准备待测溶液:将待测溶液与适量的试剂混合,以达到滴定所需的反应条件。
4.开始滴定:使用滴定管将标准溶液缓慢加入待测溶液中,并同时记录下每次加入后的电位值。
5.监测颜色变化:注意观察溶液颜色的变化情况,在颜色发生明显改变时停止加入标准溶液,并记录下此时的电位值。
6.数据处理:根据实验数据绘制曲线图,分析曲线上出现突变式电位变化的位置,确定滴定终点。
注意事项在进行电位滴定法实验时,需要注意以下事项:1.选择合适的指示剂和参比电极,确保实验结果准确可靠。
2.控制滴定速度,避免过快或过慢导致滴定终点的判断错误。
3.注意观察溶液颜色的变化情况,及时停止加入标准溶液。
4.实验室操作要规范,注意安全。
应用领域电位滴定法广泛应用于化学分析和质量控制领域。
它可以用于测定酸碱度、氧化还原反应、络合反应等不同类型的滴定分析。
在环境监测中,电位滴定法可以用于测定水体中重金属离子的浓度。


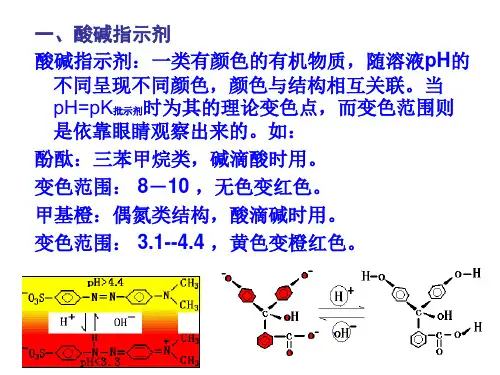





化学分析中常见酸碱滴定终点的指示方法在化学分析领域,酸碱滴定是一种重要且常用的定量分析方法。
而准确判断酸碱滴定的终点至关重要,这直接关系到分析结果的准确性和可靠性。
为了实现这一目标,人们发展出了多种酸碱滴定终点的指示方法,每种方法都有其特点和适用范围。
一、酸碱指示剂法酸碱指示剂是一类有机弱酸或弱碱,它们在溶液中能部分电离,并且由于结构的变化,其分子和离子具有不同的颜色。
在滴定过程中,随着溶液酸碱度的改变,指示剂的电离平衡发生移动,从而导致溶液颜色的变化,指示滴定终点的到达。
例如,酚酞是一种常见的酸碱指示剂,在酸性溶液中呈无色,在碱性溶液中呈粉红色。
当用强碱滴定强酸时,溶液由无色变为粉红色,即可判断滴定终点。
甲基橙也是常用的指示剂之一,在 pH < 31 时呈红色,在 pH > 44 时呈黄色。
用强酸滴定强碱时,溶液由黄色变为橙色,即为滴定终点。
选择酸碱指示剂时,需要考虑指示剂的变色范围与滴定突跃范围的匹配程度。
如果指示剂的变色范围全部或部分落在滴定突跃范围内,就能较为准确地指示滴定终点。
二、电位滴定法电位滴定法是通过测量滴定过程中电池电动势的变化来确定滴定终点的方法。
在滴定过程中,随着滴定剂的加入,溶液中离子浓度发生变化,导致电极电位发生改变。
当到达滴定终点时,电位会发生突跃。
这种方法不受溶液颜色、浑浊度等因素的影响,适用于有色溶液、浑浊溶液以及缺乏合适指示剂的滴定分析。
电位滴定法通常需要使用专门的电位计和指示电极、参比电极。
例如,常用的指示电极有玻璃电极(用于测定 pH 值)、铂电极等,参比电极则常用饱和甘汞电极。
三、电导滴定法电导滴定法是基于溶液电导的变化来确定滴定终点的方法。
在滴定过程中,随着滴定剂的加入,溶液中离子的种类和浓度发生变化,从而导致电导的改变。
例如,用强碱滴定强酸时,由于溶液中氢离子被中和,离子浓度逐渐降低,电导逐渐减小。
当达到滴定终点时,电导会发生突跃。
电导滴定法适用于稀溶液、弱电解质溶液以及离子之间相互作用较小的体系。
简述电位滴定法确定终点的方法电位滴定法是一种常用的分析化学方法,用于确定溶液中特定物质的浓度。
在电位滴定法中,通过测量溶液的电位变化来确定化学反应的终点。
确定终点的方法通常包括以下几个步骤:
1. 选择指示剂:指示剂是一种能够在溶液中发生颜色变化或电位突变的物质。
选择适当的指示剂非常重要,因为它需要在与待测物质反应终点相对应的位置显示颜色或电位变化。
2. 加入指示剂:将适量的指示剂加入待测溶液中。
指示剂的加入量应适量,以确保在接近终点时发生可观察的颜色或电位变化。
3. 开始滴定:通过滴定管逐滴加入滴定剂(通常是已知浓度的标准溶液)到待测溶液中。
滴定剂与待测物质发生化学反应,导致溶液的电位发生变化。
4. 监测电位变化:使用电位计或自动滴定装置监测溶液的电位变化。
随着滴定剂的加入,溶液的电位会发生变化。
当接近滴定终点时,电位变化可能会变得更加明显。
5. 辨别终点:通过观察电位变化或指示剂的颜色变化来确定滴定终点。
当终点达到时,电位或指示剂颜色会发生明显的变化。
终点的确定需要一定的经验和技巧。
需要注意的是,电位滴定法的准确性和可靠性取决于指示剂的选择、滴定剂的浓度和滴定速率等因素。
在进行电位滴定实验时,应严格控制实验条件,遵循正确的操作步骤,并进行实验前的充分准备和校准。
1/ 1。
酸碱滴定实验中的终点判断酸碱滴定实验是化学实验中常见的一种定量分析方法,用于确定溶液中某种物质的含量。
在滴定过程中,终点的准确判断对于结果的准确性至关重要。
本文将介绍酸碱滴定实验中常用的终点判断方法及其原理。
一、视觉指示剂法视觉指示剂法是酸碱滴定实验中最常用的终点判断方法之一。
该方法根据溶液的酸碱性质,选用合适的指示剂,在溶液中滴加指示剂后,根据颜色的变化来判断溶液的终点。
常见的视觉指示剂有酚酞、溴酚蓝、甲基橙等。
以酚酞为例,酚酞在酸性环境下呈红色,而在碱性环境下呈无色。
当滴定溶液接近中和点时,颜色会发生突变,从红色变为无色。
此时,终点即可准确判断。
二、pH计法pH计法是通过测量溶液的酸碱度来判断滴定终点。
使用pH电极和pH计,测量滴定过程中溶液的pH值,当pH值发生剧烈变化时,即可判断终点。
对于弱酸弱碱滴定,常用的指示剂是酚酞,但由于其颜色变化不明显,无法准确判断终点。
此时可以使用pH计法,通过实时监测pH值的变化,找到溶液的准确终点。
三、电导率法电导率法利用滴定过程中溶液电导率的变化来判断终点。
在滴定开始时,溶液中存在较高的离子浓度,电导率较高。
随着滴定的进行,当滴加的酸(或碱)与反应物完全反应后,反应物消失,电离度下降,溶液电导率降低。
当溶液的电导率达到最小值时,即可判断为终点。
电导率法的优点是操作简单,不受颜色和光线的影响,适用于颜色变化不明显的滴定反应。
四、自动滴定法自动滴定法是使用自动滴定仪器进行滴定的方法,可以通过设定终点指示剂和滴定速率,使实验过程更加准确和自动化。
自动滴定仪器通常配备酸碱滴定电极、磁力搅拌装置和自动加液装置,能够根据溶液的反应速率和滴定过程中的环境变化,准确判断滴定终点。
总结:酸碱滴定实验中,终点判断的准确性直接影响到实验结果的准确性。
常用的终点判断方法包括视觉指示剂法、pH计法、电导率法和自动滴定法。
不同的方法适用于不同的滴定反应,选择适合的方法能够提高实验结果的可靠性。
第三节确定滴定终点的方法滴定是一种化学分析方法,旨在确定溶液中特定物质的浓度。
滴定的原理是在溶液中滴加滴定剂,直到反应达到等价点,即滴定剂和待测物质完全反应。
为了确定等价点,需要使用其中一种方法来确定滴定终点。
以下是几种常用的确定滴定终点的方法:1.视觉指示剂法:这是最常见的确定滴定终点的方法之一、在滴定过程中,向溶液中加入一种称为视觉指示剂的物质。
当溶液中滴定剂和待测物质的摩尔比例达到一定程度时,溶液的颜色会发生明显变化,从而确定滴定终点。
例如,当溶液酸性增加时,可以使用酚酞作为视觉指示剂,当溶液由无色变为粉红色时,就达到滴定终点。
2.电位滴定法:这是一种使用电位计来测量溶液中电位变化的方法。
在滴定过程中,使用电位计测量溶液的电位,并绘制电位-滴定量曲线。
滴定剂与待测物质反应时,电位会发生突变,从而确定滴定终点。
3.自动滴定法:这种方法使用专门的仪器进行滴定,例如滴定计。
滴定计会自动控制滴定剂的滴加速度,并使用其中一种检测方法来确定滴定终点。
这种方法通常更准确和方便,特别适用于大规模或需要高精度的滴定。
4.光度计法:这种方法使用光度计来测量溶液中的光吸收或光散射。
在滴定过程中,滴定剂和待测物质之间的反应会导致溶液中一些物质的浓度变化,从而引起光吸收或光散射的变化。
通过测量这些光学信号的变化,可以确定滴定终点。
5.pH计法:这种方法使用pH计来测量溶液的酸碱性。
在滴定过程中,滴定剂的加入会导致溶液的酸碱性发生变化。
通过测量溶液的pH值,可以确定滴定终点。
以上是几种常见的确定滴定终点的方法。
选择适当的方法取决于待测物质和滴定剂的性质、滴定的目的和要求。
在选择滴定终点的方法时,需要考虑以下因素:-滴定剂和待测物质之间的反应类型:选择与滴定剂和待测物质反应相关的特定物性变化进行测量。
-滴定剂和待测物质反应的速度:选择具有足够敏感度的方法,以确保在终点附近能够观察到变化。
-滴定剂和待测物质的化学性质和浓度范围:选择相应方法能够适应滴定剂和待测物质的化学性质和浓度范围。
化学实验教案酸碱滴定的滴定终点判定方法化学实验教案-酸碱滴定的滴定终点判定方法概述:酸碱滴定是一种常见的定量分析方法,通过滴加一种酸碱溶液到另一种酸碱溶液中,以确定两种溶液中一种的准确浓度。
而滴定终点的准确判定对于滴定的准确性至关重要。
本文将介绍几种常见的滴定终点判定方法,包括视觉指示剂法、pH计法和电导度法。
一、视觉指示剂法:视觉指示剂法是最常用的滴定终点判定方法之一。
通过向反应体系中加入某种指示剂,使其在滴定过程中发生颜色变化。
常用的指示剂包括酚酞、溴酚蓝、甲基橙等。
在滴定过程中,滴加的酸碱溶液会与指示剂发生反应,当反应接近中和点时,指示剂颜色会发生明显变化。
此时记录下滴定溶液的体积,即可判定滴定终点。
二、pH计法:pH计法是一种准确度更高的滴定终点判定方法。
它使用了一种称为pH计的仪器来测量溶液的酸碱性。
在滴定过程中,将pH计电极浸入溶液中,并通过监测溶液的pH值的变化来确定滴定终点。
当pH计显示的数值在一段时间内不再变化时,即可判断滴定终点。
相比于视觉指示剂法,pH计法更为准确,可以获得更精确的滴定终点。
三、电导度法:电导度法也是一种常用的滴定终点判定方法。
它通过测量溶液的电导率来判断滴定终点。
在滴定过程中,随着反应的进行,溶液中离子的浓度会发生变化,从而影响溶液的电导率。
当电导率发生显著变化时,即可判断滴定终点。
电导度法具有反应快速、结果准确等优点,但需要借助特定的电导计仪器才能进行。
总结:滴定终点判定方法在化学实验中起到了至关重要的作用。
视觉指示剂法简单易行,但准确性较低;pH计法准确度更高,能够提供更精确的滴定终点;电导度法反应迅速,结果较为准确。
根据具体实验需求和仪器设备的条件,选择合适的滴定终点判定方法进行实验,能够提高滴定结果的准确性。
注意事项:在进行酸碱滴定实验过程中,需要注意实验操作的仪器设备的准备、实验条件的控制以及滴定剂和被滴定液的配制等环节。
此外,对于需要进行准确测量的实验,建议采取多次实验取平均值的方法,以提高实验结果的可靠性。