电位滴定法的基本原理确定终点的方法PPT课件
- 格式:ppt
- 大小:2.40 MB
- 文档页数:8




电位滴定法确定滴定终点的方法一、电位滴定法的基本原理和适用范围电位滴定法是一种利用电化学方法进行分析的技术,它利用滴定过程中溶液中某些成分在电极表面发生氧化还原反应所产生的电位变化来判断滴定终点。
该方法适用于酸碱度、氧化还原性质及其他有关物质浓度的测定。
二、电位滴定法确定滴定终点的步骤1.制备溶液首先要准备好需要测试的溶液,可以是酸碱溶液或者其他需要测试的溶液。
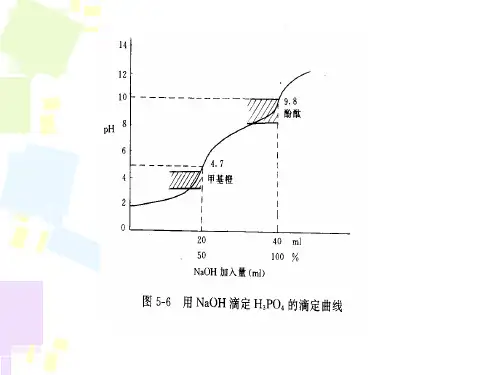
2.选择合适的指示剂根据需要测试的溶液选择合适的指示剂,不同指示剂对应不同pH值范围,如甲基橙适用于4.0-6.0 pH范围内,苯酚红适用于6.0-8.0 pH 范围内等。
3.调节pH值将待测溶液加入容量瓶中,加入少量指示剂,并使用标准盐酸或氢氧化钠调节pH值至指示剂变色前一个单位。
4.电极校准使用标准缓冲溶液进行电极校准,保证电极的准确性。
5.开始滴定将标准盐酸或氢氧化钠溶液加入待测溶液中,同时记录下电位计的读数。
6.观察指示剂变色随着滴定的进行,当滴定终点接近时,指示剂会发生颜色变化。
此时应该缓慢滴加滴定液,并注意观察指示剂颜色变化情况。
7.确定滴定终点当指示剂颜色发生明显变化时,应该停止滴定,并记录下此时电位计的读数。
这个读数就是滴定终点的电位值。
8.重复实验为了提高结果的准确性,可以重复实验多次,并取平均值作为最终结果。
三、注意事项1.在进行电位滴定法测量之前,应该对电极进行校准和清洗。
2.在调节pH值时应该使用标准缓冲溶液进行调节,以保证pH值的准确性。
3.在进行实验时应该注意控制滴加速度和稳定性,以避免误差产生。
4.在选择指示剂时要考虑其与待测溶液的相容性和准确性,以保证结果的准确性。
5.在进行实验时应该注意安全,避免化学品的直接接触和误食。
四、总结电位滴定法是一种快速、准确、易操作的分析方法,可以用于酸碱度、氧化还原性质及其他有关物质浓度的测定。
在进行实验时应该注意控制滴加速度和稳定性,并选择合适的指示剂。
通过多次重复实验并取平均值可以提高结果的准确性。


电位滴定确定终点的方法电位滴定是一种常用的化学分析方法,它通过测量电位的变化来确定化学反应的终点。
本文将介绍电位滴定的基本原理、仪器设备以及常用的终点确定方法。
一、电位滴定的基本原理电位滴定是利用电位计测量溶液中的电位变化,从而判断反应溶液中所含物质的浓度。
在电位滴定中,常用的电极有指示电极和参比电极。
指示电极用于检测溶液中所含物质的浓度变化,而参比电极则提供一个稳定的电位参考。
二、电位滴定的仪器设备电位滴定的仪器设备主要包括电位计、滴定管、磁力搅拌器和滴定管夹等。
电位计用于测量溶液中的电位变化,滴定管用于加入滴定剂,磁力搅拌器用于均匀搅拌反应溶液,滴定管夹用于控制滴定剂的滴定速度。
三、常用的终点确定方法1. 视觉指示剂法视觉指示剂法是最常用的终点确定方法之一。
在电位滴定过程中,加入一种能够与反应物发生显色反应的指示剂。
当滴定溶液接近终点时,指示剂会发生颜色的明显变化,此时停止滴定即可。
2. pH指示剂法pH指示剂法是通过测量溶液的pH值来确定终点的方法。
在电位滴定中,一般使用酸碱指示剂。
当滴定溶液接近终点时,溶液的pH 值会发生明显变化,此时停止滴定即可。
3. 电动势终点法电动势终点法是通过测量电位的变化来确定终点的方法。
在电位滴定过程中,当滴定剂与反应物完全反应时,溶液中所含物质的浓度发生明显变化,从而产生电位的跃变。
通过测量电位的变化,可以准确确定滴定终点。
4. 电导率终点法电导率终点法是通过测量溶液的电导率来确定终点的方法。
在电位滴定过程中,加入的滴定剂会与反应物发生反应,从而改变溶液的电导率。
当滴定终点达到时,电导率会发生明显变化,此时停止滴定即可。
5. 电流终点法电流终点法是通过测量电位滴定过程中的电流变化来确定终点的方法。
在电位滴定中,当滴定剂与反应物反应完全时,电流会发生明显变化。
通过测量电流的变化,可以准确确定滴定终点。
电位滴定是一种常用的化学分析方法,通过测量电位的变化来确定化学反应的终点。




电位滴定法的基本原理确定终点的方法电位滴定法是一种常用的化学分析方法,通过测定电位的变化来确定滴定反应的终点。
它的基本原理是利用电极对溶液中的化学物质的电位变化进行监测,当溶液中的物质滴定到化学计量比例时,发生了电位的剧烈变化,这时就可以确定滴定反应的终点。
首先,确定滴定物质和指示剂。
滴定物质是滴定过程中需要用来反应的物质,它可以是已知浓度的溶液,或者是固体物质与溶液的反应。
指示剂是一种对于滴定反应终点具有灵敏度的化学物质,它可以通过改变颜色、电位等方式来显示滴定反应终点。
其次,准备工作电极和参比电极。
工作电极是真正参与电位测定的电极,通常使用玻璃电极。
参比电极是用来提供一个稳定的电位参考的电极,常用的参比电极有饱和甘汞电极和饱和银氯化银电极。
然后,对待测溶液和滴定物的电位进行测定。
使用工作电极和参比电极对待测溶液和滴定物进行电势测定,记录相应的电位值。
接下来,开始滴定。
将滴定物缓慢地滴入待测溶液中,并同时记录电位的变化。
当滴定物的添加量接近滴定终点时,待测溶液中的化学反应会发生变化,进而导致电位值的剧烈变化。
最后,根据电位变化确定滴定反应终点。
根据记录的电位变化曲线,找到电位值发生突变的点,这个点对应的滴定物的体积即为滴定终点的体积。
除了基本的电位滴定法,还有一些特殊的方法可以用来确定滴定终点。
比如,使用自动滴定装置可以自动进行滴定,减少了人为因素的干扰;使用计算机软件可以对电位变化曲线进行进一步的处理和分析,提高分析的准确性。
总之,电位滴定法是一种准确、灵敏度高的化学分析方法,通过测定电位的变化来确定滴定反应的终点。
它在化学分析、药物分析等领域具有重要的应用价值。