(完整word版)滴定终点的判断
- 格式:doc
- 大小:162.00 KB
- 文档页数:2



第二节第3课时酸碱中和滴定[学习目标定位] 1.了解酸碱中和滴定的原理,熟记酸碱中和滴定的主要仪器的名称及用途。
2.掌握酸碱中和滴定的实验操作、计算方法和误差分析。
新课程探究一、酸碱中和滴定1.酸碱中和滴定的概念和原理(1)概念:是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。
(2)原理:在中和反应中,酸提供的H+与碱提供的OH-之间的物质的量相等。
即:c(H+)·V酸=c(OH-)·V碱,由此可计算c(H+),也可计算c(OH-)。
2.主要仪器及使用(1)仪器:滴定管,铁架台,滴定管夹,锥形瓶,烧杯。
仪器a是酸式滴定管,仪器b是碱式滴定管。
(2)滴定管的使用方法3.主要试剂(1)待测液;(2)标准液;(3)指示剂(一般用酚酞或甲基橙)。
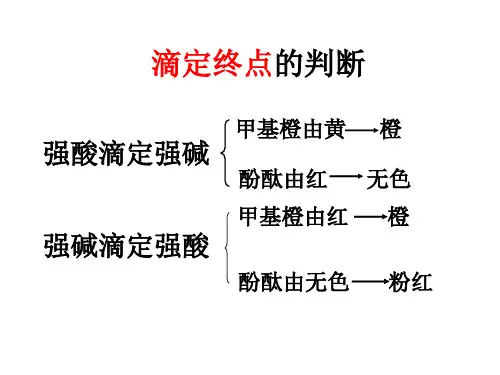
4.滴定操作(1)实验前的准备工作:(2)滴定:(3)滴定终点的判断:(以盐酸滴定氢氧化钠溶液为例,酚酞作指示剂)当滴入最后一滴盐酸时,溶液变为无色,且半分钟内不变色,即为滴定终点。
读数并记录。
5.数据处理为减少实验误差,滴定时,要求重复实验2~3次,求出所用标准溶液体积的平均值,然后再计算待测液的物质的量浓度。
纳总结酸碱中和滴定注意事项(1)准确判断滴定终点:最后一滴恰好使指示剂颜色发生明显的改变且半分钟内不变色,即为滴定终点。
(2)滴定操作要点:左手控制活塞或玻璃珠,右手摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化。
例1下列说法正确的是( )A.用图示仪器Ⅰ准确量取25.00 mL酸性KMnO4溶液B.装置Ⅱ可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验C.中和滴定时,滴定管用所盛装的待装液润洗2~3次D.中和滴定实验时,用待测液润洗锥形瓶答案 C例2用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。
称量时,样品可放在________(填字母)称量。



判断达到滴定终点的方法
滴定终点是指反应物与滴定试剂反应完全消耗的时刻。
判断是否达到滴定终点的方法有以下几种:
1. 颜色变化法:通常在滴定试剂与反应物发生反应后,会出现颜色变化,这时需要观察试液颜色的变化,当试液颜色从开始的颜色变为目标颜色时,即可判断为滴定终点。
2. 指示剂法:指示剂是一种可以随着滴定溶液中酸碱度的变化而发生颜色变化的物质。
在进行滴定时加入适当的指示剂,当溶液颜色发生变化时,即可判断为滴定终点。
3. 电位变化法:通过使用电极来测量溶液中的电位变化,当反应消耗完毕时,电位会发生明显变化,从而判断为滴定终点。
4. 热力学方法:通过测量反应的热力学参数,如热效应、焓变等来确定滴定终点。
以上几种方法可以单独或结合使用,根据实验要求和条件选择相应的方法判断滴定终点。



滴定终点的判断
一、前色、过渡色、后色。
1、前色:为滴加指示剂到样品溶液中呈现的颜色,即终点前颜色.
2、后色:滴定达到终点后的溶液颜色.
3、过渡色:当前色和后色共同存在时出现的复合色。
此时还有少量样品未被滴定。
二、滴定速度。
1、出现过渡色之前可以快滴,出现过渡色后应慢滴。
2、除非微量成分滴定,常规样品的慢滴也应逐滴滴加,不必半滴或四分之一滴的滴加。
三、终点判断。
1、接近终点:滴定到出现过渡色。
2、终点:前色全部消失.如果不能确定为终点,应先记录可疑终点时消耗标准溶液的体积。
继续滴定做以下验证。
(1)继续滴加1~2滴标准溶液到样品液中,溶液的颜色没有明显变化,可疑终点就是真正的终点,原记录有效。
(2)继续滴加1~2滴标准溶液到样品液中,溶液的颜色有明显的变化,可疑终点不是真正的终点,原记录无效。
应按本方法继续滴定,直到终点。
铬黑T指示剂前色铬黑T指示剂过渡色铬黑T指示剂后色。
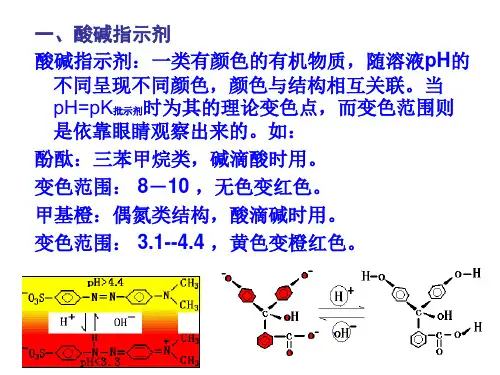
酸碱滴定终点判断方法酸碱滴定是化学实验中常见的一种分析方法,用于确定溶液中酸碱度的浓度。
在完成滴定时,准确判断滴定终点对于结果的准确性至关重要。
本文将介绍一些常用的酸碱滴定终点判断方法,帮助读者更好地理解和应用这些方法。
一、视觉指示剂法视觉指示剂法是最常见的酸碱滴定终点判断方法之一。
该方法利用颜色指示剂的颜色改变来确定滴定终点。
在酸碱滴定过程中,逐滴加入指示剂溶液,观察溶液颜色的变化,当颜色发生明显变化时,即可确定滴定终点。
常见的视觉指示剂包括酚酞、溴腈酚蓝等。
选择适合的指示剂要考虑滴定的酸碱性质和滴定剂的颜色变化范围。
注意,使用视觉指示剂时,要注意溶液的浅色和量的加入,以避免误判滴定终点。
二、电位滴定法电位滴定法是一种精确度较高的酸碱滴定终点判断方法。
该方法利用电位计测量滴定过程中溶液的电位变化,通过判断电位曲线的趋势来确定滴定终点。
在电位滴定法中,通常使用玻璃电极或参比电极连接到电位计上,将电位计设置到酸碱滴定溶液中,随着滴定剂的加入,溶液的电位发生变化。
当电位出现突变或变化速率发生显著变化时,即可确定滴定终点。
三、荧光滴定法荧光滴定法是一种利用荧光指示剂来判断滴定终点的方法。
该方法通过溶液的荧光强度的变化来确定滴定终点。
在荧光滴定法中,选择适合的荧光指示剂是关键。
荧光指示剂的选择要考虑滴定剂的反应特性以及荧光强度和滴定剂浓度之间的关系。
在滴定过程中,通过监测荧光强度的变化,当荧光强度明显变化时,即可确定滴定终点。
四、pH指示剂法pH指示剂法是一种基于溶液酸碱度(pH值)变化的酸碱滴定终点判断方法。
该方法通过测量溶液pH值的变化来确定滴定终点。
在pH指示剂法中,选择适合的pH指示剂非常重要。
pH指示剂的变色范围应与滴定剂的滴定终点pH值相匹配。
滴定过程中,持续测量溶液的pH值,当pH值发生突变或变化速率发生显著变化时,即可确定滴定终点。
综上所述,酸碱滴定的终点判断方法多种多样,根据实际情况选择适合的方法非常重要。
判断达到滴定终点的方法
达到滴定终点的方法取决于滴定反应本身的属性和所用指示剂的属性。
以下是一些常见的方法:
1. 颜色变化:许多指示剂在滴定过程中会发生颜色变化。
当颜色变化为滴定终点指定的颜色时,即可判断滴定终点已经达到。
2. 突变:某些滴定反应可能会在接近滴定终点时发生快速的反应。
这会导致溶液的某些性质(如电导率、pH、温度等)突
然发生变化,从而判断滴定终点已经到达。
3. 指示剂中峰:对于某些复杂的滴定反应,可以使用一种叫做指示剂中峰的方法。
该方法通过计算指示剂的吸光度,在某个特定波长(通常是滴定终点处指定的波长)出现高峰时判断滴定终点已经到达。
4. 突然降解:某些滴定反应可能会在接近滴定终点时迅速降解。
这会导致释放出气体或其他物质,从而可以判断滴定终点已经到达。
需要注意的是,滴定终点的判断应该主要依据滴定反应本身和指示剂的属性,而不是完全依赖于仪器和设备。
滴定终点的判断答题模板
对于滴定的终点的判断,有以下几种方法:
一、变色精确检测法
1. 按视觉变色判断标准:即观察试剂溶液颜色,当变色点靠近试剂滴定曲线尽头时,产生某种颜色变化时,宣布终点,并妥善记录滴定结果。
2. 光度比色法:即根据滴定液配制平行对照,用分光光度计测试,然后根据三者之间的比值来判断试剂滴定终点。
3. 酸度计法:即利用酸度计来直接测量pH的值,当pH值靠近滴定曲线尽头,宣布终点,并妥善记录滴定结果。
二、定量判断终点法
1. 重量比法:即在滴定液中添加指示剂,使滴定液的质量与某液体的质量成比例,当滴定液质量与该液体发生变化时,宣布终点,并妥善记录滴定结果。
2. 盐酸滴定法:即将滴定终点指示剂NaOH溶液滴定到滴定液,每滴
加入一定的量,比较每滴加入NaOH溶液的变化量,当每滴加入的NaOH溶液变化量稳定时,即宣布滴定终点。
三、定物质和定离子浓度判断终点
1. 定物质浓度法:即测定滴定液中物质的浓度,当浓度稳定时,宣布滴定结束。
2. 定离子浓度法:即通过酸度计或比色分析仪来测定滴定液中离子浓度,当离子浓度稳定时,宣布滴定结束。
滴定终点判定一、工业氰化钠:氰化钠含量(硝酸银法):用硝酸银标准滴定溶液滴定至刚出现混浊为终点。
二、熟石灰:氢氧化钙含量(酸碱滴定法):加酚酞指示剂,用盐酸标准滴定溶液滴定至溶液无色,并保持30秒为终点。
三、生石灰:氧化钙含量(酸碱滴定法):加酚酞指示剂,用盐酸标准滴定溶液滴定至溶液的粉红色显著消失,并保持30秒为终点。
四、石灰石:氧化钙含量(EDTA滴定法):用EDTA标准滴定溶液滴定至溶液由酒红色变为纯蓝色为终点。
五、工业氢氧化钠:1、氢氧化钠含量(酸碱滴定法):加酚酞指示剂,用盐酸标准滴定溶液滴定至微红色为终点。
2、氢氧化钠和碳酸钠含量(酸碱滴定法):加溴甲酚绿-甲基红混合指示剂,用盐酸标准滴定溶液滴定至酒红色为终点。
六、工业焦亚硫酸钠:焦亚硫酸钠含量(碘量法):用硫代硫酸钠标准滴定溶液滴定,近终点时加入淀粉指示剂,继续滴定至溶液蓝色消失即为终点。
七、硫酸铜:硫酸铜含量(碘量法):用硫代硫酸钠标准滴定溶液滴定,直至溶液呈现淡黄色(近终点),加入淀粉指示剂,继续滴定至溶液蓝色消失即为终点。
八、聚合硫酸铁:全铁含量/二价铁含量(重铬酸钾法):加二苯胺磺酸钠指示剂,用重铬酸钾标准滴定溶液滴定至紫色,30秒不褪即为终点。
九、黄药:黄药含量(碘量法):用碘标准滴定溶液滴定至溶液呈现淡黄色即为终点。
十、工业盐酸:盐酸含量((酸碱滴定法):加溴甲酚绿指示剂,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
十一、工业硝酸:硝酸含量((酸碱滴定法):加溴酚蓝指示剂,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝紫色为终点。
十二、工业硫酸:硫酸含量((酸碱滴定法):加甲基红—次甲基蓝指示剂,用氢氧化钠标准滴定溶液滴定至溶液呈灰绿色即为终点。
十三、水中自由氰:自由氰含量(硝酸银法):加试银灵指示剂,用硝酸银标准滴定溶液滴定至溶液由黄色变为橙红色即为终点。
十四、水中氯离子:氯离子含量(硝酸银法):加铬酸钾指示剂,用硝酸银标准滴定溶液滴定,直至出现砖红色为止。
如何确定滴定终点(共5篇)以下是网友分享的关于如何确定滴定终点的资料5篇,希望对您有所帮助,就爱阅读感谢您的支持。
电位滴定确定终点篇1实验四、电位滴定确定滴定终点方法研究一、实验目的1、掌握酸碱滴定基本原理2、掌握离子选择性电极作用原理3、掌握电位滴定确定滴定终点的方法4、标定盐酸溶液浓度(非指示剂法)二、实验原理化学分析法常用指示剂确定滴定终点,如酸碱指示剂、金属指示剂、氧化还原滴定指示剂等。
当某些滴定无法选择合适的指示剂或干扰因素较多时,可以不用指示剂,选择电位滴定方法确定滴定终点,最终完成定量计算。
本实验选择酸碱滴定,以盐酸滴定氢氧化钠为例,用电位滴定法计算盐酸溶液的准确浓度。
具体方法是:通过离子选择性电极,测定溶液的电动势E (mV) ,列出电动势E 随滴定剂体积V 的变化,列出E ~ V表,用cxcel 绘制E ~ V曲线,继续采取一阶微商、二阶微商数学方法处理(一阶微商△E/△V 中取绝对值最大值得到计量点所在的最小体积区间、二阶微商△2E /△V 2中用“内插法”取为0所对应的体积,即V ep ),最终得到终点时消耗盐酸溶液的体积,从而计算出盐酸溶液的准确浓度。
NaOH + HCl = NaCl + H2O【示例图:图1 E ~ V曲线图2 △E/△V ~ V曲线图3 △2E /△V 2 ~ V 曲线“内插法”计算示例:V 终点=24. 30+(24. 40-24. 30) ⨯4. 44. 4+5. 9】=24. 34mL三、实验仪器、药品仪器:+++++++型号磁力搅拌器(++++++公司)、+++++++型号酸度计(++++++公司)、托盘天平、复合电极、50mL 酸式滴定管、250mL 烧杯、100mL 烧杯、玻璃棒、500mL 试剂瓶(橡皮塞)、牛角匙、称量纸等。
药品:氢氧化钠(A.R )、盐酸(A.R )四、实验步骤1、0.1mol •L -1NaOH 溶液250mL 的配制与标定08应化2班:c mol •L -1 2、配制0.2mol •L -1HCl 溶液250mL 3、HCl 溶液浓度的标定(电位滴定)①近似滴定:准确移取50.00mLNaOH 溶液于100mL 烧杯中,放入搅拌子一颗,置于磁力搅拌器上,控制搅拌子搅拌速度。
滴定终点的判断
一、前色、过渡色、后色。
1、前色:为滴加指示剂到样品溶液中呈现的颜色,即终点前颜色。
2、后色:滴定达到终点后的溶液颜色。
3、过渡色:当前色和后色共同存在时出现的复合色。
此时还有少量样品未被滴定。
二、滴定速度。
1、出现过渡色之前可以快滴,出现过渡色后应慢滴。
2、除非微量成分滴定,常规样品的慢滴也应逐滴滴加,不必半滴或四分之一滴的滴加。
三、终点判断。
1、接近终点:滴定到出现过渡色。
2、终点:前色全部消失。
如果不能确定为终点,应先记录可疑终点时消耗标准溶液的体积。
继续滴定做以下验证。
(1)继续滴加1~2滴标准溶液到样品液中,溶液的颜色没有明显变化,可疑终点就是真正的终点,原记录有效。
(2)继续滴加1~2滴标准溶液到样品液中,溶液的颜色有明显的变化,可疑终点不是真正的终点,原记录无效。
应按本方法继续滴定,直到终点。
铬黑T指示剂前色铬黑T指示剂过渡色铬黑T指示剂后色。