第4节羧酸氨基酸和蛋白质
- 格式:doc
- 大小:1.54 MB
- 文档页数:51

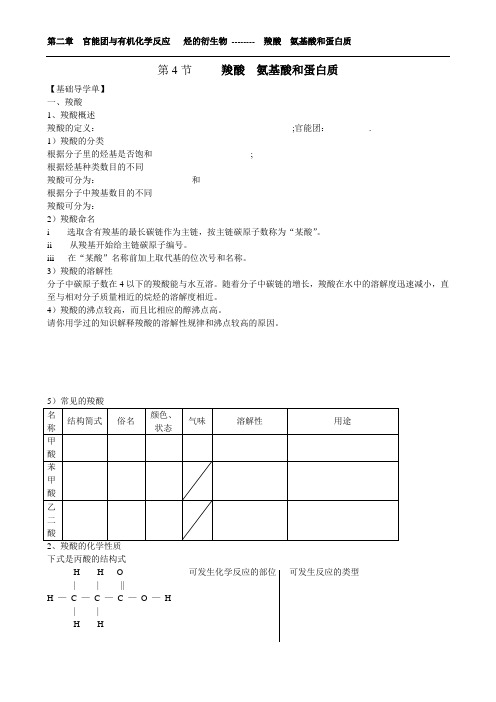
第4节羧酸氨基酸和蛋白质【基础导学单】一、羧酸1、羧酸概述羧酸的定义:____________________________________________;官能团:_________.1)羧酸的分类根据分子里的烃基是否饱和______________________ ; __________________________根据烃基种类数目的不同羧酸可分为:___________________ 和_____________________根据分子中羧基数目的不同羧酸可分为:______________ ________________________ _______________________2)羧酸命名i 选取含有羧基的最长碳链作为主链,按主链碳原子数称为“某酸”。
ii 从羧基开始给主链碳原子编号。
iii 在“某酸”名称前加上取代基的位次号和名称。
3)羧酸的溶解性分子中碳原子数在4以下的羧酸能与水互溶。
随着分子中碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
4)羧酸的沸点较高,而且比相应的醇沸点高。
请你用学过的知识解释羧酸的溶解性规律和沸点较高的原因。
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________5)常见的羧酸2、羧酸的化学性质下式是丙酸的结构式H H O 可发生化学反应的部位可发生反应的类型| | || ___________________________________________H — C —C —C —O —H| | ___________________________________________H H___________________________________________羧酸的化学性质_______________________________________________________________________________ 化学性质 化学反应举例 用途举例_______________________________________________________________________________酸性(具有酸的通性)_______________________________________________________________________________羟基被取代的反应_______________________________________________________________________________α—H 被取代的反应_______________________________________________________________________________还原反应_______________________________________________________________________________3、羧酸衍生物——酯知识支持:羧酸衍生物的定义:_____________________________________________________; 羧酸分子中的羧基去掉羟基后剩余的基团称为____________; 酰卤、酸酐、酰胺、酯。


羧酸、氨基酸和蛋白质一、羧酸羧酸是一类基本化合物,它们具有普遍的存在形式和功能。
羧酸是一类含有一个羧基的化合物。
羧基是由氢原子被羟基取代而成的。
羧基在化学反应中通常表现为一般的酸性,可以与碱反应生成盐和水,如下所示:R-COOH + NaOH → R-COONa + H2O羧酸可以通过很多方法制备,例如通过葡萄糖氧化而成的葡萄酸、柠檬酸、苹果酸,还有很多其他的有机酸,如甲酸和乙酸等。
二、氨基酸氨基酸是构成蛋白质的基本单元,其主链由一个氨基和一个羧基组成。
氨基酸由二元合成基础产生,其中一种基础是一种氨基酸,另一种是硫代氨基酸或一种醛酮,反应形成新的氨基酸。
这些氨基酸可以被单独通过氨基和羧基形成互补配对。
氨基酸的化学结构式如下: RCH(NH2)COOH,其中,R代表任意基团。
氨基酸的共轭结构如下:RCH(NH2)COO–+ H+ ↔ RCH(NH3+)COOH除了构成蛋白质的基本单元,氨基酸还有很多重要的生物化学作用。
它们可以是代谢产物和中间体,参与能量产生,包括尿素循环和谷氨酸循环。
一些氨基酸被用作糖原样品作为糖原的合成物和合成脂肪酸的原料。
三、蛋白质蛋白质是构成生物体的重要基本成分,每种蛋白质都有其特有的化学结构和功能。
所有的蛋白质都由氨基酸构成,此外,它们按不同的结构和函数分为几种不同的类型。
蛋白质具有极为复杂的结构和功能,它们在生物体中的作用非常广泛。
它们可以起到酶或抑制剂(酶在生物体中负责抑制危险元素和分解作用,抑制剂则起到反向控制酶的作用)、参与细胞结构等多种生物学作用。
此外,蛋白质也被广泛地应用于医学、工业和食品科学。
综上所述,羧酸、氨基酸和蛋白质是组成生物体重要的化学元素。
它们不仅在生物体的设备和维护中起到了关键的角色,同时,它们也被广泛地应用于医学、工业和食品科学等领域的研究中。

第2课时酰胺氨基酸和蛋白质A级必备知识基础练1.关于氨基酸的下列叙述不正确的是( )A.氨基酸是羧酸衍生物B.氨基酸都不能发生水解反应C.氨基酸是两性化合物,能与酸、碱反应生成盐D.天然蛋白质水解最终可以得到α-氨基酸、β-氨基酸等多种氨基酸2.在下列物质的浓溶液:①K2SO4②HCHO③Na2SO4④Hg(NO3)2⑤NH4Cl ⑥KOH,能使蛋白质盐析的是( )A.②④⑥B.①③⑤C.①②③D.④⑤⑥3.以下表示温度t与反应速率v的关系曲线中,有属于蛋白质的酶参加的是( )4.世界卫生组织(WHO)和世界粮农组织(FAO)联合发出警告,油煎和烘烤的食品中含有浓度严重超标的丙烯酰胺(CH2CHCONH2,简称丙毒),它是一种致癌物质。
下列有关丙烯酰胺的说法不正确的是( )A.丙烯酰胺能使溴水褪色B.丙烯酰胺分子内的所有原子不可能在同一平面内C.丙烯酰胺是一种氨基酸D.丙烯酰胺在一定条件下能水解生成CH2CHCOOH和NH35.下列物质中既能与NaOH溶液反应,又能与盐酸反应的一组是( )①②③④⑤A.只有②③⑤B.只有①④⑤C.只有①②③④D.①②③④⑤6.某天然蛋白质充分水解后,能分离出有机化合物R,R可与等物质的量的KOH或HCl完全反应。
4.45 g R可与50 mL 1 mol·L-1的NaOH溶液完全中和,则R的结构简式为( )A.B.C.D.7.营养品和药品都是保障人类健康不可缺少的物质,其性质和制法是化学研究的主要内容。
已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是。
(1)酪氨酸能发生的化学反应类型有(填字母)。
A.取代反应B.加成反应C.酯化反应D.中和反应(2)在酪氨酸的同分异构体中,同时满足下列三个条件的,除酪氨酸外还有种。
①属于氨基酸且“碳骨架”与酪氨酸相同;②羟基直接连在苯环上;③氨基(—NH2)不与苯环直接相连。
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:。

第4 节羧酸氨基酸和蛋白质(第1 课时)教材分析乙酸是学生比较熟悉的生活调味品。
从内容看,乙酸既是重要的烃的含氧衍生物,又是羧酸类物质的代表;从教材编排上看,乙酸编排在醇与酯之间,有着承上启下的作用,既是对醇知识的巩固、延续和发展,又是学好酯(油脂)类化合物的基础,将乙醇,乙酸,酯等编排在同一章节---《饮食中的有机化合物》,注意了由简单有机化合物到复杂有机化合物,便于学生的学习、知识的积累及迁移应用,不拘泥于原有的知识体系(单一的从官能团及其衍变进行展示),而是从生活中的营养物质切入具体有机化合物按“结构——性质——重要应用——回归人体中的作用”顺序展示,原有的知识内容隐含于教材,加强于习题。
教学目标1.了解常见羧酸的结构、特点及主要物理性质。
2.会用系统命名法命名简单的羧酸。
3.掌握羧酸的主要化学性质。
教学重点:乙酸的结构特点和主要化学性质。
教学难点:乙酸的酯化反应。
教学过程自主学习,反馈交流1.羧酸的含义分子由烃基(或氢原子)和羧基相连而组成的有机化合物。
羧酸的官能团是或—COOH。
饱和一元脂肪酸的通式为C n H2n O2(n≥1)或C n H2n+1COOH(n≥0)。
2.羧酸的分类依据类别举例烃基种类脂肪酸乙酸:CH3COOH芳香酸苯甲酸:羧基数目一元羧酸甲酸:HCOOH二元羧酸乙二酸:HOOC—COOH多元羧酸—烃基是否饱和饱和羧酸丙酸:CH3CH2COOH不饱和羧酸丙烯酸:CH2===CHCOOH3.羧酸的命名——系统命名法(1)选取含有羧基的最长碳链作为主链,按主链碳原子数称为“某酸”。
(2)从羧基开始给主链碳原子编号。
(3)在“某酸”名称之前加上取代基的位次号和名称。
如:名称为 4甲基3乙基戊酸。
4.羧酸的物理性质(1) 水溶性:分子中碳原子数在 4 以下的羧酸能与水互溶;随着分子中碳链的增长,羧酸在水中的溶解度迅速减小,直至与相对分子质量相近的烷烃的溶解度相近。
因为羧基是亲水基团,烃基是憎水基团, 随着碳链的增长,烃基的影响逐渐增大,决定了羧酸的水溶性。
第4节羧酸氨基酸和蛋白质第1课时羧酸[学习目标定位] 1.熟知羧酸的分类结构特点及其主要化学性质。
2.会比较羧基、羰基与羟基的性质差异。
1.乙酸的组成与结构乙酸的分子式C2H4O2,结构式为,结构简式为CH3COOH,官能团是—COOH。
2.乙酸的性质(1)乙酸俗名为醋酸,是一种无色液体,具有强烈的刺激性气味,易溶于水和乙醇。
(2)乙酸是一种弱酸,其酸性比碳酸的强,具有酸的通性。
在水中可以电离出H+,电离方程式为CH3COOH CH3COO-+H+。
(3)与酸碱指示剂作用,能使石蕊试液变红。
(4)与Mg反应的化学方程式为Mg+2CH3COOH―→(CH3COO)2Mg+H2↑。
(5)与CaO反应的化学方程式为CaO+2CH3COOH―→(CH3COO)2Ca+H2O。
(6)与Cu(OH)2反应的化学方程式为Cu(OH)2+2CH3COOH―→(CH3COO)2Cu+2H2O(7)与Na2CO3反应的化学方程式为Na2CO3+2CH3COOH―→2CH3COONa+CO2↑+H2O。
探究点一羧酸的概念1.分类:观察下列几种酸的结构简式填空:①乙酸:CH3COOH②硬脂酸:C17H35COOH③亚油酸:C17H31COOH④苯甲酸:C6H5COOH⑤乙二酸:HOOC—COOH(1)从上述酸的结构可以看出,羧酸可以看作是由羧基和烃基(或氢原子)相连而构成的化合物。
其通式可表示为R—COOH,官能团为—COOH。
(2)按不同的分类标准对羧酸进行分类:若按羧酸分子中烃基的结构分类,上述物质中的①②③⑤属于脂肪酸,④属于芳香酸。
若按羧酸分子中羧基的数目分类,上述物质中的①②③④属于一元酸,⑤属于二元酸。
按烃基的饱和程度分①②⑤属于饱和酸,③④属于不饱和酸。
2.物理性质(1)水溶性:分子中碳原子数在4个以下的羧酸能与水互溶。
随碳链增长,羧酸在水中的溶解度迅速减小。
(2)熔、沸点:比相同碳原子数的醇的沸点高,原因是羧酸分子之间更容易形成氢键。
3.常见的羧酸甲酸苯甲酸乙二酸俗名蚁酸安息香酸草酸结构HCOOH简式色、态、味无色液体白色针状晶体无色透刺激性气味易升华明晶体溶解性溶于水、有机溶剂微溶于水、易溶于有机溶剂溶于水、乙醇用途工业还原剂、消毒剂食品防腐剂化工原料(1)羧酸是羧基与烃基(或氢原子)相连形成的有机化合物,根据羧基数目、烃基的种类及烃基的饱和程度,可分为不同的类别。
受氢键影响,羧酸的熔、沸点与相应的醇相比较高。
(2)羧酸的命名与前面所学醇类、醛类相似。
饱和一元羧酸的通式可写成C n H2n O2或C n H2n+1COOH。
[活学活用]1.羧酸是一类非常重要的有机物,下列关于羧酸的说法中正确的是()A.羧酸在常温常压下均为液态物质B.羧酸的通式为C n H2n+2O2C.羧酸的官能团为—COOHD.只有链烃基与羧基相连的化合物才叫羧酸答案C解析A×常温常压下通常只有分子中含有10个碳原子以下的羧酸为液态,分子中含有10个碳原子以上的羧酸通常为固态。
B×饱和一元羧酸的通式为C n H2n O2。
C√羧酸的官能团为羧基,可写为—COOH或写为。
D×羧酸除包括链烃基与羧基相连的有机物外,环烃基、芳香烃基等与羧基相连得到的有机物均为羧酸。
A.苯、乙酸、四氯化碳B.乙醇、乙醛、乙酸C.乙醛、乙二醇、硝基苯D.苯酚、乙醇、甘油答案A解析A中苯、四氯化碳与水不互溶,苯密度小于水,四氯化碳密度大于水,乙酸与水互溶,故可鉴别;B中均与水互溶;C中乙醛、乙二醇与水互溶;D中乙醇、甘油与水互溶。
探究点二羧酸的化学性质1.羧酸的官能团羧基可以看成是由羰基和羟基组合而成,联系前面所学醇、醛、酮等知识,请在丙酸分子的结构式中标出可能发生化学反应的部位,并推测其可能发生的反应类型。
2.羧酸的化学性质(以丙酸为例)(1)羧酸中的羟基由于受碳氧双键影响,与醇、酚比较更容易断裂,在水溶液中可部分电离显弱酸性。
①与NaHCO 3反应:CH 3CH 2COOH +NaHCO 3―→CH 3CH 2COONa +H 2O +CO 2↑。
②与NH 3反应:(2)羟基的取代反应(C—O 断裂) ①与乙醇的酯化:②与NH 3反应(加热条件下生成酰胺,羟基被—NH 2取代): CH 3CH 2COOH +NH 3――→△CH 3CH 2CONH 2+H 2O 。
(3)αH(与官能团相邻的C—H)的取代反应 (在催化剂存在下与Cl 2反应αH 被取代):(4)羧基的还原反应一般情况下,羧基很难被还原,但强还原剂如氢化铝锂(LiAlH 4)可将羧基还原,羧酸还原为相应的醇。
CH 3CH 2COOH ――→LiAlH 4CH 3CH 2CH 2OH 。
[归纳总结](1)羧基由羰基和羟基组成,由于官能团之间的相互影响,使得羧酸的性质并不是羟基化学性质和羰基化学性质的简单相加。
(2)与醇羟基相比羧基中羟基上的氢原子更容易以离子形式电离出来,所以羧酸都有酸性。
(3)与醛、酮中的羰基相比羧基中的羰基较难发生加成反应,不能加氢生成羟基,只有遇到强还原剂才能发生还原反应。
[活学活用]3.某有机物结构简式为,则用Na 、NaOH 、NaHCO 3与等物质的量的该有机物恰好反应时,消耗Na 、NaOH 、NaHCO 3的物质的量之比为( ) A .3∶3∶2 B .3∶2∶1 C .1∶1∶1 D .3∶2∶2 答案 B解析 由题意和所学知识得出Na 能与羧基、醇羟基和酚羟基反应,NaOH 能与羧基和酚羟基反应,而NaHCO 3只能与羧基反应。
所以本题正确答案为B 。
理解感悟 醇、酚、羧酸的结构中均有—OH ,可分别称为“醇羟基”、“酚羟基”和“羧羟基”。
由于这些—OH 所连的基团不同,—OH 受相连基团的影响也就不同。
故羟基上的氢原子的活性不同,表现在性质上相差较大,羟基的活动性顺序:羧酸>酚>水>醇。
探究点三 乙酸乙酯的制备 1.按下列实验步骤,完成实验。
在一试管中加3 mL 乙醇和2 mL 乙酸的混合物,然后边摇动试管边慢慢加入2 mL 浓硫酸,加入2~3块碎瓷片,按下图所示连接好装置。
用酒精灯小心均匀地加热试管3~5 min ,产生的蒸气经导管通到饱和碳酸钠溶液的液面上。
(1)观察到的现象是在饱和的碳酸钠溶液的上方有无色透明的油状液体产生,并可闻到香味。
(2)由实验得出的结论是在浓硫酸存在、加热的条件下,乙酸和乙醇发生酯化反应,生成无色、透明、不溶于水,且有香味的乙酸乙酯。
2.上述实验中反应的化学方程式为CH3COOH+C2H5OH浓H2SO4CH3COOC2H5+H2O。
△3.实验思考:(1)浓H2SO4的作用是催化剂和吸水剂。
(2)导气管末端不能浸入饱和Na2CO3溶液的原因是防止受热不均发生倒吸。
(3)饱和Na2CO3(aq)的作用是①吸收未反应的乙酸和乙醇;②降低乙酸乙酯的溶解度,有利于分层。
[归纳总结](1)酯化反应的原理羧酸与醇发生酯化反应时,一般是羧酸分子中的羟基与醇分子中羟基上的氢原子结合生成水,其余部分结合生成酯,用示踪原子法可以证明。
(2)无机酸也可以和醇发生酯化反应。
[活学活用]4.CH3C18OOH在水溶液中存在平衡:当CH3C18OOH与CH3CH2OH发生酯化反应时,不可能生成的产物是()C.H2O D.H182O答案B解析因乙酸在水溶液中存在平衡,故有两种形式:与乙醇、浓硫酸共热时发生酯化反应:故B不可能。
醇、酚、羧酸中羟基性质的比较含羟基的物质醇酚羧酸比较项目1.确定乙酸是弱酸的依据是()A.乙酸可以和乙醇发生酯化反应B.乙酸钠的水溶液显碱性C.乙酸能使石蕊试液变红D.Na2CO3中加入乙酸产生CO2答案B解析乙酸钠的水溶液呈碱性,说明乙酸钠是强碱与弱酸形成的盐。
2.关于乙酸的下列说法不正确的是()A.乙酸是一种具有强烈刺激性气味的液体B.乙酸分子中含有四个氢原子,所以乙酸是四元酸C.无水乙酸又称冰醋酸,它是纯净物D.乙酸易溶于水和乙醇答案B解析羧酸是几元酸是根据分子中所含羧基的数目来划分的,一个乙酸分子中只含有一个羧基,故为一元酸。
3.下列化合物中,既显酸性,又能发生酯化反应和消去反应的是()答案C解析根据分子中所含的各种官能团的性质判断。
4.有机物A的结构简式是,下列有关A的性质的叙述中错误的是() A.A与金属钠完全反应时,两者物质的量之比是1∶3B.A与氢氧化钠完全反应时,两者物质的量之比是1∶3C.A能与碳酸钠溶液反应D.A既能与羧酸反应,又能与醇反应答案B解析A中有醇羟基、酚羟基、羧基,三者均能与钠反应,故1 mol A能与3 mol钠反应,A不符合题意;B选项中A中的酚羟基、羧基中的羟基能与氢氧化钠反应,故1 mol A能与2 mol氢氧化钠反应,符合题意;C选项中A中的酚羟基、羧基中的羟基能与碳酸钠溶液反应,不符合题意;D选项中A含醇羟基,能与羧酸发生酯化反应,含羧基,能与醇发生酯化反应,不符合题意。
5.酸牛奶中含有乳酸,其结构简式为。
高级动物和人体的无氧呼吸可产生乳酸。
(1)乳酸可能发生的反应是________(填序号)。
①取代反应②酯化反应③水解反应④消去反应⑤聚合反应⑥中和反应(2)两分子乳酸在不同条件下可形成链状酯和六元环酯,它们的结构简式分别为________、________。
[基础过关]一、羧酸的结构及分类1.下列有关乙酸结构的表示或说法中错误的是()A.乙酸的比例模型为B.乙酸分子中所有原子均位于同一平面上C.乙酸的结构简式为CH3COOH,官能团名称为羧基D.乙酸分子中既存在极性键又存在非极性键答案B解析乙酸分子中含有甲基,因此所有原子不可能共平面。
2.从分类上讲,属于()①脂肪酸;②芳香酸;③一元酸;④多元酸A.①②B.②③C.②④D.①③答案B二、羧酸的性质3.要使有机化合物转化为,可选用的试剂是()A.Na B.NaHCO3C.NaCl D.NaOH答案B解析酸性强弱顺序为—COOH>H2CO3>>HCO-3,NaHCO3仅能与—COOH反应生成—COONa,不能和酚羟基反应。
4.下列物质中肯定不能与乙酸发生化学反应的是()A.新制的Cu(OH)2悬浊液B.乙二醇C.氯化钙D.苯酚钠答案C解析乙酸具有酸的通性,能发生酯化反应,但不能与强酸盐CaCl2反应。
5.某同学在学习了乙酸的性质后,根据甲酸的结构()对甲酸的化学性质进行了下列推断,其中不正确的是()A.能与碳酸钠溶液反应B.能发生银镜反应C.不能使KMnO4酸性溶液褪色D.能与单质镁反应答案C解析甲酸分子中含有醛基和羧基两种官能团,具有醛与羧酸的双重性质。
6.1 mol X能与足量碳酸氢钠溶液反应放出44.8 L CO2(标准状况),则X的分子式是() A.C5H10O4B.C4H8O4C.C3H6O4D.C2H2O4答案D解析 1 mol X能与足量碳酸氢钠溶液反应放出44.8 L CO2(标准状况),说明X中含有2个—COOH,饱和的二元羧酸的通式为C n H2n-2O4,符合此通式的只有D项。