变应性支气管肺曲霉病的诊治
- 格式:pdf
- 大小:283.24 KB
- 文档页数:2







变应性支气管肺曲霉病诊断指标探讨变应性支气管肺曲霉病是烟曲霉过敏引起的一种变应性肺部疾病,哮喘患者中ABPA发生率约为2.5%。
1977年Rosenberg及Patterson首次提出了ABPA的7条主要诊断标准。
2013年国际人类及动物真菌学会对既往诊断标准进行了梳理,确定了主要诊断标准和次要诊断标准。
2016年Agarwal又在ISHAM标准的基础上,提出了新的ABPA诊断评分系统,对不同的诊断条目赋予了相应的权重。
2017年中华医学会呼吸病学分会哮喘学组结合我国实际情况,制定了《变应性支气管肺曲霉病诊诊治专家共识》,并于2022年进行更新,提高了我国ABPA的诊治水平。
目前多数诊断标准中包括基础疾病、免疫检测、影像学、病理学检查四方面内容,本文就上述ABPA诊断指标临床意义进行探讨,了解其变迁有助于提高对ABPA诊断的认识,减少误诊和漏诊。
一、基础疾病基础疾病是ABPA诊断的基石,ABPA最早见于对曲霉菌过敏的支管哮喘患者。
后来发现类似的临床表现也可见于囊性纤维化患者,因此目前多数ABPA诊断标准中将支气管哮喘及CF列为ABPA 的主要基础疾病。
然而Ishguro等发现符合ABPA病理诊断的患者中约41%不伴有CF及哮喘,公丕平等统计国内病例报道的ABPA 患者中20%无哮喘病史,其他结构性肺病如慢性阻塞性肺疾病(简称慢阻肺)、非CF支气管扩张均可继发ABPA,气道清除能力下降所致曲霉菌定植生长可能是此类患者继发ABPA的机制。
2016年Agarwal等提出的诊断标准及2017、2022年中国专家共识中将慢阻肺、纤维空洞性肺结核、支气管扩张等结构性肺病列入诊断标准。
对于原发病控制不佳的慢阻肺、支扩等患者应定期监测血常规、IgE,及时筛查ABPA相关指标,避免延误诊断。
二、免疫检测1. 血清总IgE:tIgE升高是ABPA患者的重要特征,tIgE水平在ABPA、真菌致敏性严重哮喘以及慢性空洞性肺曲霉菌病患者中存在明显差别,因此tIgE是诊断ABPA的重要指标。

变应性支气管肺曲霉病的诊治变应性支气管肺曲霉病(a11ergic bronchopulmonary aspergillosis, ABPA)是一种非感染性、炎症性肺部疾病,以机体对寄生于支气管内的曲霉发生变态反应为主要特征[1]。
该病于1890年初次报道,1952年Hinson等[2]在哮喘患者中发现并病名,此后多为学者对该病进行了详细描述。
ABPA不常见,但近年来肺曲霉菌病的发病率呈上升趋势,已成为仅次于念珠菌病的主要肺部真菌感染性疾病。
一、发病机制健康人由于有支气管黏膜-上皮屏障功能、黏液纤毛清除功能和肺泡n噬细胞的吞噬作用,不会引起ABPA。
ABPA是机体对曲霉菌抗原的过敏反应,是I型和Ⅲ型变态反应的联合作用。
大量孢子被机体吸入后,在支气管树的黏液中长期定制并长出菌丝。
霉菌毒素可抑制吞噬细胞的活性,阻碍其对烟曲霉菌的吞噬,使烟曲霉菌在气道内定居。
烟曲霉菌抗原可激活T淋巴细胞,增强IL.4、IL-5的基因表达,引起血清总IgE和烟曲霉菌特异性抗体升高以及局部嗜酸性粒细胞、单核细胞的大量浸润,导致气道壁及周围肺组织炎症反应,最终出现支气管痉挛,腺体分泌增多等一系列病理改变[3]。
早期主要表现为支气管壁大量单核细胞和嗜酸性细胞浸润,但不发生组织侵袭。
以后出现黏液嵌塞、中心性支气管扩张和嗜酸细胞性肺炎,进一步发展为慢性细支气管炎和非干酪性支气管肉芽肿,晚期则出现广泛肺纤维化。
[4]二、临床表现对曲霉过敏者吸入大量孢子后,阻塞小支气管,引起短暂的肺不张和喘息的发作,亦可引起肺部反复游走性浸润。
患者喘息、畏寒、发热、乏力、刺激性咳嗽、咳棕黄色浓痰,偶带血。
喘息发作时双肺多可闻及哮鸣音,局部可闻及湿啰音,晚期多有紫绀及杵状指。
临床上复发与缓解常交替出现。
痰中有大量嗜酸性粒细胞及曲霉丝,烟曲霉培养阳性。
哮喘样发作为其突出的临床表现,一般解痉平喘药难以奏效,外周嗜酸性粒细胞增多。
典型X线胸片为上叶短暂性变实或不张,可发生于双侧。


变应性支气管肺曲霉病诊治专家共识(最全版)变应性支气管肺曲霉病(allergic bronchopulmonary aspergillosis, ABPA)是烟曲霉致敏引起的一种变应性肺部疾病,表现为慢性支气管哮喘(简称哮喘)和反复出现的肺部阴影,可伴有支气管扩张。
该病相对少见,临床上常被误诊或漏诊[1];而早期诊断、及时给予全身糖皮质激素(简称激素)治疗,可控制病情,防止不可逆性肺部损害的发生[2,3]。
少见情况下,其他真菌也可引起与ABPA相似的表现,统称变应性支气管肺真菌病(allergic bronchopulmonary mycosis, ABPM)。
近年来ABPA逐步引起我国临床医师重视,病例资料不断见诸报道[4,5,6,7,8],但由于该病临床表现多样,诊断标准不一,且需要特殊的实验室检查,临床上存在诊断不及时、治疗不规范等情况。
为了进一步提高ABPA的诊断和治疗水平,推动相关领域的临床研究,中华医学会呼吸病学分会哮喘学组有关专家在充分复习文献,掌握国内外相关研究进展的基础上,结合我国实际情况,讨论制定本专家共识。
第一部分流行病学ABPA较常发生于哮喘患者,研究显示ABPA在哮喘中所占比例为1.0%~3.5%[9]。
国内研究发现在连续就诊的哮喘患者中 2.5%为ABPA[10]。
一项系统性综述结果显示,在就诊于呼吸专科或哮喘专科的哮喘患者中,ABPA的比例可达12.9%[11]。
除哮喘外,ABPA还可见于其他疾病。
在欧美国家,肺囊性纤维化并发ABPA相对多见,病例汇总后所得患病率为8.9%[12]。
此外,ABPA还可发生于其他肺部疾病患者,例如支气管扩张[13]、慢性阻塞性肺疾病等[14,15,16]。
第二部分临床表现ABPA多于哮喘诊断多年后发病,但也可见于新发哮喘。
与其他过敏性疾病常见于儿童不同,ABPA发病率在成年人最高[2]。
由于临床对该病认识不足,常被漏诊,往往发展至晚期出现不可逆性结构改变才得以确诊。
临床变应性支气管肺曲霉病诊断、疾病分期、药物治疗及诊治方案变应性支气管肺曲霉病是烟曲霉所致的变应性肺病。
烟曲霉特异性IgE所致的I型超敏反应,以及特异性IgG介导的III型超敏反应是ABPA的病因之一。
ABPA患者可表现为慢性咳嗽、咳痰、喘息、胸闷,存在支气管扩张者,可出现咯血。
ABPA在哮喘中的发病率为1%-3.5%。
此外,在支气管扩张症、囊性纤维化(CF)、慢性阻塞性肺疾病(COPD)患者中,亦可合并ABPA。
对于ABPA,早期医疗干预可改善临床症状。
相反的是,若未及时就医或病情进展迅速者,肺功能严重恶化、可出现肺纤维化,严重影响患者生活质量。
诊断诊断ABPA涉及肤试验、血清学、痰液检查、胸部影像学等多个实验室检查项目。
皮肤试验。
包括皮内实验、点刺试验,其中皮内试验敏感性更高。
血清学检查总IgE>1000U/ml(1U/ml=2.4ng/ml)可用于疾病诊断。
临床治疗有效的ABPA病例,患者总IgE数值有下降;若患者总IgE水平出现明显回升,提示疾病复发可能。
sIgE>0.35kUA/L(A为变应原)提示曲霉致敏和ABPA可能。
sIgG是诊断ABPA的辅助指标。
诊断ABPA的血清sIgG临界值因检测方法而异,其中ImmunoCAP荧光免疫法检测的临界值为>27mgA/L。
血嗜酸性粒细胞计数ABPA常伴有外周血嗜酸性粒细胞计数升高,但特异性不高。
因血嗜酸性粒细计数无法预测肺部嗜酸性粒细胞的浸润程度。
为此,血嗜酸性粒细胞增多只作为ABPA辅助诊断指标,其临界值为>0.5×109个/L。
痰液检查痰涂片或培养发现曲霉菌丝,可用于ABPA的诊断。
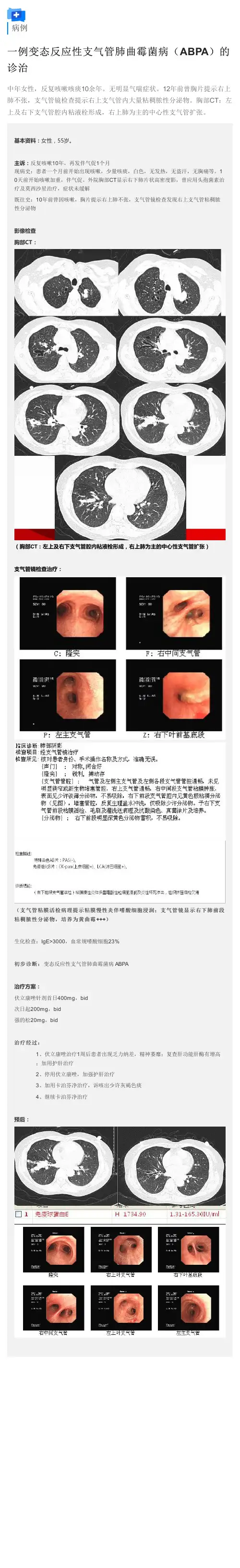
胸部影像学ABPA患者胸部高分辨率CT可见中央型支气管扩张、气管内黏液阻塞,肺部病灶可从肺门向外延伸而形成“指套征”。
肺功能。
肺功能可评估ABPA患者的通气功能,当第一秒用力呼气量(FEV1)/用力肺活量(FVC)<70%、FEV1 <80%预测值,则表明患者存在阻塞性通气功能障碍。
变应性支气管肺曲霉病的诊治
发表时间:2013-11-13T13:13:41.170Z 来源:《医药前沿》2013年第29期供稿作者:田路军何淑敏[导读] 对曲霉过敏者吸入大量孢子后,阻塞小支气管,引起短暂的肺不张和喘息的发作,亦可引起肺部反复游走性浸润。
田路军何淑敏(山东省桓台县人民医院 256400)【中图分类号】R563 【文献标识码】A 【文章编号】2095-1752(2013)29-0142-02变应性支气管肺曲霉病(a11ergic bronchopulmonary aspergillosis, ABPA)是一种非感染性、炎症性肺部疾病,以机体对寄生于支气管内的曲霉发生变态反应为主要特征[1]。
该病于1890年初次报道,1952年Hinson等[2]在哮喘患者中发现并病名,此后多为学者对该病进行了详细描述。
ABPA不常见,但近年来肺曲霉菌病的发病率呈上升趋势,已成为仅次于念珠菌病的主要肺部真菌感染性疾病。
一、发病机制
健康人由于有支气管黏膜-上皮屏障功能、黏液纤毛清除功能和肺泡n噬细胞的吞噬作用,不会引起ABPA。
ABPA是机体对曲霉菌抗原的过敏反应,是I型和Ⅲ型变态反应的联合作用。
大量孢子被机体吸入后,在支气管树的黏液中长期定制并长出菌丝。
霉菌毒素可抑制吞噬细胞的活性,阻碍其对烟曲霉菌的吞噬,使烟曲霉菌在气道内定居。
烟曲霉菌抗原可激活T淋巴细胞,增强IL.4、IL-5的基因表达,引起血清总IgE和烟曲霉菌特异性抗体升高以及局部嗜酸性粒细胞、单核细胞的大量浸润,导致气道壁及周围肺组织炎症反应,最终出现支气管痉挛,腺体分泌增多等一系列病理改变[3]。
早期主要表现为支气管壁大量单核细胞和嗜酸性细胞浸润,但不发生组织侵袭。
以后出现黏液嵌塞、中心性支气管扩张和嗜酸细胞性肺炎,进一步发展为慢性细支气管炎和非干酪性支气管肉芽肿,晚期则出现广泛肺纤维化。
[4]
二、临床表现
对曲霉过敏者吸入大量孢子后,阻塞小支气管,引起短暂的肺不张和喘息的发作,亦可引起肺部反复游走性浸润。
患者喘息、畏寒、发热、乏力、刺激性咳嗽、咳棕黄色浓痰,偶带血。
喘息发作时双肺多可闻及哮鸣音,局部可闻及湿啰音,晚期多有紫绀及杵状指。
临床上复发与缓解常交替出现。
痰中有大量嗜酸性粒细胞及曲霉丝,烟曲霉培养阳性。
哮喘样发作为其突出的临床表现,一般解痉平喘药难以奏效,外周嗜酸性粒细胞增多。
典型X线胸片为上叶短暂性变实或不张,可发生于双侧。
中央支气管扩张征像如“戒指症”和“轨道征”。
由于有不同程度的支气管扩张和大量的黏液栓形成,ABPA患者常会发生反复的细菌感染。
三、辅助检查
1.实验室检查:外周血嗜酸粒细胞计数升高(比例≥8%或计数≥n6×109/L)。
血清IgE和IgG升高。
IgG和总IgE升高是疾病活动的敏感指标,其中血清总IrE与病情活动程度密切相关。
痰栓直接显微镜检查或染色后镜检可发现菌丝,也常见到嗜酸性粒细胞。
2.影像学:急性期的肺浸润可呈一过性、持续性,以肺上叶为多见,也可累及中、下肺叶。
慢性期可表现为黏液填塞或病变气道内的分泌物所致的中央型支气管扩张,常为近端支气管呈柱状或囊状扩张,远端支气管可正常,表现为牙膏征、手套征和平行线阴影(parallel line)等。
特征性的中央型支气管扩张对诊断ABPA有重要意义[5]。
3.纤维支气管镜:ABPA引起的病变主要在细支气管腔内,可有肉芽肿或伴有干酪样坏死物产生,纤维支气管镜能提示为曲霉菌感染的征象是质地硬的肿块、干酪样坏死物和黄色分泌物,可表现为新月形、圆形息肉样物堵塞支气管,表面不光滑[6]。
四、诊断标准
2008年美国感染病协会制定的诊断标准分为:主要标准:(1)发作性支气管哮喘;(2)外周血嗜酸性粒细胞增多;(3)曲霉抗原皮内实验呈速发阳性反应;(4)血清曲霉变应原沉淀抗体阳性;(5)血清总IgE升高;(6)肺内浸润影(游走性或固定渗出);(7)中心性支气管扩张。
次要标准:(1)多次痰涂片或曲霉培养阳性;(2)咳褐色痰栓;(3)血清曲霉特异性IgE抗体增高;(4)曲霉变应原迟发型皮肤反应阳性。
符合两项主要标准及两项次要标准即可确诊。
最近,美国囊性纤维化基金会制定了囊性纤维化患者ABPA的诊断标准:(1)支气管哮喘发作;(2)烟曲霉变应原速发性皮肤试验阳性;(3)血清总IsE浓度增高(>1 mg/L);(4)血清烟曲霉变应原沉淀抗体阳性;(5)肺部影像学有异常表现(浸润影、黏液栓等)。
五、治疗
ABPA治疗的主要目的是保护气道和肺组织的正常结构及功能,包括控制急性症状、抑制机体对曲霉抗原的变态反应、在曲霉定植于气道内前将其清除。
1、激素:目前激素治疗方案尚不统一。
常用的方案为急性期应用泼尼松40-60mg/d。
症状与影像学表现改善后,减量至0.5mg/Kg,隔日1次,维持3个月,并在3个月内逐渐减量(每2周减5mg) 至终止用药。
对传统反应差的患者可短期内静脉使用甲泼尼龙。
可以有效减少肺渗出及痰液生成,降低嗜酸粒细胞水平[7]。
2、抗真菌药物:激素治疗的同时加用抗真菌药物可清除支气管内真菌,减轻炎症反应,降低激素的用量及改善肺功能。
目前推荐口服伊曲康唑200mg,bid,持续使用16周[8]。
伏立康唑可作为二线的抗真菌药物[9]。
ABPA是一种少见病,临床表现不典型,极易漏诊,常被误诊为肺结核、过敏性肺炎及细菌性肺炎等而错过治疗良机,这与医务人员对该病的认识不足、未及时进行相关检查及基层医院条件有限有关。
全面、认真掌握ABPA的相关特点,能够避免我们进入诊断的误区。
参考文献
[1] Patterson R, Greenberger PA, Roberts ML. Allergic bronehopulmonary aspergillosis. Providence, RI:Oceanside Publications, 1995:l-3.
[2] Hinson KF,Moon AJ,PIumnler NS.Bronchopulmonary.Aspergillosis: a review and a report of eight new cases. Thorax.1952.7:317-333.
[3]周新.肺曲菌病的分类和实验室诊断.中国感染与化疗杂志,2007,7:425-427.
[4] Gibson PG. Allergic brenchopulmonary ospergillosis. SeminRespir Crit Care Med. 2006,27:185-191.
[5] 刘莉,关玉宝,曾庆思等.变态反应性支气管肺曲菌病的影像学表现.放射学实践,2008,23:396-399.
[6] 周玉皆.纤支镜对以支气管肉芽肿为表现的肺曲菌病的诊断价值.中国内镜杂志,2002,8:101-103.
[7] Thomson JM, Wesley A, Bymes CA, et al.Plulse intravenous methylprednisolone for resistant allergic bronchopulmonary aspergillosis in cystic fibrosis. Pediatr Pulmonol, 2006,4l:164-170.
[8] Wark PA,Gibson PG, Wilson AJ. Azoles for allergic bronchopulmonary aspergillosis associated with asthma.Cochrane Database Syst Rev,2004,3:CD001108.。