物质的溶解性曲线图
- 格式:ppt
- 大小:1.20 MB
- 文档页数:18



章节测试题1.【综合题文】以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物(其中氯化钠和氯化钾的质量和小于总质量的3%)中分离出硝酸钾的实验步骤:(三种物质的溶解度曲线见下图)Ⅰ.用托盘天平称得样品的总质量为87.5g;Ⅱ.配制成80℃左右的饱和溶液;Ⅲ.将热饱和溶液冷却至室温(20℃)后进行过滤,并用少量水洗涤2—3次;Ⅳ.取出过滤器中的固体,干燥后分装。
请回答以下问题:【答题】用天平称取87.5g样品时,砝码应放在天平的______盘。
【答案】右【分析】根据托盘天平的正确使用方法分析即可。
【解答】用托盘天平称量物体时应遵循左物右码的原则,故答案为右。
【答题】某同学发现,无论将称量物还是砝码放置于托盘中时,天平均不发生偏转,原因是______A.天平未放置于水平桌面上B.天平没有调零C.托盘下的垫圈未取下D.游码未归零【答案】C【分析】根据托盘天平的正确使用方法分析即可。
【解答】天平在使用前应先把托盘下的垫圈取下,不然会出现无论将称量物还是砝码放置于托盘中时,天平均不发生偏转。
故选C。
【答题】将这些样品制成80℃左右的热饱和溶液,约需______水(填序号)。
A.12.5mLB.50 mLC.100 mLD.112.5mL【答案】B【分析】根据表格中硝酸钾在80℃的溶解度去计算【解答】从表格数据中得到80℃时硝酸钾的溶解度大约是170g,所以溶解大约87.5g的硝酸钾用水量≈≈51mL。
故选B。
【答题】该实验中,玻璃棒除了用于搅拌和引流外,还用于______。
【答案】转移固体【分析】根据实验操作中玻璃棒的各种用途去分析。
【解答】当过滤结束后,含需要把滤纸上的晶体取下来放到其它容器中,此时就要用到玻璃棒,故答案为:转移固体。
【答题】步骤Ⅲ中,只能用少量水洗涤固体的原因是______。
【答案】因晶体易溶于水,洗涤用水越少,晶体质量损失越小【分析】洗涤可溶性物质时应该用少量水去洗涤。
【解答】过滤结束后还需要把晶体表面的离子洗去,但洗涤时不能用水太多,因为此晶体是可溶性的,若用水太多,会损失的晶体较多,故答案为;因为晶体易溶于水,洗涤晶体时用水越少,晶体损失越少。

1.5物质的溶解——溶解性与溶解度习题分类集训一、影响物质溶解性的因素1.(2021八上·淳安期末)下列措施中,能够增强蔗糖在水中溶解性的是()A.加热B.搅拌C.增加水量D.将蔗糖研碎2.(2021八上·义乌月考)小明想要尽快得到一杯蔗糖水,下列方法可以采取的是()①冷水中溶解蔗糖;②热水中溶解蔗糖;③将蔗糖研碎;④搅拌A.③④B.①②④C.①③④D.②③④3.(2021八上·浙江期中)物质的溶解性受很多因素的影响,下列会影响固体物质溶解性的一组是()①溶质的性质②溶剂的性质③温度④压强A.①B.①②C.①②③D.①②③④4.某同学往一杯水中加了三勺蔗糖,搅拌后发现蔗糖全部溶解,在相同条件下三勺食盐却不能全部溶解。
这说明物质的溶解能力与( )有关。
A.温度高低B.物质本身的性质C.水的多少D.时间的长短5.(2021八上·余杭月考)在《饱和溶液》这一课的演示实验时,老师先往一试管中加入1小匙蔗糖,然后加入10mL 的水,接下来的操作正确的是( )A.B.C.D.6.(2020八上·西湖期末)如图,两个实验的目的均是探究影响物质溶解性的因素,下列说法不正确的是()A.实验一研究的变量是温度B.实验一可以得到温度会影响硝酸钾的溶解性C.实验二目的是探究溶剂种类对物质溶解性的影响D.实验二中氯化钠的颗粒大小必须相同7.(2021八上·江干期末)用下表中三个实验对溶液相关知识进行探究(实验中溶质均完全溶解),下列说法正确的是()实验序号实验(1) 实验(2) 实验(3)冰糖(2g) 粉末块状粉末水冷水50mL 热水50mL 热水50mLA.实验(3)的溶液一定是不饱和溶液B.对比实验(2)和(3),可探究固体溶质的形态对溶质在水中溶解速率的影响C.对比实验(1)和(3),可探究水的体积对溶质在水中溶解速率的影响D.对比实验(1)和(2),可探究水的温度对溶质在水中溶解速率的影响8.(2020八上·拱墅期末)若要研究温度对蔗糖溶解快慢的影响,应对比()A.甲和乙B.乙和丙C.甲和丙D.丙和丁9.(2021八上·义乌月考)下列关于物质溶解性的叙述不正确的是()A.不同的物质在同一溶剂中溶解性不同B.同一种物质在不同溶剂中的溶解能力不同C.同一种物质在同一溶剂中的溶解能力与温度有关D.物质的溶解性与使用的溶质与溶剂的质量都有关系10.(2021八上·余杭月考)下列有关物质的溶解性的说法中错误的是( ) A.在一定条件下,物质能够溶解的数量是有限的B.相同条件下,不同物质的溶解能力是不同的C.气体也能溶解在液体中,且温度越高,气体溶解能力越强D.物质溶解时,有的放热,有的吸热11.在20℃时,100克水中最多能溶解0.165克氢氧化钙,由此可知,氢氧化钙在水中的溶解性为( )。
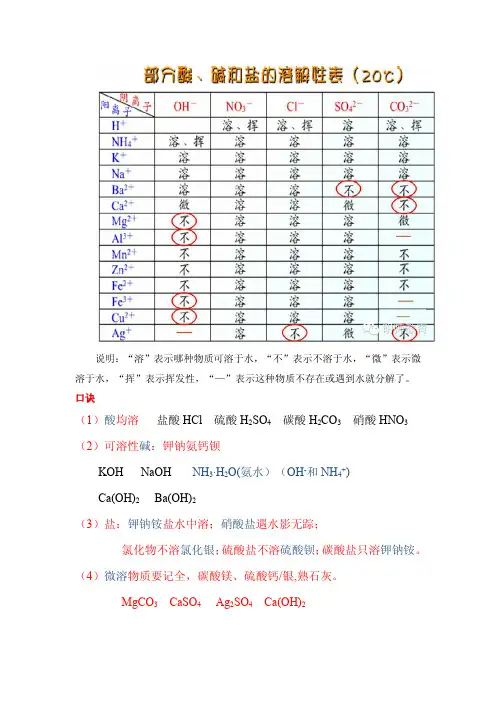
说明:“溶”表示哪种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示这种物质不存在或遇到水就分解了。
口诀
(1)酸均溶盐酸HCl硫酸H2SO4碳酸H2CO3硝酸HNO3(2)可溶性碱:钾钠氨钙钡
KOH NaOH NH3·H2O(氨水)(OH-和NH4+)
Ca(OH)2Ba(OH)2
(3)盐:钾钠铵盐水中溶;硝酸盐遇水影无踪;
氯化物不溶氯化银;硫酸盐不溶硫酸钡;碳酸盐只溶钾钠铵。
(4)微溶物质要记全,碳酸镁、硫酸钙/银,熟石灰。
MgCO3CaSO4Ag2SO4Ca(OH)2
五大阴离子四大酸根离子
物质名称化学式
物质分类
(酸碱盐)
溶解性
(溶不微)
例:氯化钠NaCl盐溶1硫酸
2氯化银
3碳酸钠
4氢氧化镁
5氯化铜
6硫酸钡
7硝酸银
8氢氧化铁
9氨水
10硫酸锌
11碳酸镁
12硝酸铜
13氯化亚铁
14碳酸铵
15硝酸铵
16硝酸铝
17氢氧化钡
18硫酸钠
19硝酸钡
20硝酸
21硫酸铁
22碳酸钙
23氢氧化钙
24氢氧化锌
25氯化铵
26碳酸钡
27硫酸钙
28高锰酸钾
29硝酸亚铁
30碳酸
31硫酸铜
32氢氧化铝
33氯化铝。



20192020浙教版八年级上科学同步提高必刷题训练1.5.1物质的溶解性和饱和溶液◆要点1 物质的溶解性(1)溶解性①定义:一种物质溶解在另一种物质里的能力。
②影响因素:一定温度下,物质的溶解性与溶质和溶剂的性质有关。
③物质溶解性的比较:要比较不同物质的溶解性,必须在一定温度下、一定量的溶剂及该溶质不能再继续溶解的条件下进行比较。
(2)溶解过程的吸、放热:物质在溶解时,有些会放出热量,有些会吸收热量,还有些溶解时温度没有明显变化。
①溶解时吸热的物质:硝酸铵(NH4NO3)等;②溶解时放热的物质:氢氧化钠(NaOH)、浓硫酸(浓H2SO4)等;③溶解时既不吸热也不放热的物质:氯化钠(NaCl)、蔗糖等。
◆要点2 饱和溶液和不饱和溶液的概念(1)饱和溶液:在一定温度下,在一定量的溶剂里不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液。
(2)不饱和溶液:在一定温度下,在一定量的溶剂里还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液。
◆要点3 饱和溶液和不饱和溶液之间的转换对于大多数饱和溶液和不饱和溶液之间可以相互转换饱和溶液增加溶剂或升高温度降低温度、蒸发溶剂、增加溶质饱和溶液大多数固体物质在一定量水中溶解的最大量随温度的升高而增大,但也有例外,如氯化钠的溶解度随温度的升高无明显变化,熟石灰的溶解度随温度的升高而降低。
◆要点4 浓溶液和稀溶液一定量溶剂里,溶有较多溶质的溶液称为浓溶液;溶有较少溶质的溶液称为稀溶液。
说明:(1)浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(2)对于同一种溶质和溶剂形成的溶液来说,在一定温度下的饱和溶液一定比不饱和溶液浓一些。
Δ基础题系列◆1.(2015浙江义乌、绍兴中考)在装有水的四个烧杯中,分别加入少量牛奶、食盐、菜油和面粉,充分搅拌后可形成溶液的是()A.牛奶B.食盐C.菜油D.面粉【答案】B【解析】食盐能够溶解于水中形成溶液,牛奶、菜油与水混合形成乳浊液,面粉与水混合形成悬浊液。

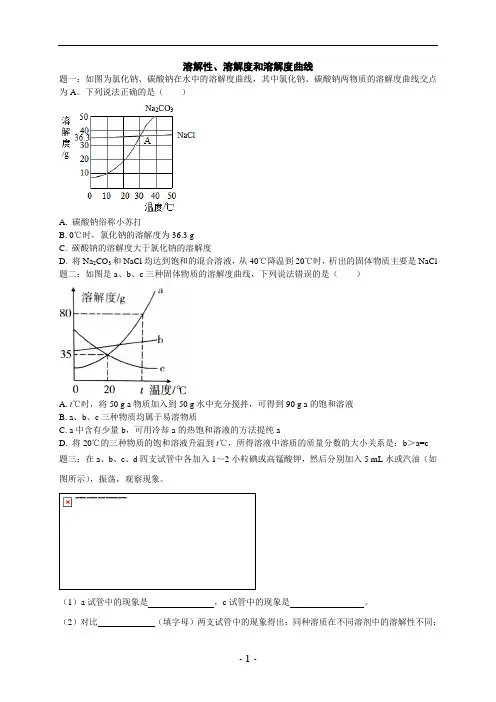
溶解性、溶解度和溶解度曲线题一:如图为氯化钠、碳酸钠在水中的溶解度曲线,其中氯化钠、碳酸钠两物质的溶解度曲线交点为A。
下列说法正确的是()A. 碳酸钠俗称小苏打B. 0℃时,氯化钠的溶解度为36.3 gC. 碳酸钠的溶解度大于氯化钠的溶解度D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温到20℃时,析出的固体物质主要是NaCl 题二:如图是a、b、c三种固体物质的溶解度曲线,下列说法错误的是()A. t℃时,将50 g a物质加入到50 g水中充分搅拌,可得到90 g a的饱和溶液B. a、b、c三种物质均属于易溶物质C. a中含有少量b,可用冷却a的热饱和溶液的方法提纯aD. 将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a=c题三:在a、b、c、d四支试管中各加入1~2小粒碘或高锰酸钾,然后分别加入5 mL水或汽油(如图所示),振荡,观察现象。
(1)a试管中的现象是,c试管中的现象是。
(2)对比(填字母)两支试管中的现象得出:同种溶质在不同溶剂中的溶解性不同;对比a、c试管中的现象得出的结论是;(3)【提出问题】物质的溶解性除与溶质、溶剂的性质有关外,还与什么有关?【作出猜想】。
【设计方案】。
【观察现象】。
【得出结论】。
题四:小明陪妈妈到医院输液,不小心将护士手中的盘子打翻,其中的棉球落在了小明的白色衬衣上,白色衬衣上立即出现了一大片紫黑色痕迹。
为找到去掉白衬衣上的痕迹的最好方法,几位同学进行了讨论,提出了以下几个方案并进行实验:①用水洗;②用无水酒精洗;③用汽油洗;④用四氯化碳洗;⑤用肥皂水洗;⑥用淀粉溶液洗。
(1)你认为留在白色衬衣上的紫黑色物质是什么?(2)如果用白色布条进行实验,为使实验结果更加准确,你认为该实验中需要控制哪些实验条件?(3)一位同学按如图所示方法进行实验:结果是⑤、⑥几乎完全褪色;②略带颜色;③、④略微变浅;①几乎不变。

固体物质的溶解度随温度变化的规律Na(OH)的溶解度随温度的升高而变小NaCL的溶解度随温度的升高而几乎不变KNO3等的溶解度随温度的升高而几乎变大固体物质的溶解度随温度变化的情况可分为三类:(1)大部分固体物质溶解度随温度的升高而增大;(2)少数物质溶解度受温度的影响很小;(3)极少数物质溶解度随温度的升高而减小。
固体溶解度固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,用字母s表示,其单位是“g/100g水”。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
例如:在20℃时,100g水里最多能溶36g氯化钠(这时溶液达到饱和状态),我们就说在20℃时,氯化钠在水里的溶解度是36g。
基本信息中文名称固体溶解度外因温度、压强(气体)内因溶质和溶剂本身的性质可溶大于等于1g小于10g提示物质在水里的溶解度定义固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,用字母s表示,其单位是"g/100g水"。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
例如:在20℃时,100g水里最多能溶36g氯化钠(这时溶液达到饱和状态),我们就说在20℃时,氯化钠在水里的溶解度是36g。
【提示】如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度。
另外,溶解度不同于溶解速度。
搅拌、振荡、粉碎颗粒等增大的是溶解速度,但不能增大溶解度。
溶解度也不同于溶解的质量,溶剂的质量增加,能溶解度溶质质量也增加,但溶解度不会改变。
简介指固体物质在100g溶剂内达到饱和状态时溶解度质量。
物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难(不)溶不溶小于0.01g影响物质溶解度的因素?内因:溶质和溶剂本身的性质。
外因:温度、压强(气体)。
主要影响固体的溶解度是温度。
对于大多数固体,温度越高,固体的溶解度越大。