第2章 金属的晶体结构与缺陷
- 格式:ppt
- 大小:1.26 MB
- 文档页数:22


小结第二章晶体与晶体结构内容:金属的晶体结构:合金的晶体结构实际金属的晶体结构第一节金属的晶体结构晶体与非晶体1. 晶体:指原子呈规则、周期性排列的固体。
常态下金属主要以晶体形式存在。
晶体具有各向异性。
非晶体:原子呈无规则堆积,和液体相似,亦称为“过冷液体”或“无定形体”。
在一定条件下晶体和非晶体可互相转化。
2. 区别(a)是否具有周期性、对称性(b)是否长程有序(c)是否有确定的熔点(d)是否各向异性3金属的晶体结构晶体结构描述了晶体中原子(离子、分子)的排列方式。
1)理想晶体——实际晶体的理想化·三维空间无限延续,无边界·严格按周期性规划排列,是完整的、无缺陷。
·原子在其平衡位置静止不动2)理想晶体的晶体学抽象(晶体)空间规则排列的原子→刚球模型→晶格(刚球抽象为晶格结点,构成空间格架)→晶胞(具有周期性最小组成单元)。
晶体学参数:a,b,c,α,β,γ晶格常数:a,b,c晶系:根据晶胞参数不同,将晶体分为七种晶系。
90%以上的金属具有立方晶系和六方晶系。
立方晶系:a=b=c,α=β=γ=90︒六方晶系:a1=a2=a3≠ c, α=β=90︒, γ=120︒原子半径:晶胞中原子密度最大方向上相邻原子间距的一半。
晶胞原子数:一个晶胞内所包含的原子数目。
配位数:晶格中与任一原子距离最近且相等的原子数目。
致密度:晶胞中原子本身所占的体积百分数。
二.常见的金属晶格晶胞晶体学参数原子半径晶胞原子数配位数致密度2 8 68% BCC a=b=c,α=β=γ=90oFCC a=b=c, α=4 12 74%β=γ=900HCP a=b c,a/2 6 12 74% c/a=1.633, α=β=90o, γ=120o第二节实际金属的晶体结构理想晶体+晶体缺陷——实际晶体实际晶体——单晶体和多晶体单晶体:内部晶格位向完全一致,各向同性。
多晶体:由许多位向各不相同的单晶体块组成,各向异性。





第二章 晶体结构与晶体中的缺陷1、证明等径圆球面心立方最密堆积的空隙率为25.9%。
解:设球半径为a ,则球的体积为4/3πa 3,求的z=4,则球的总体积(晶胞)4×4/3πa 3,立方体晶胞体积:33216)22(a a =,空间利用率=球所占体积/空间体积=74.1%,空隙率=1-74.1%=25.9%。
2、金属镁原子作六方密堆积,测得它的密度为1.74克/厘米3,求它的晶胞体积。
解:ρ=m/V =1.74g/cm 3,V=1.37×10-22。
3、 根据半径比关系,说明下列离子与O 2-配位时的配位数各是多少? 解:Si 4+ 4; K + 12; Al 3+ 6; Mg 2+ 6。
4、一个面心立方紧密堆积的金属晶体,其原子量为M ,密度是8.94g/cm 3。
试计算其晶格常数和原子间距。
解:根据密度定义,晶格常数)(0906.0)(10906.094.810023.6/(43/13/183230nm M cm M M a =⨯=⨯⨯=- 原子间距= )(0641.02/0906.0)4/2(223/13/1nm M M a r ==⨯=5、 试根据原子半径R 计算面心立方晶胞、六方晶胞、体心立方晶胞的体积。
解:面心立方晶胞:3330216)22(R R a V ===六方晶胞(1/3):3220282/3)23/8()2(2/3R R R c a V =•••=•= 体心立方晶胞:333033/64)3/4(R R a V ===6、MgO 具有NaCl 结构。
根据O 2-半径为0.140nm 和Mg 2+半径为0.072nm ,计算球状离子所占据的体积分数和计算MgO 的密度。
并说明为什么其体积分数小于74.05%?解:在MgO 晶体中,正负离子直接相邻,a 0=2(r ++r -)=0.424(nm)体积分数=4×(4π/3)×(0.143+0.0723)/0.4243=68.52%密度=4×(24.3+16)/[6.023×1023×(0.424×10-7)3]=3.5112(g/cm 3)MgO 体积分数小于74.05%,原因在于r +/r -=0.072/0.14=0.4235>0.414,正负离子紧密接触,而负离子之间不直接接触,即正离子将负离子形成的八面体空隙撑开了,负离子不再是紧密堆积,所以其体积分数小于等径球体紧密堆积的体积分数74.05%。


第二章晶体结构与晶体中的缺陷内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构,用以掌握与本专业有关的各种晶体结构类型。
介绍了实际晶体中点缺陷分类;缺陷符号和反应平衡。
固熔体分类和各类固熔体、非化学计量化学化合物的形成条件。
简述了刃位错和螺位错。
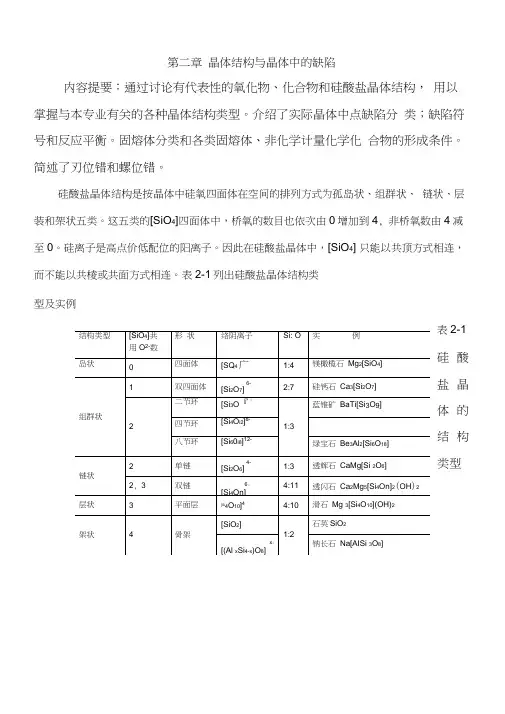
硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。
这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4, 非桥氧数由4减至0。
硅离子是高点价低配位的阳离子。
因此在硅酸盐晶体中,[SiO4] 只能以共顶方式相连,而不能以共棱或共面方式相连。
表2-1列出硅酸盐晶体结构类型及实例表2-1 硅酸盐晶体的结构类型真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。
晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。
点缺陷根据产生缺陷的原因分类,可分为下列三类:(1)热缺陷(又称本征缺陷)热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。
弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。
肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(2)杂质缺陷(非本征缺陷)(3)非化学计量化学化合物为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。
表2-2 Kroger-Vink 缺陷符号(以MTX2-为例)缺陷反应方程式书写规则:(1)位置关系。
(2)质量平衡。
(3)电荷守恒。
热缺陷平衡浓度n/N :n/N二exp(- : G t/2kT)其中n——TK时形成n个孤立空位;G t――热缺陷形成自由焓;h――波儿兹曼常数。
