第二章晶体结构缺陷
- 格式:ppt
- 大小:2.26 MB
- 文档页数:113







第二章 晶体结构与晶体中的缺陷1、证明等径圆球面心立方最密堆积的空隙率为25.9%。
解:设球半径为a ,则球的体积为4/3πa 3,求的z=4,则球的总体积(晶胞)4×4/3πa 3,立方体晶胞体积:33216)22(a a =,空间利用率=球所占体积/空间体积=74.1%,空隙率=1-74.1%=25.9%。
2、金属镁原子作六方密堆积,测得它的密度为1.74克/厘米3,求它的晶胞体积。
解:ρ=m/V =1.74g/cm 3,V=1.37×10-22。
3、 根据半径比关系,说明下列离子与O 2-配位时的配位数各是多少? 解:Si 4+ 4; K + 12; Al 3+ 6; Mg 2+ 6。
4、一个面心立方紧密堆积的金属晶体,其原子量为M ,密度是8.94g/cm 3。
试计算其晶格常数和原子间距。
解:根据密度定义,晶格常数)(0906.0)(10906.094.810023.6/(43/13/183230nm M cm M M a =⨯=⨯⨯=- 原子间距= )(0641.02/0906.0)4/2(223/13/1nm M M a r ==⨯=5、 试根据原子半径R 计算面心立方晶胞、六方晶胞、体心立方晶胞的体积。
解:面心立方晶胞:3330216)22(R R a V ===六方晶胞(1/3):3220282/3)23/8()2(2/3R R R c a V =•••=•= 体心立方晶胞:333033/64)3/4(R R a V ===6、MgO 具有NaCl 结构。
根据O 2-半径为0.140nm 和Mg 2+半径为0.072nm ,计算球状离子所占据的体积分数和计算MgO 的密度。
并说明为什么其体积分数小于74.05%?解:在MgO 晶体中,正负离子直接相邻,a 0=2(r ++r -)=0.424(nm)体积分数=4×(4π/3)×(0.143+0.0723)/0.4243=68.52%密度=4×(24.3+16)/[6.023×1023×(0.424×10-7)3]=3.5112(g/cm 3)MgO 体积分数小于74.05%,原因在于r +/r -=0.072/0.14=0.4235>0.414,正负离子紧密接触,而负离子之间不直接接触,即正离子将负离子形成的八面体空隙撑开了,负离子不再是紧密堆积,所以其体积分数小于等径球体紧密堆积的体积分数74.05%。

第二章晶体缺陷P2问题空位形成应该遵循物质守恒,即内部原子跑到表面上。
空位形成整体是膨胀过程,但具体机制较复杂。
一方面,缺少了原子会造成整体收缩;另一方面,跑到表面的原子使体积增加,综合效果是形成一个空位导致半个原子体积的增加。
相关问题有:1.如果测量产生空位的晶体,其点阵常数是增大还是缩小?2.将点阵常数测量结果与晶体整体膨胀的事实做对比,能够发现什么与空位浓度相关的规律?提示:由简到繁是惯用的方法,故可以考虑一维晶体。
答:①增大②随着晶体整体膨胀的增加,空位浓度增加。
-——详见潘金生《材料科学基础》P213空位的测量问题溶质原子尽管造成局部的排列偏离,但并不把它算为点缺陷,为什么?答:由对“置换原子”与“空位”的比较及“间隙溶质”与“自间隙原子”的比较可知,溶质原子的加入所产生的对于标准态的偏离比较小,因此不把它算为点缺陷。
问题图2-2中的置换原子(黑色)的尺寸画得有些随意。
假定(b)图中黑原子半径比白的小5%,而(c)图中大5%,问那种情况下基体内的应变能更大些?为什么?答:(b)图中应变能更大。
①(a)图中,周围白原子点阵常数变大,呈现拉伸状态。
(b)图中,周围白原子点阵常数变小,呈现压缩状态。
②由右结合能的图像可知,在平衡位置r0左右,曲线并非对称。
产生相同的形变,压缩引起的应变能更大。
所以(b)图中应变能更大。
P4问题Al2O3溶入MgO(具有NaCl结构)中,形成的非禀性点缺陷在正离子的位置,还是相反?答:Al 2O 3溶入MgO 晶体,由于Al 离子是+3价,,而Mg 离子是+2价,所以当两个铝离子取代两个镁离子的位置后,附近的一个镁离子必须空出,形成的非禀性点缺陷在正离子的位置。
问题 图2-3(a)的画法有些问题。
更好的画法是将图中的大小方块画在一起,即正负离子空位成对出现(参见余永宁“材料科学基础”图6-5)。
为什么成对的画法更好些?答:因为①正、负电中心成对出现的时候,可以抵消一点局部电中性的无法满足。

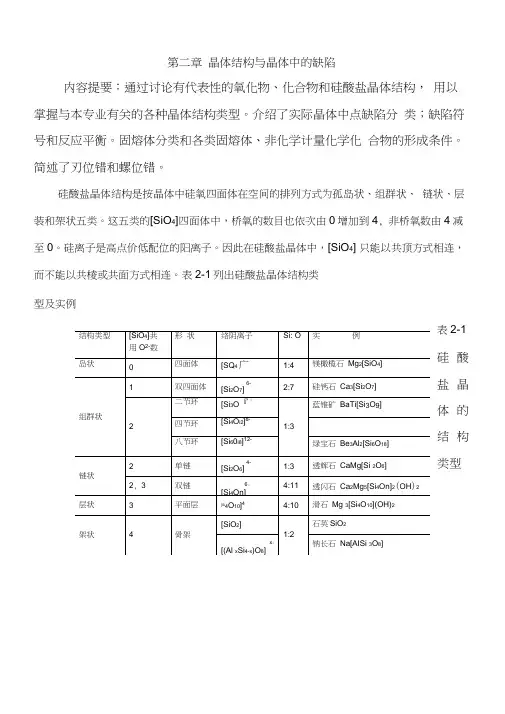
第二章晶体结构与晶体中的缺陷内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构,用以掌握与本专业有关的各种晶体结构类型。
介绍了实际晶体中点缺陷分类;缺陷符号和反应平衡。
固熔体分类和各类固熔体、非化学计量化学化合物的形成条件。
简述了刃位错和螺位错。
硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。
这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4, 非桥氧数由4减至0。
硅离子是高点价低配位的阳离子。
因此在硅酸盐晶体中,[SiO4] 只能以共顶方式相连,而不能以共棱或共面方式相连。
表2-1列出硅酸盐晶体结构类型及实例表2-1 硅酸盐晶体的结构类型真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。
晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。
点缺陷根据产生缺陷的原因分类,可分为下列三类:(1)热缺陷(又称本征缺陷)热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。
弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。
肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(2)杂质缺陷(非本征缺陷)(3)非化学计量化学化合物为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。
表2-2 Kroger-Vink 缺陷符号(以MTX2-为例)缺陷反应方程式书写规则:(1)位置关系。
(2)质量平衡。
(3)电荷守恒。
热缺陷平衡浓度n/N :n/N二exp(- : G t/2kT)其中n——TK时形成n个孤立空位;G t――热缺陷形成自由焓;h――波儿兹曼常数。

56第二章 晶体结构缺陷我们在讨论晶体结构时,是将晶体看成无限大,并且构成晶体的每个粒子(原子、分子或离子)都是在自己应有的位置上,这样的理想结构中,每个结点上都有相应的粒子,没有空着的结点,也没有多余的粒子,非常规则地呈周期性排列。
实际晶体是这样的吗?测试表明,与理想晶体相比,实际晶体中会有正常位置空着或空隙位置填进一个额外质点,或杂质进入晶体结构中等等不正常情况,热力学计算表明,这些结构中对理想晶体偏离的晶体才是稳定的,而理想晶体实际上是不存在的。
结构上对理想晶体的偏移被称为晶体缺陷。
实际晶体或多或少地存在着缺陷,这些缺陷的存在自然会对晶体的性质产生或大或小的影响。
晶体缺陷不仅会影响晶体的物理和化学性质,而且还会影响发生在晶体中的过程,如扩散、烧结、化学反应性等。
因而掌握晶体缺陷的知识是掌握材料科学的基础。
晶体的结构缺陷主要类型如表2—1所示。
这些缺陷类型,在无机非金属材料中最基本和最重要的是点缺陷,也是本章的重点。
表2—1 晶体结构缺陷的主要类型2.1 点缺陷研究晶体的缺陷,就是要讨论缺陷的产生、缺陷类型、浓度大小及对各种性质的影响。
60年代,F .A .Kroger 和H .J .Vink 建立了比较完整的缺陷研究理论——缺陷化学理论,主要用于研究晶体内的点缺陷。
点缺陷是一种热力学可逆缺陷,即它在晶体中的浓度是热力学参数(温度、压力等)的函数,因此可以用化学热力学的方法来研究晶体中点缺陷的平衡问题,这就是缺陷化学的理论基础。
点缺陷理论的适用范围有一定限度,当缺陷浓度超过某一临界值(大约在0.1原子%左右)时,由于缺陷的相互作用,会导致广泛缺陷(缺陷簇等)的生成,甚至会形成超结构和分离的中间相。
但大多数情况下,对许多无机晶体,即使在高温下点缺陷的浓度也不会超过上述极限。
缺陷化学的基本假设:将晶体看作稀溶液,将缺陷看成溶质,用热力学的方法研究各种缺陷在一定条件下的平衡。
也就是将缺陷看作是一种化学物质,它们可以参与化学反应——准化学反应,一定条件下,这种反应达到平衡状态。