藏药中乙酰胆碱酯酶抑制剂的筛选
- 格式:pdf
- 大小:166.22 KB
- 文档页数:3

中草药中乙酰胆碱酯酶抑制活性的筛选张东博;任晋【摘要】阿尔茨海默病是一种慢性中枢神经系统退行性疾病,是老年痴呆的主要类型.对于该病的治疗,一个有希望的策略是乙酰胆碱酯酶抑制剂的使用.为了寻找潜在的、高效的乙酰胆碱酯酶抑制剂,5种中草药的生物碱提取物的乙酰胆碱酯酶抑制活性通过经典的Ellman比色法被评价.结果表明,元胡与黄柏的生物碱提取物显示了显著的乙酰胆碱酯酶抑制活性,其余3种中草药的生物碱提取物显示了非常弱的乙酰胆碱酯酶抑制活性.结果暗示,从中草药的生物碱提取物中筛选乙酰胆碱酯酶抑制剂是可行的,能够为开发治疗阿尔茨海默病的新药提供有用的先导化合物.【期刊名称】《甘肃科技》【年(卷),期】2010(026)019【总页数】2页(P172-173)【关键词】阿尔茨海默病;筛选;乙酰胆碱酯酶抑制活性;Ellman比色法【作者】张东博;任晋【作者单位】兰州理工大学,甘肃,兰州,730050;兰州理工大学,甘肃,兰州,730050【正文语种】中文【中图分类】R971阿尔茨海默病 (AD)是一种发生于老年和老年前期以进行性神经退化为特征的大脑退行性疾病。
伴随着全球老龄化人口的增加,AD的发病率呈逐年上升的趋势[1]。
对于该病的治疗,目前最有效的手段是乙酰胆碱酯酶抑制剂的使用[2,3]。
现有的几个高效的乙酰胆碱酯酶抑制剂,像石杉碱甲[4]、加蓝他敏[5]均源自于药用植物。
这暗示,对于乙酰胆碱酯酶抑制剂的筛选,中草药是极具价值的资源之一。
为了寻找潜在的、高效的乙酰胆碱酯酶抑制剂,本文通过改进的 Ellman比色法[6,7]对 5种中草药的生物碱提取物进行了乙酰胆碱酯酶抑制活性的评价。
1.1 供试药材元胡 (Corydalis humosa),黄柏 (Bark of Phellodendron amurense),鸡骨草(Abrus cantoniensis),龙葵草 (Solanum nigrum),草乌 (Aconitum vilmorinianum),以上药材均购买自兰州黄河药材市场安宁医药公司复兴厚药庄,由兰州理工大学生命科学与工程学院杨林副教授鉴定。

中药中乙酰胆碱酯酶和α-葡萄糖苷酶抑制剂的亲和筛选及其与酶的相互作用研究中药中乙酰胆碱酯酶和α-葡萄糖苷酶抑制剂的亲和筛选及其与酶的相互作用研究摘要:乙酰胆碱酯酶和α-葡萄糖苷酶是参与生物体代谢的关键酶,与多种疾病的发生发展密切相关。
本研究采用了亲和筛选的方法,研究了中药中乙酰胆碱酯酶和α-葡萄糖苷酶抑制剂的筛选,并进一步探讨了其与这些酶的相互作用机制。
1. 引言乙酰胆碱酯酶是一种重要的酶类,能够降解神经递质乙酰胆碱,维持突触前后的正常传递。
α-葡萄糖苷酶则是一种参与多种氧化酶反应和碳水化合物代谢的酶。
这些酶的异常活性与多种疾病的发生和进展密切相关。
传统中药中存在着大量能够干预这些酶活性的化合物,因此,研究中药中乙酰胆碱酯酶和α-葡萄糖苷酶抑制剂具有重要意义。
2. 方法和材料本研究从中药中提取了一系列的化合物,并采用亲和筛选的方法,通过对这些化合物与乙酰胆碱酯酶和α-葡萄糖苷酶的相互作用进行筛选和评价。
亲和筛选的结果通过分子对接和动力学模拟进行验证。
3. 结果通过亲和筛选,我们筛选出了8个中药中具有明显抑制乙酰胆碱酯酶和α-葡萄糖苷酶活性的化合物。
其中,化合物A和化合物B在不同酶的抑制活性中表现出最佳的效果。
分子对接结果显示,化合物A和化合物B与酶活性中心形成稳定的结合。
动力学模拟进一步揭示了这些化合物与酶的结合机制,并证实了它们对乙酰胆碱酯酶和α-葡萄糖苷酶的抑制作用。
4. 讨论通过亲和筛选的方法,我们成功地筛选出了具有抑制乙酰胆碱酯酶和α-葡萄糖苷酶活性的化合物。
这些化合物的发现为中药开发和治疗相关疾病提供了候选物。
进一步的研究可以深入探讨这些化合物的药理机制以及应用的可行性。
5. 结论本研究通过亲和筛选的方法,筛选了多个中药中具有抑制乙酰胆碱酯酶和α-葡萄糖苷酶活性的化合物,并揭示了它们与酶的相互作用机制。
这些研究结果有望为开发新的中药治疗方法和药物提供理论基础。
通过亲和筛选和分子对接及动力学模拟的方法,本研究成功筛选出了多个中药中具有抑制乙酰胆碱酯酶和α-葡萄糖苷酶活性的化合物。


植物来源的生物碱类乙酰胆碱酯酶抑制剂研究进展一、本文概述随着全球对医药领域的深入研究,生物碱类化合物因其独特的药理活性和广泛的生物活性,已成为新药研发的重要来源。
特别是植物来源的生物碱类乙酰胆碱酯酶抑制剂,在医药领域中的应用前景尤为广阔。
这类化合物能够通过抑制乙酰胆碱酯酶的活性,从而增加乙酰胆碱的含量,进一步影响神经传导,对于治疗某些神经系统疾病如阿尔茨海默病、帕金森病等具有重要的理论和实践意义。
本文旨在全面综述近年来植物来源的生物碱类乙酰胆碱酯酶抑制剂的研究进展,包括其提取工艺、作用机制、构效关系以及临床应用等方面的研究,以期为未来相关药物的研究和开发提供参考。
二、乙酰胆碱酯酶及其抑制剂概述乙酰胆碱酯酶(AChE)是一种水解酶,其主要功能是催化神经递质乙酰胆碱(ACh)的水解,从而终止胆碱能神经的突触传递。
在生物体内,AChE在神经-肌肉接点、中枢神经系统以及外周神经系统等多个部位发挥关键作用,对于维持神经系统的正常功能至关重要。
因此,AChE也成为了许多神经性疾病,如阿尔茨海默病、帕金森病等的重要治疗靶点。
乙酰胆碱酯酶抑制剂(AChEI)是一类能够抑制AChE活性的化合物,通过抑制ACh的水解,增加突触间隙中ACh的浓度,从而增强胆碱能神经的传递功能。
自20世纪50年代以来,人们就开始了对AChEI 的研究,并发现了多种具有抑制AChE活性的化合物,如毒扁豆碱、他克林等。
然而,这些药物在临床应用中存在一些副作用,如他克林的肝脏毒性等,限制了其应用。
近年来,随着天然产物研究的深入,从植物中发现的乙酰胆碱酯酶抑制剂逐渐受到人们的关注。
植物来源的AChEI具有多样性和复杂性,其化学结构和抑制机制各异,为开发新型、高效、低毒的AChEI 提供了丰富的资源。
例如,从某些药用植物中提取的生物碱类化合物,就被发现具有显著的AChE抑制活性,并显示出良好的神经保护和治疗潜力。
因此,对植物来源的乙酰胆碱酯酶抑制剂进行深入研究和开发,对于寻找新型神经性疾病治疗药物具有重要意义。

两面针中乙酰胆碱酯酶抑制剂的筛选与修饰本论文利用分子对接方法对于两面针中乙酰胆碱酯酶的抑制剂进行了筛选。
结果表明,两面针中多个成分对于乙酰胆碱酯酶具有抑制作用,其中抑制作用最强的化合物8能够以疏水作用和氢键相互作用与乙酰胆碱酯酶结合。
此外,我们发现把化合物5中的甲氧基修饰成羟基,能够显著提高其对乙酰胆碱酯酶的抑制作用。
标签:两面针;乙酰胆碱酯酶;分子对接引言两面针Zanthoxylumnitidum(Roxb.)DC.又名入地金牛、蔓椒、双面针、双背针等,系芸香科花椒属藤本植物,主要分布于我国浙江、福建、广东、广西、海南、四川等地。
两面针的化学成分和药理作用已有报道[1]含有多种化学成分,主要为生物碱、香豆素和木脂素。
在民间两面针常用于治疗牙痛、神经痛、胃痛、咽喉肿痛、风湿性关节炎痛等多种病症。
许多生物碱类成分对于乙酰胆碱酯酶都具有一定的抑制作用[2]。
分子对接方法能够相对准确的预测不同化合物对于乙酰胆碱酯酶的抑制活性[3]。
因此,本论文采用分子对接方法对于两面针的部分成分对于乙酰胆碱酯酶的抑制作用进行了研究,并探讨了化学修饰对于其活性的影响,为进一步的实验研究奠定了基础。
1. 对接计算方法1.1 配体分子和受体的结构从文献中确定两面针中已知10个化合物的结构,画出配体平面结构,用openbabel软件把平面结构转成三维结构。
然后Autodock Tool 软件对配体结构转成Autodoc文件格式(pdtqt)用于对接计算。
从蛋白质结构数据库中()中下载乙酰胆碱酯酶的晶体结构(1ACJ.pdb),用Autodock Tool 软件去除其中的结晶水,加极性氢原子和原子电荷,保存成pdbqt格式,供对接计算使用。
1.2 对接方法利用Autodock软件完成乙酰胆碱酯酶与10个化合物的对接,活性位点设定为以(2.78,64.38,67.97)中心,边长为25埃的立方盒子。
其余参数均为缺省值,根据分子对接结果,选择结合自由能最低構象,为最终对接结果。
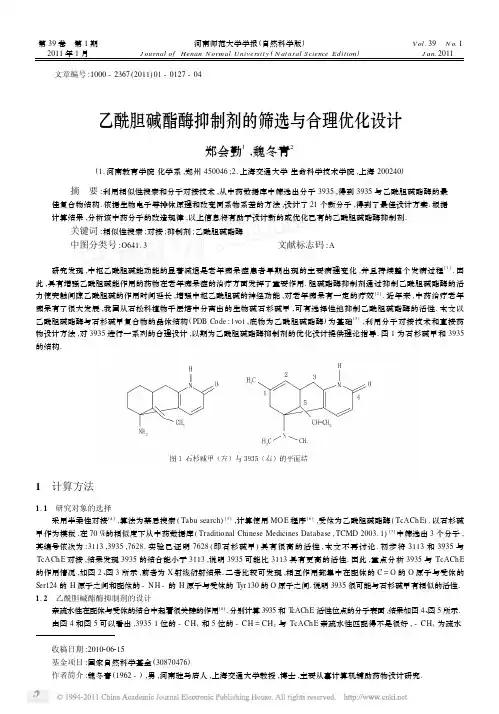
第39卷 第1期2011年1月河南师范大学学报(自然科学版)J ournal of Henan N ormal Universit y(N atural Science Edition) V ol.39 N o.1 J an.2011 文章编号:1000-2367(2011)01-0127-04乙酰胆碱酯酶抑制剂的筛选与合理优化设计郑会勤1,魏冬青2(1.河南教育学院化学系,郑州450046;2.上海交通大学生命科学技术学院,上海200240)摘 要:利用相似性搜索和分子对接技术,从中药数据库中筛选出分子3935,得到3935与乙酰胆碱酯酶的最佳复合物结构.依据生物电子等排体原理和改变同系物系差的方法,设计了21个新分子,得到了最佳设计方案.根据计算结果,分析该中药分子的改造规律,以上信息将有助于设计新的或优化已有的乙酰胆碱酯酶抑制剂.关键词:相似性搜索;对接;抑制剂;乙酰胆碱酯酶中图分类号:O641.3文献标志码:A研究发现,中枢乙酰胆碱能功能的显著减退是老年痴呆症患者早期出现的主要病理变化,并且持续整个发病过程[1].因此,具有增强乙酰胆碱能作用的药物在老年痴呆症的治疗方面发挥了重要作用.胆碱酯酶抑制剂通过抑制乙酰胆碱酯酶的活力使突触间隙乙酰胆碱的作用时间延长,增强中枢乙酰胆碱的神经功能,对老年痴呆有一定的疗效[2].近年来,中药治疗老年痴呆有了很大发展,我国从石松科植物千层塔中分离出的生物碱石杉碱甲,可有选择性地抑制乙酰胆碱酯酶的活性.本文以乙酰胆碱酯酶与石杉碱甲复合物的晶体结构(PDB Code:1vot,底物为乙酰胆碱酯酶)为基础[3],利用分子对接技术和直接药物设计方法,对3935进行一系列的合理设计,以期为乙酰胆碱酯酶抑制剂的优化设计提供理论指导.图1为石杉碱甲和3935的结构.1 计算方法1.1 研究对象的选择采用半柔性对接[4],算法为禁忌搜索(Tabu search)[5],计算使用MO E程序[6],受体为乙酰胆碱酯酶(TcACh E).以石杉碱甲作为模板,在70%的相似度下从中药数据库(Traditional Chinese Medicines Database,TCMD2003.1)[7]中筛选出3个分子,其编号依次为:3113,3935,7628.实验已证明7628(即石杉碱甲)具有很高的活性,本文不再讨论.初步将3113和3935与TcAChE对接,结果发现3935的结合能小于3113,说明3935可能比3113具有更高的活性.因此,重点分析3935与TcAChE 的作用情况,如图2、图3所示,前者为X射线衍射结果.二者比较可发现,相互作用都集中在配体的C=O的O原子与受体的Ser124的H原子之间和配体的-N H-的H原子与受体的T yr130的O原子之间.说明3935很可能与石杉碱甲有相似的活性.1.2 乙酰胆碱酯酶抑制剂的设计亲疏水性在配体与受体的结合中起着很关键的作用[8].分别计算3935和T cAChE活性位点的分子表面,结果如图4、图5所示.由图4和图5可以看出,39351位的-CH3和5位的-CH=CH2与TcAChE亲疏水性匹配得不是很好,-CH3为疏水收稿日期:2010206215基金项目:国家自然科学基金(30870476)作者简介:魏冬青(1962-),男,河南驻马店人,上海交通大学教授,博士,主要从事计算机辅助药物设计研究.基,对应的受体部位则为部分亲水部分疏水区;-CH =CH 2为疏水基,对应的受体部位却为亲水区.因此,在分子设计中重点对这两个部位进行改造,同时也尝试了其他改造方法.改造时主要依据电子等排体原理和改变同系物系差的方法,具体方案如下(括号内数字为新分子编号):对1位-CH 3的改造:方案1:将-CH 3分别替换为其电子等排体:-F (1),-Cl (2),-Br (3),-I (4),-O H (5),-SH(6),-N H 2(7),-P H2(8).方案2:将-CH 3分别替换为:-CH 2CH 3(9),-CH 2CH 2CH 3(10),-CH (CH 3)2(11),-OCH 3(12)-OCH 2CH 3(13),-CH 2F (14),-CH 2Cl (15),-CH 2Br (16),-CH 2I (17).对5位-CH =CH 2的改造:方案3:将-CH =CH 2分别替换为亲水基团-N H 2(18)和-O H (19).其他类型的改造.方案4:将3位的-CH 2-替换为-N H -(20).方案5:将2位的-CH =替换为-N =(21).2 计算结果将上述分子在MO E 软件包的优化模块下进行结构优化.选择MMFF94力场,计算各分子的部分电荷,通过系统搜索,得到各分子最低能量构象,将该构象保存为mol2格式用于对接计算.结果列于表1中,结合能由公式(1)计算:E intelation =E vdw +E electroctaic +E h 2bond(1)其值越小,说明配体与受体结合得越好.氢键相互作用可以采用式(1)中的显式表达,也可采用隐性表达,即通过调整对象分子中相应原子之间的范德华半径来处理,或者将其包含在静电作用能项中.本文采用隐性表达.3 结果讨论3.1 计算结果分析方案1:计算结果显示各分子与受体的结合能均为负值,且相差不大,其平均值为-53.383,说明这种方案是合理的.其中821河南师范大学学报(自然科学版) 2011年将疏水的甲基换为亲水的羟基,其结合能在本组中最低,为-64.863,说明这种改造方案有利于化合物活性的提高.表1 各分子与受体TcAChE 的对接结果(Kcal ·mol -1)改造方案分子编号静电作用范德华作用配体能量结合能1-48.090 4.180155.946-43.9102-60.156-3.181121.320-63.3373-57.052 3.077120.301-53.97514-59.81810.571126.751-49.2475-62.303-2.560121.387-64.8636-47.383 1.273120.009-46.1107-65.0837.570115.921-57.5138-56.8178.009123.523-48.8089-55.437 4.032142.056-51.40510-53.06651.219151.756-1.84711 3.99044.997177.43048.98712-29.72123.160130.549-6.561213-7.37147.357157.24439.98614-59.239-1.207132.740-60.44615-59.425 5.708140.853-53.71716-70.348-2.803143.259-73.15117-48.19124.420141.278-23.771318-64.063-0.186130.156-64.24919-52.44010.186109.947-42.254420-55.680-2.278101.381-57.958521-57.920-1.830120.081-59.750表2 对接较好的分子与TcAChE 所成氢键情况比较 (Kcal ·mol -1)分子编号氢键数目/个成键原子氢键键长C =O 的O 与Ser124的H 0.229162-N H -的H 与Tyr130的O 0.229C =O 的O 与Ser124的H 0.25953-N H -的H 与Tyr130的O 0.258-O H 的O 与G ly119的H 0.30922C =O 的O 与G ly117的H 0.313-N H -的H 与Tyr130的O 0.258141C =O 的O 与G ly117的H 0.343182C =O 的O 与Ser124的H 0.229-N H -的H 与Tyr130的O0.229方案2:将甲基分别换为乙基、丙基、异丙基,结合能从-51.405Kcal ·mol -1迅速升高到48.987Kcal ·mol -1;如换为甲氧基和乙氧基,结合能由- 6.562Kcal ·mol-1升高到39.986Kcal ·mol-1,均发生了显著改变,这是因为改造所得的新分子体积太大,与受体作用时,需越过更高的能垒,才能与之更好地匹配.说明此位置不宜有过长的碳链或过大的疏水基.相反,将甲基的一个氢原子换为卤素原子,结合能变化较小(碘除外,碘的体积太大),且均为负值,说明在此处加上亲水性好,电负性大的基团,将有助于化合物活性的提高.方案3:用-N H 2替换-CH =CH 2,结合能较低,为-64.249Kcal·mol -1,因为-CH =CH 2为疏水基团,与受体的亲水区域不匹配,当换为亲水的-N H 2时,改变了这种弊端,故可使化合物的活性有所提高.方案4、5:计算结果也相对较好,结合能分别为-57.958Kcal ·mol -1和-59.750Kcal ·mol -1.因此,这两种方案可考虑使用,但不及方案1、2、3好,且在环上进行改造,难度系数较高,不是最佳方案.3.2 较优的设计方案比较以上5种方案,1、2、3为较优的设计方案,即改造甲基和乙烯基效果较好.在药物-受体相互作用中,非键作用尤其是氢键起着很重要的作用,因此分析了较优的改造分子与TcACh E 结合时的氢键作用,截取0.5nm 内的残基,结果如表2所示.氢键的有效半径在0.2~0.4nm 之间[9].由表2知,C =O 的O 原子和2N H 2的H 原子无论什么情况下,均可与受体形成较强的氢键,说明二者在药物分子中极为重要,在设计新分子时不能变动.同时,几种方案显示了较为相似的活性,分子16与TcAChE 结合能最低,这可能是因为Br 原子的诱导效应使甲基碳原子的正电荷增加,有利于亲核进攻,同时也加强了2CH 2Br 与氨基酸残基的C =O 形成氢键的可能,故结合能较低;分子16与TcAChE 形成了两条较强的氢键,使复合物更为稳定,这也是结合能降低的原因之一.分子5是将疏水的甲基替换为亲水的2O H ,使其与受体的亲水区域匹配,且2O H 与受体之间形成了一条较弱的氢键,这一氢键可能对药物的活性起关键作用,有理由认为这种方案比较可行.图6为分子16和分子5与TcACh E 的结合情况.将图6、图7与图2、图3比较可知,分子16和分子5与TcAChE 的结合能力强于3935及石杉碱甲与TcAChE 的结合.证明本文对3935的改造方法是有效的,可能提高中药分子对乙酰胆碱酯酶的抑制活性.4 结 论通过分子对接方法得到中药分子3935与TcAChE 的最佳复合物结构.根据该复合物的结合模式,设计了21个新分子,921第1期 郑会勤等:乙酰胆碱酯酶抑制剂的筛选与合理优化设计得到最佳设计方案,即将1位上疏水的甲基替换为亲水基团,如2O H,或将甲基的一个氢原子替换为电负性大、体积适中的原子,如Br原子,将大大提高化合物的活性.以上信息将有助于设计新的或优化已有的治疗老年痴呆症的乙酰胆碱酯酶抑制剂.参 考 文 献[1] Pelayo C,Raehid E A,Jordi M,et a1.New Tacrine2Huperzine A Hybrids(Huprines):Highly Potent Tight2Binding Acetylcholinester2ase Inhibitors of Interest for t he Treat ment of Alzheimer’s Disease[J].Med Chem,2000,43(24):465724665.[2] 何 炜,杜道彬,武金霞,等.蚯蚓乙酰胆碱酯酶的分离与固定化实验研究[J].河南师范大学学报:自然科学版,2007,35(1):1072110.[3] Raves M L,Harel M,Pang Y P,et al.Structure of Acetylcholinestemse Complexed wit h t he Nootropic Alkaloid,Huperzine A[J].NatStruct Bid,1997(4):57263.[4] Kuntz I D.Struture2Based Strategies for Drug Design and Discovery[J].Science,1992,257:1078.[5] Hou T J,Wang J M,Chen L R,et al.Automated docking of peptides and proteins by using a genetic algorit hm combined wit h a tabusearch[J].Protein Eng,1999,12(8):6392648.[6] MO E.Molecular Operating Environment Montreal[M].Canada Quebec:Chemical Computing Group,2003.[7] 周家驹.中药原植物化学成分手册[K].北京:化工出版社,2005.[8] Sirois S,Wei D Q,Du Q S,et al.Virtual screening for SARS2CoV protease based on KZ7088pharmacophore point s[J].Chem Inf Com2put Sci,2004,44(3),:11121122.[9] 叶德泳.计算机辅助药物设计导论[M].北京:化学工业出版社,2003.Screening and Optimization Design the Acetylcholinesterase InhibitorsZH EN G Hui2qin1,WEI Dong2qing2(1.Depart ment of Chemistry,Henan Institute of Education,Zhengzhou450046,China;2.College of Life Sciences and Technology,Shanghai Jiaotong University,Shanghai200240,China) Abstract:The similarity search and molecular docking are used to search the Traditional Chinese Medicines Database.A new molecule3935is screened.The best complex structure of3935and Acetylcholinesterase are computed.Based on the infor2 mation,bioisosteric replacement and homologue methods are applied,total amount of twenty2one novel compounds are de2 signed.Some rules have been obtained f rom the results,which are important for designing new inhibitors and optimization de2 sign the current Acetylecholinestemse inhibitors.K ey w ords:similarity search;docking;inhibitor;Acetylcholinesterase031河南师范大学学报(自然科学版) 2011年。

固定化乙酰胆碱酯酶的制备及其在中药抑制剂筛选中的应用唐爽;张红燕;吴仁安;邓仕任;陈晓霞;夏林波
【期刊名称】《广州化工》
【年(卷),期】2022(50)9
【摘要】采用固定化酶的方法从治疗阿尔茨海默病的常用中药中筛选出具有乙酰
胆碱酯酶(acetylcholinesterase,AChE)抑制活性的品种。
结果表明,AChE能较好
的固定在修饰羧基的磁珠表面,在酶浓度8 mg/mL、固定时间4 h、缓冲液pH5.0、固定温度20℃的条件下,固定的AChE具有最佳的酶固载量及酶活性;将所合成的固定化酶与高效液相色谱-质谱(LC-MS/MS)技术相结合,成功筛选出石菖蒲、川芎、
茯苓、当归等4味具有较好AChE抑制活性的药材。
【总页数】3页(P57-59)
【作者】唐爽;张红燕;吴仁安;邓仕任;陈晓霞;夏林波
【作者单位】辽宁中医药大学;中国科学院大连化学物理研究所
【正文语种】中文
【中图分类】R917
【相关文献】
1.新型固定化乙酰胆碱酯酶传感器的制备及氨基甲酸酯农残检测
2.新型固定化乙酰胆碱酯酶传感器的制备及氨基甲酸酯农残检测
3.基于固定化酶的乙酰胆碱酯酶抑
制剂体外筛选模型的建立4.磁珠固定化凝血酶的制备及其在槐米活性化合物筛选
中的应用5.利用壳聚糖微球制备固定化乙酰胆碱酯酶
因版权原因,仅展示原文概要,查看原文内容请购买。


乙酰胆碱酯酶活性抑制剂筛选比色法检测试剂盒产品说明书(中文版)主要用途乙酰胆碱酯酶活性抑制剂筛选比色法检测试剂是一种旨在通过乙酰胆碱酯酶反应系统中,在抑制剂存在与否的情况下,所释放出巯基胆碱,与Ellman试剂反应后,产生黄色5-巯基-2-硝基苯甲酸产物,出现吸光峰值的变化,即采用比色法来评价样品酶活抑制能力的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
其适用于各种抑制剂筛选检测。
产品严格无菌,即到即用,操作简捷,性能稳定。
技术背景乙酰胆碱酯酶(Acetylcholinesterase;AchE;EC3.1.1.7),又称为红细胞胆碱酯酶(RBC cholinesterase),广泛存在于真核生物,包括某些植物,尤其在脑组织、神经肌肉连接处(neuromuscular junction)、中枢神经系统的胆碱能突触(cholinergic synapses)和红细胞膜上高度表达,催化主要的神经传导介质乙酰胆碱的水解反应,产生乙酸和胆碱,终止突触传导。
其功能在于调节乙酰胆碱作用。
神经毒气,例如有机磷沙林(Sarin),抑制乙酰胆碱酯酶活性,导致神经肌肉瘫痪,最终发生窒息(asphyxiation)。
血清乙酰胆碱酯酶浓度显著降低与有机磷杀虫剂中毒有关,因此血液检测是环境污染的重要指标。
基于人工合成底物碘化硫代乙酰胆碱(acetylthiocholine iodide),在抑制剂存在与否的情况下,通过乙酰胆碱酯酶的作用,水解产生乙酸和硫代胆碱(thiocholine),与Ellman试剂5,5-二硫基-双(2-硝基苯甲酸)[5,5’-dithiobis-(2-nitrobenzoic acid);DTNB]反应后,产生黄色的5-巯基-2-硝基苯甲酸(5-thio-2-nitrobenzoic acid;TNB),通过其吸收峰值的变化(412nm波长),来定量分析乙酰胆碱酯酶抑制剂的效应。
乙酰胆碱酯酶反应系统为:Acetylcholinesteraseacetylthiocholine iodide →acetate + thiocholineinhibitorDTNB + thiocholine →TNB + choline-S-S-TNB产品内容缓冲液(Reagent A)20毫升反应液(Reagent B)2毫升底物液(Reagent C)2毫升阴性液(Reagent D)1毫升产品说明书1份保存方式保存在-20℃冰箱里;反应液(Reagent B)和底物液(Reagent C)避免光照;有效保证6月用户自备乙酰胆碱酯酶:用于抑制剂筛选1.5毫升离心管:用于样品操作的容器比色皿或96孔板:用于比色的容器分光光度仪或酶标仪:用于比色分析实验步骤一、测定准备1.准备好待测样品,置于冰槽里备用2.开启并设定好分光光度仪(温度为37℃):波长412nm,间隔5分钟,读数3次(共15分钟),并置零3.从-20℃冰箱里取出试剂,置于冰槽里融化;反应液(Reagent B)和底物液(Reagent C)避免光照4.缓冲液(Reagent A)室温下均衡温度二、抑制剂筛选1.在96孔板上做好相应标记:背景、完全活性和待测抑制剂样品2.按下表加入试剂,进行样品预处理3.分别移取130微升缓冲液(Reagent A)到新的96孔板的所有孔里4.分别加入25微升反应液(Reagent B)5.分别加入25微升底物液(Reagent C)6.轻轻摇动96孔板7.在37℃温度下孵育3分钟8.加入20微升上述预处理的待测样品9.即刻放进37℃酶标仪检测:测读15分钟10.(选择步骤)完全酶活计算:[(样品读数-背景读数)X样品稀释倍数X 0.20(体系容量;毫升)]÷[0.005(样品容量;毫升)X 13.6(毫摩尔吸光系数)X 0.6(光径距离;厘米)X 15(反应时间;分钟)]=单位/毫升÷(样品蛋白浓度)毫克/毫升=单位/毫克单位=微摩尔硫代胆碱/分钟11.抑制活性计算:1)[(完全活性读数-空背景对照读数)-(抑制剂样品活性读数-样本背景读数)]÷(完全活性读数-空背景对照读数)=实际抑制百分率2)IC50:50%抑制率所需的抑制剂浓度X(所需抑制剂样品浓度)=(已知抑制剂样品浓度÷实际抑制百分率)X 50%3)直接构建抑制曲线:纵座标(Y轴)为吸光单位(OD);横座标(X轴)为已知抑制剂浓度注意事项1.本产品为20次操作2.操作时,须戴手套3.样品须澄清,至关重要4.加样后3秒内比色测定5.测定值由低到高变化;测定可持续15分钟6.用户根据实际需求,可以调整纯酶的浓度7.如果待测样品浓度过高或过低,可以调整样品浓度8.可以使用乙酰胆碱酯酶抑制剂(1,5-bis(4-allyldimethylammoniumphenyl)pentan-3-one dibromide;BW284c51;IC50=30纳摩尔)作为抑制剂对照9.乙酰胆碱酯酶单位活性定义为:在37℃,pH 7.5条件下,每分钟内能够生成1微摩尔硫代胆碱所需的酶量作为一个活性单位10.本公司提供系列乙酰胆碱酯酶检测试剂产品质量标准1.本产品经鉴定性能稳定2.本产品经鉴定检测敏感。


上海应用技术学院研究生课程《高等天然产物化学》试卷2014 / 2015 学年第1 学期课程代码:NX0702013论文题目:乙酰胆碱酯酶抑制剂的研究进展姓名:芮银146061414康满满146061409专业:制药工程学院:化工学院乙酰胆碱酯酶抑制剂的研究进展芮银,陈祎桐,康满满摘要:本文阐述了乙酰胆碱酯酶抑制剂(AChEI)的研究进展,介绍了用于药物治疗的乙酰胆碱酯酶抑制剂的各种来源如植物、微生物等,及其抑制乙酰胆碱的活性物质。
在此基础上,总结了几种现代分析技术,对AChEIs进行筛选,大大加快AD药物资源的开发利用进程。
这些方法主要有基于比色法的Ellman's法及相关的改进方法、薄层显色法、荧光显色法、电喷雾质谱法等。
但是,到目前为止,现代分析技术在AD药物资源中的应用还处在起步阶段。
关键词:乙酰胆碱酯酶抑制剂,筛选方法,薄层显色法,荧光显色法The progress of acetylcholinesteraseinhibitorsRui Yin, Chen Yitong, Kang ManmanAbstract:In this artical, the research elaborates progress of acetylcholinesterase inhibitors (AChEI), and introduces a variety of sources for drug treatment acetylcholinesterase inhibitors such as plants, microorganisms, and its active ingredients. On this basis, the review summarizes several modern analytic techniques such as Ellman's method which based on the colorimetric method, TLC chromogenic method, fluorescent color method, Electrospray ionization mass spectrometry and so on. However, at present, the application of modern analytic techniques in AD drug resources is still in infancy.Key word: Acetylcholinesterase inhibitors, Screening Methods, TLC chromogenic method, Fluorescent color method目录摘要.................................................................................................错误!未定义书签。
笔者通过大量查阅文献总结出乙酰胆碱酯酶抑制剂主要有三大类来源,①植物来源的乙酰胆碱酯酶抑制剂②人工合成的乙酰胆碱酯酶抑制剂③微生物来源的乙酰胆碱酯酶抑制剂。
其中众多研究发现植物来源的乙酰胆碱酯酶抑制剂的有效成分主要为生物碱类,萜类和香豆素类结构类型的化合物。
人工合成的乙酰胆碱酯酶抑制剂的主要来源则是对于天然的乙酰胆碱酯酶抑制剂对于一些基团的替换和增添删减,来提高其有效成分的活性。
微生物来源目前属于不太成熟阶段,相应的文献介绍相对较少,较为显著的是日本的科技工作者开始进行从微生物来源的AChE抑制剂筛选工作,Izawa等首先报道从淡紫灰链霉菌中分离的AChE抑制剂cyclophostint[1],Omura等报道了从青霉和曲霉中分离的一组化合物arisugacins和territrems对AChE有抑制作用[2]。
下面就笔者及其小组成员的发现进行综述。
1.1乙酰胆碱酯酶抑制剂的检测方法最初的乙酰胆碱酯酶抑制剂的检测是通过对临床标本采用肠道浴的药理学技术方法,但是该方法的实验周期长,所使用的动物组织和试剂都较昂贵。
因此,该方法已经被灵敏的化学方法取代。
如Ellman等[5]研究的方法就得到广泛的使用,该方法操作简单、耗费低、灵敏度和专属性高,不易产生假阳性,是一种快速测定乙酰胆碱酯酶抑制剂的方法。
其原理为:乙酰胆碱酯酶水解底物丁酰硫代胆碱(acetylthiocholine),生成的产物硫代胆碱再与显色剂二硫二硝基苯甲酸(DTNB)[5,5’一dithiobis一(2一nitrobenzoic acid)]反应生成在410nm 处有特征吸收的化合物2一硝基一5一巯基苯甲酸(5一thi0—2一nitrobenzoic acid),通过测定410 am处的吸光度的增量可以间接测定乙酰胆碱酯酶的活性。
硫代乙酰胆碱+H2O→AChE→乙酸+硫代胆碱+二硫二硝基苯甲酸→2一硝基一5一巯基苯甲酸当该技术首次报道出来后,利用可见分光光度计和酶标仪测定乙酰胆碱酯酶抑制剂的活性得到广泛应用。
阿卡宁衍生物合成产物中乙酰胆碱酯酶抑制剂的筛选左娜娜马志玲*(中山大学化学学院分析化学研究所,广州,510275)摘要本文以合成得到的乙酰胆碱酯酶抑制剂混合物为研究对象,通过紫外分光光度法检测出混合物是否具有活性,进一步通过高效薄层色谱法(HPTLC)确定活性物质的个数以及位置,接着通过液相-质谱(LC-MS)联用等方法对活性物质定性分析。
混合物体系,通过本实验的方法,不经分离提纯即可测定各种化合物是否具有抑制能力以及抑制活力的大小,包括各种副产物,因而可以获得合成体系中有关抑制剂的最大的信息量。
关键词乙酰胆碱酯酶抑制剂筛选1 前言阿尔茨海默病(Alzheimer’s,AD)是一种多发生于老年人中的缓慢进行性、智能衰退性疾病,俗称老年性痴呆病。
AD的关键性症状主要是由胆碱能功能障碍所引起的,治疗AD 病的主要途径是寻找新的中枢拟胆碱药,乙酰胆碱酯酶抑制剂就是其中的一类治疗药物。
传统的药物筛选方法是定向合成再定向筛选,即首先通过化学预试寻找到药物先导物,接下来设计合成路线,对产物进行分离纯化,最后检验活性。
传统筛选方法有两个主要缺陷,一是传统活检只能应用于纯品,该方法只适用于易分离体系,对难分离混合物体系暂时没有解决办法;二是传统定向合成只关注主合成产物,无视副产物也可能会有活性等信息。
而在本方法中,合成产物不需经过分离和纯化,可以直接筛选出活性物质并对其定性。
本文以合成得到的乙酰胆碱酯酶抑制剂混合物为研究对象,通过紫外分光光度法检测出混合物是否具有活性,进一步通过高效薄层色谱法(HPTLC)确定活性物质的个数以及位置,接着通过高效液相色谱法(HPLC)以及液相-质谱(LC-MS)联用等方法对活性物质定性分析。
这种筛选方法,克服了传统筛选方法的弊端,讲求整体性,对任意的合成体系,可以判断出产物是否具有活性、活性物质的位置以及活性物质的结构,这对药物筛选有重要的指导意义。
基金项目:中山大学化学与化工学院第五届创新化学实验与研究基金项目资助第一作者左娜娜,女,中山大学化学与化工学院应用化学专业2001级指导老师马志玲,中山大学化学院,副教授,Email:cesmzl@.2实验部分2.1抑制剂混合物体系的合成反应步骤如下:在两个50ml圆底烧瓶中,分别加入50mg原料和5ml甲醇,搅拌溶解;分别加入2-氨基吡啶和2-氨基代苯骈噻唑50mg;室温状态下搅拌72h;用薄层色谱法监测反应的进行程度,必要时加入催化剂硼酸(催化量);反应结束后,用氮气把溶剂吹干,再用三氯甲烷溶解;转入分液漏斗中,用水洗两次,每次5ml。
(生物科技行业)阿卡宁衍生物合成产物中乙酰胆碱酯酶抑制剂的筛选阿卡宁衍阿卡宁衍生物合成产物中乙酰胆碱酯酶抑制剂的筛选左娜娜马志玲*(中山大学化学学院分析化学研究所,广州,510275)摘要本文以合成得到的乙酰胆碱酯酶抑制剂混合物为研究对象,通过紫外分光光度法检测出混合物是否具有活性,进壹步通过高效薄层色谱法(HPTLC)确定活性物质的个数以及位置,接着通过液相-质谱(LC-MS)联用等方法对活性物质定性分析。
混合物体系,通过本实验的方法,不经分离提纯即可测定各种化合物是否具有抑制能力以及抑制活力的大小,包括各种副产物,因而能够获得合成体系中有关抑制剂的最大的信息量。
关键词乙酰胆碱酯酶抑制剂筛选1前言阿尔茨海默病(Alzheimer’s,AD)是壹种多发生于老年人中的缓慢进行性、智能衰退性疾病,俗称老年性痴呆病。
AD的关键性症状主要是由胆碱能功能障碍所引起的,治疗AD病的主要途径是寻找新的中枢拟胆碱药,乙酰胆碱酯酶抑制剂就是其中的壹类治疗药物。
传统的药物筛选方法是定向合成再定向筛选,即首先通过化学预试寻找到药物先导物,接下来设计合成路线,对产物进行分离纯化,最后检验活性。
传统筛选方法有俩个主要缺陷,壹是传统活检只能应用于纯品,该方法只适用于易分离体系,对难分离混合物体系暂时没有解决办法;二是传统定向合成只关注主合成产物,无视副产物也可能会有活性等信息。
而在本方法中,合成产物不需经过分离和纯化,能够直接筛选出活性物质且对其定性。
本文以合成得到的乙酰胆碱酯酶抑制剂混合物为研究对象,通过紫外分光光度法检测出混合物是否具有活性,进壹步通过高效薄层色谱法(HPTLC)确定活性物质的个数以及位置,接着通过高效液相色谱法(HPLC)以及液相-质谱(LC-MS)联用等方法对活性物质定性分析。
这种筛选方法,克服了传统筛选方法的弊端,讲求整体性,对任意的合成体系,能够判断出产物是否具有活性、活性物质的位置以及活性物质的结构,这对药物筛选有重要的指导意义。
华西药学杂志W C J ·P S2010,25(5)∶542 543基金项目:新世纪优秀人才基金(NECT -08-0820);中央高校基本科研业务费专项资金(SWJTU09ZT28)作者简介:许雪梅(1986―),女,正攻读微生物与生化药学专业的硕士学位。
Email :66362293xxmsheye@163.com *通信作者(Correspondent author ),Email :yukai2037@sina.com从植物浸膏中追踪筛选胆碱酯酶抑制剂许雪梅,喻凯*,吴奶珠,周先礼(西南交通大学生命科学与工程学院,四川成都610031)摘要:目的从植物浸膏中筛选对乙酰胆碱酯酶有抑制作用的物质,为研发治疗阿尔茨海默病(AD )的新药提供先导化合物。
方法建立乙酰胆碱酯酶抑制剂(AchEI )体外筛选模型,用改良Ellman 比色法测定AchE 的活力,随机筛选多种植物浸膏,对有抑制作用的浸膏进一步进行活性追踪,筛出活性物质。
结果追踪得抑制率超50%的两个单体化合物(东茛菪内酯和cannabichromeorcinic acid )。
结论东茛菪内酯和cannabichromeorcinic acid 可作为治疗AD 的先导化合物进行深入研究。
关键词:乙酰胆碱酯酶;胆碱酯酶抑制剂;阿尔茨海默病中图分类号:R96文献标志码:A文章编号:1006-0103(2010)05-0542-02Research on screening out acholinesterase inhibitors from herb extractsXU Xue -mei ,YU Kai *,WU Nai -zhu ,ZHOU Xian -li(College of Life Science and Engineering ,Southwest Jiaotong University ,Chengdu ,Sichuan ,610031P.R.China )Abstract :OBJECTIVETo screen out AchE inhibitors from herb extracts.The inhibitors will be used as lead compounds to developnew drugs for Alzheimer ’s disease (AD ).METHODS An AchEIs screening model was established in vitro.The extracts of herbswere randomly screened with the improved Ellman colorimetry.The inhibitors were traced from active extracts.RESULTSTwo inhibi-tors ,inhibitions of which were more than 50%,were obtained.They were scopoletin and cannabichromeorcinic acid.CONCLUSION The model is convenient and reliable.It can be used to screen out the inhibitors.The two compounds can be researched further as lead compounds to develop new drugs for AD.Key words :Acetylcholinesterase ;Acholinesterase inhibitors ;Alzheimer ’s disease CLC number :R96Document code :AArticle ID :1006-0103(2010)05-0542-02阿尔茨海默氏病(AD )又称老年性痴呆症,随着老龄人口比例的快速增长,AD 发病率呈上升趋势。