低位直肠癌局部切除术
- 格式:doc
- 大小:32.00 KB
- 文档页数:4

生垦塞厦医型垫!Q生§旦箜i!鲞筮!!羽£垡些竺地磐!鲢塑!鲤璺鱼丛鲤塑』!!!:垫!Q:Y!!:≥!:盟!:!!淋巴细胞增殖,降低外周血I L一2、I L一10、I FN—r等细胞因子密度。
且N B—U V B不易发生红斑效应。
这些为N B—U V B有效、安全治疗玫瑰糠疹提供了理论基础。
本文的研究结果显示,玫瑰糠疹患者经过2周的N B—U V B光疗取得了显著疗效,有效率达89.7%,明显优于常规疗法的疗效(P<O.01);同时不良反应轻微,达到了较快消除皮损,减轻症状,缩短病程的目的。
提示N B—U V B光疗治疗玫瑰糠疹起效快,疗效确切,不良反应少,值得临床应用。
参考文献[1]罗静,钱奕红,陶小华,等.窄谱U V B治疗玫瑰糠疹疗效观察[J].中国皮肤性病学杂志,2006,20(4):223-230.早期低位直肠癌局部切除术36例陈产方75[2]顾有守.玫瑰糠疹[J].临床皮肤科杂志,2006,35(7):479-480.[3]钟绮丽,顾有守.玫瑰糠疹与病毒感染[J].岭南皮肤性病科杂志,2007。
14(5):323-325,333.[4]廖家,吴昌辉,吴志华,等.玫瑰糠疹免疫病因学研究新进展[J].岭南皮肤性病科杂志,2008,15(1):52-54.[5]于波,程滨珠,钟绮丽。
等.玫瑰糠疹皮损中朗格汉斯细胞的超微结构[J].复旦学报(医学版),2006,33(1):110一112.[6]王雷,李春英,高天文.窄谱中波紫外线的生物学效应及应用[J].国外医学皮肤性病学分册,2003,29(5):282-284.(收稿日期:2009—12—20)(本文编辑:方华玲)【摘要】目的探讨局部切除术在早期直肠癌治疗中的应用及效果。
方法回顾分析5l例早期直肠癌患者的临床资料,其中局部切除36例,根治术15例,比较两种术式的术后并发症和5年生存率。
结果局部切除组术后并发症发生率8.3%;5年生存率88.9%;根治组术后并发症发生率20%,5生存率93.3%。


2021年低位直肠癌经括约肌间切除术ISR(全文)【摘要】结直肠外科医生从未停止对保肛手术的探索,只有在“保命、保功能”的基础上才能探讨保肛问题。
直肠肿瘤患者对保留肛门有着强烈而广泛的需求。
仅仅出于肿瘤学安全的考虑,不加区别地拿掉患者的肛门也是不人道的。
保肛手术有很多种,但只有经内、外括约肌间切除的ISR(Intersphincteric resection)手术可以被称为超低位极限保肛手术。
机器人在ISR手术中有特别的优势,未来可通过分子层面精确判断ISR手术的远切缘距离。
【关键词】直肠肿瘤;保肛手术;经括约肌间切除术世界首例直肠手术由法国外科医生Fageb于1739年完成,迄今已有近300年的历史[1]。
300年来,外科医生从未停止对保肛手术的探索,也从未停止“保肛还是保命”的争论。
1952年版《克氏外科学》上有这样的叙述:“反对结肠造瘘术者,乃是由于他们不希望而亦不需要让他们的病人继续生存。
开口在会阴部的结肠造瘘术,其瘘口不能有效地控制,除了在人情上外观上的无谓的一点作用之外,无论在哪方面来讲,它的价值总远逊于腹壁上的开口” [2]。
这些今天看来有失偏颇的论断,恰恰在提醒我们,患者的生命永远是第一位的,肛门的功能是第一位的。
只有在“保命、保功能”的基础之上,我们才能探讨保留肛门的问题。
1 保肛手术的现实需求无论国内还是国外,患者对于保留肛门都有着强烈而广泛的需求,这背后蕴含了深刻的社会甚至宗教的原因。
仅仅出于肿瘤学安全的考虑,不加区别地拿掉患者的肛门,也是不人道的。
本中心团队曾遇到3例患者在Miels手术后因无法接受失去肛门的事实而轻生。
拿掉肛门和永久性造口对患者身体及心理都会造成巨大创伤。
切莫以为造口是小手术,造口手术有20多种并发症。
永久性造口的患者,很多会产生严重的自卑心理,不愿再参与社会生活与人交往,有些人因此而失去工作,对个人和家庭的影响都是难以估量的。
抛开思想上的局限不谈,永久性造口也会严重降低患者的生活质量。



经肛门局部切除术治疗中低位T1期直肠癌的效果及预后【摘要】目的:分析在中低位T1期直肠癌治疗中应用经肛门局部切除术治疗的效果。
方法:随机抽选我院2021年1月到2022年1月间诊治的64例中低位T1期直肠癌患者进行分析,根据手术治疗方式将其分成参比组和研究组,n=32。
参比组接受经腹根治性切除术治疗,研究组接受经肛门局部切除术治疗,比较两组术后指标和并发症发生率。
结果:研究组在治疗后的首次下床活动时间、胃肠道功能恢复时间及住院时间均短于参比组,P<0.05;研究组治疗后并发症的发生率明显低于参比组,P<0.05。
结论:经肛门局部切除术治疗中低位T1期直肠癌能有效缩短患者的术后恢复时间,降低患者并发症发生率,值得参考。
【关键词】中低位T1期直肠癌;经肛门局部切除术;经腹根治性切除术直肠癌是消化道疾病常见的恶性肿瘤,临床大多采取手术切除的方式治疗该病,但多项研究提出,手术切除后肠管破损或之肠系膜破损等均会增加患者围术期并发症发生风险和病死率,尤其是肿瘤巨大、肥胖、中低位直肠癌者[1]。
中低位T1期直肠癌在解剖结构上与肛管、生殖器、尿道、膀胱关系密切,治疗时若切除肿瘤及周围组织则会对患者造成难以接受的性功能障碍、排尿、排便障碍等。
选取更加合理的手术方式显得十分必要。
而部分早期直肠癌充分可以通过经肛门局部切除术达到根治效果,有利于降低围术期并发症发生率和病死率。
但在中低位T1期直肠癌的治疗中,经腹根治性切除术和经肛门局部切除术的有效性和安全性尚未充分明确[2]。
为此,本次研究选择2021年1月到2022年1月间我院诊治的64例中低位T1期直肠癌患者进行分析,具体结果报告如下。
1资料与方法1.1基本资料从2021年1月到2022年1月间随机抽选我院诊治的64例中低位T1期直肠癌患者进行分析,根据手术治疗方式将其分成参比组和研究组,n=32。
参比组中男20例,女12例;年龄25-72岁,均值(40.36±1.57)岁;肿瘤直径(2.16±1.01)cm。



直肠癌低位前切除手术临床路径一、直肠癌低位前切除手术临床路径标准住院流程(一)适用对象。
1.第一诊断为直肠癌(ICD-10:C20),行直肠癌低位前切除手术(ICD-9-CM-3:48.62或48.63)。
2.可R0切除的高中位直肠癌(Ⅰ期及部分Ⅱ、III期患者)。
(二)诊断依据。
根据卫生部《结直肠癌诊疗规范(2010年)》等。
1.症状:便血,脓血便,排便习惯改变,里急后重,下腹坠痛等。
2.体格检查:(1)一般情况评价:体力状况评估、是否有贫血、全身浅表淋巴结肿大;(2)腹部检查:是否看到肠型及肠蠕动波、触及肿块、叩及鼓音、听到高调肠鸣音或金属音;(3)直肠指检:明确肿瘤位于直肠壁的位置,下极距肛缘的距离;占肠壁周径的范围。
肿瘤大体类型(隆起、溃疡、浸润),基底部活动度及与周围脏器的关系,了解肿瘤向肠壁外浸润情况。
观察是否有指套血染。
3.实验室检查:粪常规+粪潜血;血清肿瘤标记物CEA 和CA19-9,必要时可查CA242、CA72-4、AFP和CA125。
4.辅助检查:术前肿瘤定性及TNM分期,指导选择正确的术式。
(1)结肠镜取活检,病理检查明确肿瘤组织类型(腺癌、粘液腺癌、印戒细胞癌)和分化程度(高、中、低);排除同时性结直肠多原发癌。
可使用乙状结肠镜确定直肠肿瘤位置(低位、中位、高位)。
(2)术前应当明确肿瘤分期。
行盆腔MRI或CT明确肿瘤与周围脏器和盆壁的关系,或行直肠腔内超声内镜,诊断肿瘤浸润肠壁深度及周围淋巴结是否转移。
5.鉴别诊断:必要时需行经肛门直肠壁穿刺活检病理,并请相关科室会诊。
(1)其他常见的结直肠疾病:胃肠道间质瘤(GIST)、炎性肠疾病、淋巴瘤、寄生虫感染、息肉等;(2)腹腔其他脏器疾病累及直肠:妇科肿瘤、子宫内膜异位症及男性前列腺癌累及直肠。
(三)治疗方案的选择。
根据卫生部《结直肠癌诊疗规范(2010年)》和NCCN 《结肠癌临床实践指南中国版(2011年)》等。
1.直肠癌低位前切除手术。

直肠癌手术时,如何选择保肛还是造瘘直肠癌主是指从齿状线一直到直肠乙状结肠的交界位置处出现了癌变现象,直肠癌是消化道中比较常见的一种恶性肿瘤。
由于直肠癌本身的位置比较低,所以在对直肠癌进行诊断的时候,必须要利用相对应的检测仪器和设备来进行。
但是由于直肠本身的解剖关系比较复杂,所以即使是利用手术的方式,也很彻底治愈,甚至手术之后的复发率比较高。
什么是保肛手术对于直肠癌患者而言,虽然在利用手术对患者进行治愈的时候,即使手术完成之后,也很容易就会出现复发现象,对患者将会造成非常严重的威胁。
在患者决定接受手术的时候,要与患者的实际情况进行结合,对保肛手术或者是造瘘手术进行科学合理的选择和利用,这样可以为患者的术后恢复效果打下良好基础。
其中,保肛手术是比较常见的一种治疗直肠癌的手术方式。
如果是单纯从广义的角度出发对其进行分析,那么保肛手术其实主要是指可以为患者保留住肛门。
但是需要注意一点就是,保留肛门并不意味着肛门的功能仍然可以正常使用。
现阶段,从学术界的角度出发对其进行分析,发现只有保留“有功能”的肛门,才可以被称之为真正意义上的保肛手术。
对于一些高位直肠癌患者而言,保肛手术之后,基本上肛门的正常功能并不会受到任何的影响,在经过一段时间的调养之后就可以恢复到正常的状态。
但是对于一些低位的保刚手术患者而言,由于这种类型的患者本身已经失去了直肠壶腹储存大便的功能。
所以由于受到大便分泌物的影响和刺激,患者下意识就会老想要排便。
这种情况从医学的角度对其进行解释,就是直肠在受到一定刺激之后会产生的症状,可以将其称之为前切除综合症。
对于患者而言,经常会绝八感觉到便意,甚至还会出现不受自己主观意识控制的排便情况发生。
特别是对于部分患者而言,虽然保留了肛门,但是肛门在实际应用过程中的功能特征非常差。
因此,对于低位的直肠癌局部切除手术,必须要保证所有的手术指征都必须要按照标准要求来进行。
除此之外,还有一种情况就是肛门完全失去了任何的功能,比如哈特曼手术在实施之后,虽然也可以在其中保留住患者的肛门,但是患者肛门的所有功能全部都丧失。
直肠癌局部切除术一、适应征直肠癌经肛门切除的标准:NCCN Clinical Practice Guidelines in Oncology - Rectal Cancer V.1.20071、<30%肠管周径;2、病变<3cm;3、边界清晰(>3mm);4、活动,无固定;5、距肛缘8cm以内;6、T1或T2(T2应谨慎,因为复发率高);7、恶变的息肉破碎或病理不能确定(如果局部病变示侵袭性癌则术前即应行全面检查);8、没有淋巴、血管和周围神经侵犯;9、高、中分化;10、术前影像学检查未发现淋巴结转移。
直肠癌局部切除的适应征:Maingot’s Abdominal Operations 11th1、T1N0或T2N0病变;2、病变直径<4cm;3、<40%腔内周径;4、距齿状线<10cm;5、高、中分化;6、活检证实无淋巴和血管侵犯;7、广泛转移预后不良但是需要控制局部病变的患者;对于淋巴侵犯、具有预后不良特征的T1患者、T2患者需要化疗。
二、概述局部切除有四种术式:经括约肌途径(transsphincteric excision,即Mason术)、经肛门途径(transanal excision)、经尾骨途径(transcoccygeal excision,即Kraske 术)、TEM(transanal endoscopic microsurgery)。
经括约肌途径可以引起明显的肛门括约肌功能障碍,导致中重度便失禁,因此应尽量选用其它三种术式。
经肛门切除手术适用于距离齿状线3-5cm以内并且没有侵犯括约肌的病变;距离齿状线5cm肿瘤可以选用经尾部途径或TEM;经尾部途径手术适用于直肠后壁病变,但是前壁病变也可使用;距离齿状线7-10cm的肿瘤需TEM手术或低位前切除手术。
三、手术方法(一)、Kraseke手术——M. L. 格利埃德曼(美)著《外科手术技巧图谱》;Maingot’s Abdominal Operations 11th1、Kraske最初作骶骨切除,作者发现如将肛门括约肌向下牵拉,仅作尾骨切除已足以切除病变。
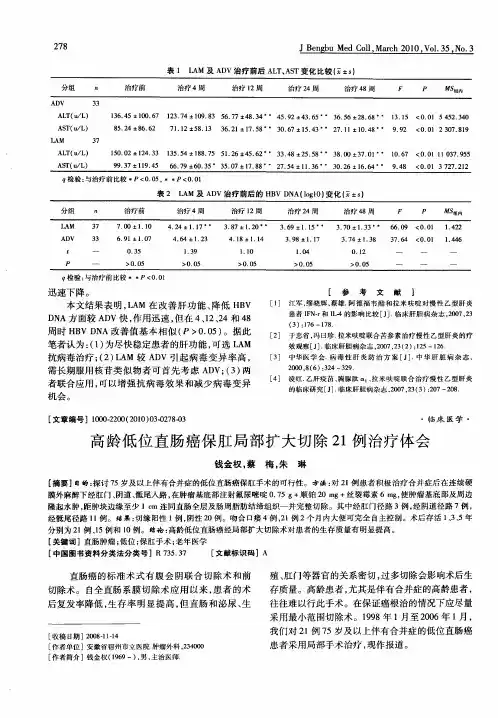
低位直肠癌局部切除术
(附一例报告并文献综述)
张玉贤、女、51岁,已婚,陕西、西安。
大便干结、带血、下坠20年,于2009、12、28入院。
20年前渐见大便干结,1次/3~4天,便时有下坠感且有少许血性液,偶见大便有凹槽,未曾诊治。
既往10年前曾有宫外孕手术史,3年前在胃镜下胃息肉套扎。
头、颈、心肺、腹未见异常。
直肠指诊:截石位10~12点扪及带蒂肿瘤,肿瘤呈2x2cm,不光滑、质中,蒂部光滑、质软,活动度大。
纤维结肠镜检:进境4cm可见3X2cm不规则肿瘤,表面欠光滑、质脆,触之易出血,根部带蒂,活动度尚可。
进境6cm可见一孤立粘膜溃疡、表面覆盖脓苔、周围粘膜充血水肿。
降结肠:可见0.3x0.3cm肿物,表面欠光滑,粘膜充血水肿。
横结肠:近肝区可见0.3X0.3cm肿物,表面欠光滑、粘膜充血水肿。
病理报告:(直肠中下段)小块粘膜组织高分化腺癌。
(降结肠、乙状结肠)腺瘤性息肉。
2010.1.5日,在硬膜外麻醉下经肛门低位直肠癌局部切除,术中见:直肠前壁距肛缘4cm可见隆起样肿瘤,凹凸不平、3X3cm,基地软、活动度好,阴道后壁质软。
距肿瘤1.5cm电刀切除(功率80),连同肿瘤、肠壁全层切除,3-0可吸收线间断缝合。
术中冰冻:肿瘤侵及粘膜下层,肌层及基地部未见癌细胞。
病理报告:直肠高分化腺癌。
病理分期:AJCC P T1NOMO。
讨论
1、早期直肠癌局部切除的可行性分析
早期直肠癌是指病变浸至直肠粘膜层和粘膜下层(T1-T2),由于直肠粘膜无淋巴管,因此,局限在粘膜层的早期直肠癌不致发生淋巴转移。
有作者指出如何判断肿瘤转移的危险性是应用局部切除术的关键,也是当今研究的重点。
一般认为其影响的因素有:1肿瘤的大小:肿瘤越大则淋巴转移率越高,直径<2cm,2-3cm,3-5cm,的直肠癌淋巴结转移率分别为10.5%,33.5%,54.2%;
2,肿瘤形态:浸润型切除病灶时要求更广泛,但术前难以明确;3,肿瘤浸润深度;浸润深度与淋巴结转移率有明显关系,肿瘤局限粘膜下层者,淋巴转移率17.9%,侵犯肌层为37.8%,侵及浆膜下者为58.5%,侵出浆膜者为
60%;4,组织学类型:肿瘤分化程度越低淋巴转移率越高,高分化腺癌、中分化腺癌、低分化腺癌的淋巴转移率分别为25%、33%、71%。
故理论上讲局部切除术应限于高、中分化腺癌。
也有肿瘤浸润深度超过粘膜下层,也不一定有淋巴转移。
因此,对早期直肠癌(T1-T2)尤其是局限粘膜层组织学分化好的肿瘤,施行局部切除是可行的。
2、术前准备
(1)直肠指诊:了解肿瘤大小、位置、形态及活动度。
如肿瘤固定提示有肠壁外侵,不宜行局部切除。
(2)胸部X片:腹部B超、CT、盆腔MRI,利于排除区域淋巴转移及肺、肝转移。
(3)直肠腔内B超:能显示肠壁层次,判断肿瘤侵犯肠壁深度,其准确率80-95%。
(4)纤维结肠镜检:了解整个大肠有无其他病变排除多发肿瘤等。
(5)病理检查和肠道准备:术前常规病理检查,明确诊断和细胞分化程度。
3、适应证
(1)直肠肿瘤距肛缘<8cm.
(2)直肠肿瘤直径<3cm,或侵入肠壁周径30%以内。
(3)直肠肿瘤活动度好,基地无侵润,肿瘤大体分型为隆起型、息肉型表浅型溃疡。
(4)组织学类型分化好的高、中分化腺癌或绒毛状腺瘤癌变。
(5)低分化腺癌、粘液腺癌和印戒细胞癌不适合局部切除。
(6)无淋巴转移、无血管侵润、无远处转移。
4、手术方式
局部切除方法包括:经肛门局部切除、经骶局部切除、经肛门括约肌局部切除、经阴道局部切除。
经肛门局部切除是最常用、创伤最小的手术方法,对再次手术影响不大,缺点是位置较高的肿瘤手术操作不便,可能影响肿瘤切除的完整性。
局部切除以切除肠壁的深度不同分为部分肠壁肌层切除和肠壁全层切除。
肠壁部分切除适用于肿瘤多为带蒂或亚蒂者,肠壁全层切除适用于肿瘤大体类型为隆起型、盘状型。
具体操作:
术中常规冰冻判断肿瘤的范围和深度。
首选超声刀切除或双极电刀切除。
于肿瘤基底部用1/20万肾上腺素和0.25%氟脲密啶氯化钠注射,使肿瘤和基底组织分离,易于切除、减少出血,同时可杀灭可能存在的残留瘤细胞。
四定点局部切除。
距肿瘤1.5cm全层缝合4针支持线,向下牵引使肿瘤下移,距瘤体 1.5cm切除肿瘤及肠壁全层。
用蒸馏水+碘伏冲洗术区,用5-FU500ml浸泡10min,可吸收线缝合。
5.术后并发症
局部出血。
局部感染。
肛瘘、直肠狭窄。
6、术后放化疗
多数学者认为直肠癌局部切除后辅助治疗对于控制局部复发有重大意义,Vanila等报告早期直肠癌局部切除58例,其中19例行辅助治疗,局部复发率5.3%,未作辅助治疗局部复发率20.5%。
有作者报告局部切除T1患者接受术后放疗,T2期术后接受化疗。
放疗于术后4周开始,化疗于手术后二周开始。
方法:(1)喃氟啶每日800-1200mg,分3-4次口服,服药3周,休息一周,共6个月。
(2)5-氟脲咪啶+亚叶酸,第1-5天剂量分别为每日425mg/㎡和200mg/㎡,28天为一疗程,共4-6个周期。
有作者报告局部切除后均行放、化疗。
2008年中国版NccN指出,对于T1期直肠癌局部切除后可随访观察无须辅助治疗。
有作者认为辅助放化疗对于局部切除术预后的影响目前仍不明确,术后放化疗并不能明显降低肿瘤复发率及提高病人的生存率。
7、疗效T1和T2直肠癌局部切除后,有10-40%复发率,T2复发率高于T1。
低分化肿瘤复发率高于高、中分化肿瘤(高、中分化肿瘤复发率12.07%,低分化肿瘤复发率40%)。
天津人民医院马东旺报道63例直肠癌局部切除后,1、3、5年生存率分别为:100%、96%、90%。
梁建伟报道早期直肠癌局部切除101例,16例局部复发,局部复发率
15.8%,复发时间为4-174月,平均48.3个月,Tis.T2.及T3.T4局部复发
率为7.1%、14.6%、22.2%、42、9%,5年生存率为91.0%,Tis、T1、T2、及T3、T4、T5年生存率分别为100%、92.6%、77.1%、83.3%。
8、早期低位直肠癌局部切除术前景
本世纪50年代Loekhary和Dukes提出恶性直肠息肉采用局部切除的理论,他们认为不论从外科学角度还是病理角度均是安全的治疗措施。
以往认为局部切除治疗早期直肠癌是一姑息性手术,而今认为是一种微创手术,具有创伤小、痛苦少、恢复快等优势,日益受到国内外众多学者的关注。
早期低位直肠癌的局部切除,尤其是Tis期5年生存率100%。
直肠癌关键在于早发现,选择合理治疗方式,既要提高肿瘤病人的生存率,又要考虑病人的生活质量,是我们肛肠学着研究和实施的课题。