麦克斯韦速率分布律气体分子的平均碰撞频率和平均自
- 格式:ppt
- 大小:1.22 MB
- 文档页数:46


麦克斯韦气体速率分布律Maxwell Velocity Distribution大家知道,由气体的温度公式可以得出气体分子的方均根速率。
例如在时,氦气。
氧气。
但我们要注意的是,方均根速率仅是运动速率的一种统计平均值,并非气体分子都以方均根速率运动。
事实上,处于平衡状态下的任何一种气体,各个分子均以不同的速率、沿各个方向运动着。
有的速率大于方均根速率,有的速率小于方均根速率,它们的速率可以取零到无穷大之间的任意值。
而且由于气体分子间的相互碰撞,每个分子的速度也在不断地改变,所以在某一时刻,对某个分子来说,其速度的大小和方向完全是偶然的。
然而就大量分子整体而言,在平衡状态下,分子的速率分布遵守一个完全确定的统计性分布规律又是必然的。
下面我们介绍麦克斯韦应用统计理论和方法导出的分子速率分布规律。
气体分子按速率分布的统计规律,最早是由麦克斯韦于1859年在概率论的基础上导出的,1877年玻耳兹曼由经典统计力学中也导出该规律。
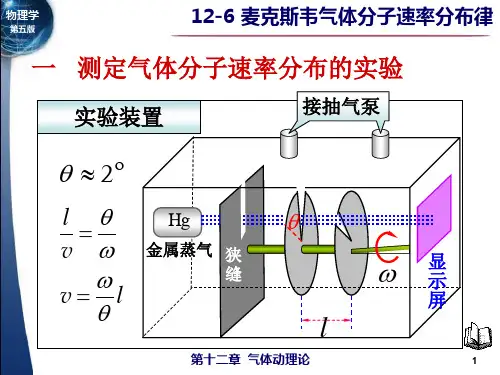
由于技术条件的限制,测定气体分子速率分布的实验,直到本世纪二十年代才实现。
1920年斯特恩(O.Stern首先测出银蒸汽分子的速率分布;1934年我国物理学家葛正权测出铋蒸汽分子的速率分布;1955年密勒(Mlier和库士(Kusch测出钍蒸汽分子的速率分布。
斯特恩实验是历史上最早验证麦克斯韦速率分布律的实验。
限于数学上的原因和本课程的要求,我们不推导这个定律,只介绍它的一些基本内容。
*麦克斯韦(J. C. Maxwell,1831—1879)英国物理学家,经典电磁理论的奠基人,气体动理论的创始人之一。
他提出了有旋电场和位移电流概念,建立了经典电磁理论,这个理论包括电磁现象的所有基本定律,并预言了以光速传播的电磁波的存在。
1873年,他的《电磁学通论》问世,这本书凝聚着杜费、富烂克林、库仑、奥斯特、安培、法拉第……的心血,这是一本划时代巨著,它与牛顿时代的《自然哲学的数学原理》并驾齐驱,它是人类探索电磁规律的一个里程碑。


1. 理想气体状态方程:处于平衡态的理想气体,质量为m 0,摩尔质量为M ,总分子数为N ,其状态参量P 、V 、T 之间满足状态方程:RT Mm PV 0=, 1131.8--⋅⋅=K mol J R , nkT P = 式中VN n =为分子数密度, 1231038.1--⋅⨯=K J k 为玻尔兹曼常数。
4. 理想气体压强公式:)21(32322v m n n P k ==ε 5. 理想气体温度公式: k k T ε32=6.麦克斯韦速率分布律:处于平衡态的N 个分子,其速率分布在dv v v +-之间的分子数为dN ,则 dv v f NdN )(= )(v f 称为速率分布函数,)(v f 表示速率分布于v 附近单位速率区间的分子数占总分子数的百分比, 速率在v 1 --v 2 区间 的分子数占总分子数的比率为dv v f N N v v )(21⎰=∆, 归一化条件为1)(0=⎰∞dv v f 。
7. 气体分子的三种统计速率:(1) 物理量(如分子速率v )的平均值为dv v vf v )(0⎰∞=。
(2) 最概然速率(曾用名:最可几速率)p v ,f(v)的极大值所对应的速率,用于研究分子的速率分布情况MRT M RT m kT v p 41.122≈==。
(3) 平均速率v ,用于研究分子碰撞MRT M RT m kT v 60.188≈==ππ。
(4) 方均根速率2v ,用于研究分子平均平动动能,MRT M RT m kT v 73.1332≈==。
8. 能量均分定理,理想气体的热力学能(内能):(1) 自由度:决定一个物体在空间的位置所需要的独立坐标数目。
(2) 能量均分定理:在平衡态下,分子热运动的每一个自由度的平均动能都等于kT 21。
(3) 分子的平均总动能ε:设分子有t 个平动自由度,r 个转动自由度,s 个振动自由度,令i=t+r+2s, 则分子的平均总能量是:kT i 2=ε 单原子分子i=3, kT 23=ε , 刚性双原子分子i=5, kT 25=ε, 刚性多原子分子(3个及3个以上),i=6,kT 26=ε。





