氮族单元复习(应用)
- 格式:doc
- 大小:195.50 KB
- 文档页数:4

高二化学氮族元素单元复习人教版【同步教育信息】一. 本周教学内容:氮族元素单元复习二. 重点、难点1. 掌握氮族元素的原子结构特点及其在周期表的位置和性质的变化规律。
2. 掌握氨和铵盐的性质、用途及氨的实验室制法,学会检验铵离子。
3. 掌握硝酸的通性和特性,及氨氧化法制取的化学反应原理,并了解主要生产过程。
4. 了解氮气、磷的同素异形体白磷和红磷的性质和用途。
三.具体内容2. 知识网络:请你按下表要求填入你所知道的含有氮元素的物质的化学式:含氧酸 HNO 3、HNO 2、 碱 NH 3·H 2O 盐 NH 4NO 3络合物 OH NH Ag ])([23有机物C 6H 5—NO 232263)(NO H C CH - n ONO O H C ])([32276(1)氮气① 结构的稳定性 ② 氧化性——223H N +32NH2323N Mg MgN 点燃+③ 还原性——NO O N 222放电+④ 2N 的工业制法及氮的固定 (2)氮的氧化物 (3)磷及其化合物 ① 同素异形体 ② 磷的还原性③ 磷的氧化物——52O P ④ 磷酸及偏磷酸 ⑤ 磷酸盐的性质 (4)氨气及铵盐① 3NH 的结构及物理性质② 3NH 的化学性质——还原性,与水,与酸反应 ③ 3NH 的制法及用途 ④ 铵盐的四大特点: <1> 易溶于水,且吸热 <2> 与碱反应 <3> 受热易分解<4> 水解 ⑤ +4NH 的检验(5)硝酸及硝酸盐① 硝酸的强氧化性、不稳定性、有机反应 ② 工业制硝酸 ③ 硝酸盐的性质 ④ 王水【典型例题】[例1] 在一定条件下,某元素的氢化物X 可完全分解为两种单质:Y 和Z ,若已知:① 反应前的X 与反应后生成的Z 的物质的量之比3:2)(:)(=Z n X n② 单质Y 的分子为正四面体构型 请填写下列空白。
(1)单质Y 是 ,单质Z 是 (填写名称或分子式) (2)Y 分子共含 个共价键。




氮族元素复习讲义一12.10[高考热点]1、知道氮族元素的原子结构及性质变化规律2、掌握N2和P物理性质和化学性质[高考热点精讲]典型例题一:氮族元素和同周期的氧族元素及卤族元素相比,谁的非金属性较强?为什么?举例说明。
典型例题二、氮气是一种不活泼的气体,其根本原因是A. 氮元素的非金属性较弱B. 氮原子半径较小N 键断裂需要很高的能量C. 氮气是双原子分子D. 使N典型例题三、①HNO3和HNO2的酸酐各是什么?②NO为无色气体,如用排空气法收集时,气体却显红色,为什么?③NO2和溴蒸气都是红棕色、有刺激性气味的气体,怎样加以区别?④某种气态的氮的氧化物中含氧69.6%,在标准状态下,每4.6g这种气体的体积是1.12L,试确定它的分子式。
典型例题四、为了消除NO x对大气的污染,工业上常用如下反应来保护环境:NO x +NH3→N2 + H2O现有NO2和NO的混合气体3L可用相同状况下3.5L NH3恰好使其完全转化为N2,则混合气体中NO2和NO的体积比是。
典型例题五、怎样证明红磷、白磷是同种元素构成的呢?答:典型例题六、取相同物质的量浓度,相同体积的(NH4)3PO4、(NH4)2HPO4、NH4H2PO4三种溶液分别滴加同一种NaOH溶液,要全部正好放出氨气生成正盐,则三种溶液耗用NaOH溶液的体积之比是()A.1∶2∶3 B.3∶2∶1 C.1∶1∶1 D.6∶3∶2[高考考点扫描]一、氮族元素的通性:1、原子结构:写出氮族元素的元素符号和原子结构示意图:2、性质上的相似性:(1)能获得3个电子,在气态氢化物中化合价都是3-价,通式为 ;(2)最高价氧化物的化合价都是+5,最高价氧化物通式为 ,其对应水化物为 或 ,呈酸性。
3、性质的递变规律:N P As Sb Bi金属性逐渐非金属性逐渐NH 3 PH 3 AsH 3 SbH 3稳定性逐渐HNO 3 H 3PO 4 H 3AsO 4 H 3SbO 4 HBiO 4酸性逐渐二、氮气的性质及用途:1、分子结构:氮气的电子式: ,结构式为:有一个共价叁键,所以键能大(946KJ/mol ),稳定,一般在高温时发生反应。
《氮族元素》复习教案(一)【教学内容】氮族元素、氮气【教学目标】1、能运用原子核外电子排布规律,熟练地写出氮、磷两种元素原子结构示意图。
2、认识氮族元素性质的相似性和递度规律,以及引起氮族元素性质异同的原因。
3、记住氮族元素的一些重要性质。
4、认识氮分子结构、性质及其重要用途。
5、熟悉氮在六种不同氧化物中的化合价;掌握一氧化氮和二氧化氮的重要性质。
6、了解氮的固定的重要性。
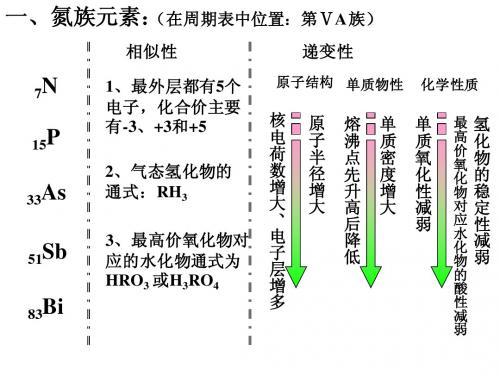
【知识讲解】一、氮族元素的结构特点氮族元素包括 N、 P、A S、 S b、 B i五种元素,在周期表中位于第 VA 族。
它们的最外层电子数均为 5 个,它们的原子半径随着核电荷数的增大而逐渐增大。
它们在原子结构上的异同处决定了性质的相似性和递变性。
单质的物理性质递变规律有:从氮到铋、单质的密度逐渐增大;固态氮和红磷、白磷均属分子晶体,熔沸点逐渐升高;锑和铋的金属性已较显著,熔、沸点的递变规律与碱金属单质相仿,逐渐降低。
砷较特殊,灰砷已呈现一定金属性,但常压下,它在613C0时能升华,加压下测得的熔点是氮族元素的单质中最高的。
二、氮族元素的相似性和递变性相似性递变性1、最外层上均为 5 个电子,均能1、氮、磷、砷、锑、铋的单质从非金获得 3 个电子而达到稳定结构。
属过渡到金属。
2、在最高价氧化物中化合价都是2、氮、磷与氧气反应的条件不同+5 价,化学式为 R2 O5放电2NO (难化合)N 2+O23、在气态氢化物中,都显- 3 价化点燃2P2O5(易化合)4P+5O 2学式为 RH3点燃2P2O5P4+5O 24、最高价氧化物的水化物的化学式所以还原性 N<P为: H 3RO4或 HRO 33、氮、磷与 H 2反应的条件不同高温、高压N 2+3H 2催化剂2NH 3而磷与 H 2很难直接化合成PH3所以氧化性: N>P4、气态氢化物的稳定性NH 3、 PH3、 A S H3、 S b H3稳定性逐渐减弱5、最高价氧化物的水化物的酸性HNO 3、 H3PO4、 H3A S O4、 H3S b O4酸性逐渐减弱说明:①氮族元素原子的价电子数是 5,但主要为 +3 、+5 价。
复习氮族一. 本周教学内容:复习氮族(一)氮、磷的原子结构氮、磷的原子结构简图电子式VA族元素的原子最外层有5个电子,所以它们具有比较稳定的化学性质。
但是,它们原子核外的电子层数从N→Bi由2层增加到6层,所以它们的原子半径递增、非金属性递减、最高价氧化物对应水化物的酸性递减、气态氢化物①稳定性递减,②沸点递增(二)氮气的结构氮气N2的电子式结构式N2分子稳定的原因:分子内的叁键键能大,分子不容易断裂。
1. N2的重要物理性质:2. N2的重要化学性质:①N2与H2反应②N2与O2反应③N2与Mg反应3. 常见与“N”有关的化学计算原理或关系式(也叫总反应式):⑴NO2与H2O⑵NO、O2、H2O⑶NO2、O2、H2O⑷由NH3制HNO3(三)NH3结构式电子式几何构型:三角锥形1. NH3的重要物理性质:氨水的主要成份2. NH3 的重要化学性质:⑴与酸反应⑵与O2反应⑶与HCl反应3. 实验室制取NH3 :①原理②装置:与甲烷、氧气的相同4. NH3的检验方法:湿润的红色石蕊试纸5. 铵盐与碱溶液反应的离子方程式:NH4+ + OH- == NH3↑ + H2O(四)硝酸1. 硝酸的重要物理性质:浓硝酸的保存方法是:2. 硝酸的重要化学性质:⑴硝酸具有强酸性,但是在浓硝酸中滴入石蕊试液的现象是先变红后褪色,硝酸与金属反应时无氢气生成。
⑵强氧化性:浓硝酸在常温使铁、铝钝化。
浓硝酸、稀硝酸和金属反应的规律:浓硝酸的还原产物为二氧化氮,稀硝酸的还原产物为一氧化氮。
⑶王水的组成是:体积比为3:1的浓盐酸和浓硝酸混合。
(五)磷1. 白磷的主要物理性质:2. 红磷的主要物理性质:3. 白磷与红磷可以相互转化,该过程属于化学变化。
4. 磷的重要化学性质:⑴磷与氧气反应:⑵磷与氯气反应:主要现象为白色烟雾(六)过量计算:【典型例题】例1. 室温下,将等体积的NO和O2混合,混合气体的平均相对分子质量是A 31B 41.3C 稍大于41.3D 稍小于41.3解析:由于反应:2NO + O2→ 2NO2假定原含2摩尔NO和2摩尔O2,反应后生成2摩尔NO2同时剩余1摩尔O2,根据平均相对分子质量的计算,等于41.3。
氮族元素复习一、氮氮族元素包括:(符号)氮族元素的相似性:最外电子层上均有个电子,获得个电子达到稳定结构,所以最低价,最高价均为。
最高价氧化物的通式为,对应水化物通式为或。
气态氢化物通式为。
物一般不显氧化性。
氮元素有多种价态,有:、、、、、对应化合物有:、、、、、1、氮的存在:态:大气中N2的体积比为、质量比为。
2、氮气的物理性质:色味,溶于水(1:0.02),密度比空气稍。
常见气体在常温常压下的溶解度难溶气体:N2(1:0.02);H2(1:0.02);微溶气体:O2(1:0.2)可溶气体:Cl2(1: 2)、H2S(1:2.6)易溶气体:SO2(1:40)极易溶气体:HCl(1:500)、NH3(1:700)[思考]实验室制N2时应该用什么方法来收集?3、氮气的化学性质1.N2的结构:电子式:;结构式:。
氮氮三键的键能很大(946kJ·mol-1),所以N2很,通常情况下,性质很。
2.氮气的化学性质(1)与氢气反应:(2)跟镁反应:(3)与氧气反应:中国有句农谚,叫做“雷雨发庄稼”,谁能解释这句话的含义?4、NO:色味,且很易被氧化,由色变成色的。
方程式:5、NO2:色气味的气体,溶于水,生成。
方程式:6、NO2与N2O4之间的转化7、氮气的用途①合成氨、制氮肥、制硝酸。
②用作保护气:焊接金属、充填灯泡、保存粮食和水果。
(原因:结构稳定,性质稳定)7、氮的固定:将游离态的氮转变为氮的化合物的过程叫做氮的固定。
[随堂练习]1.不属于氮的固定的变化是()A、根瘤菌把氮气转化为氨B、氮气和氢气在适宜条件下合成氨C、氮气和氧气在放电条件下合成NOD、工业上用氨和二氧化碳合成尿素2.利用下列方法,可以在实验室里从空气中制取氮气的是()A、把空气液化, 然后分离出氮气B、把空气缓缓通过加热了的铜网C、把空气缓缓通过加热了的镁粉D、把空气通过装有氢氧化钠的洗气瓶3(双).下列叙述正确的是A、从氮到铋随原子序数增加,单质的密度逐渐减小B、N、P主要表现非金属性,A S以非金属性为主,但已表现出一些金属性,而Sb、Bi已表现出明显的金属性C、氮族元素中,都有-3、+3、+5价态化合物D、氮的化合价最复杂4(双).下列叙述中,正确的是A、硝酸酸性比磷酸强B、PH3的稳定性大于NH3C、PH3的还原性大于NH3D、氮气的化学性质比磷活泼8、氮的氧化物和NO、NO2、O2、H2O之间的综合反应。
N2O、NO、NO2、N2O4均无对应含氧酸,属不成盐氧化物。
N2O3、N2O5分别是亚硝酸和硝酸的酸酐。
2NO+O2=2NO23NO2+H2O=2HNO3+NO①反应物为NO、O2、H2O时,用方程式:4NO+3O2+2H2O=4HNO3a、当V NO︰V O2 = 4︰3时,完全反应,气体剩余。
b、当V NO︰V O2<4︰3时,过量,剩余c、当V NO︰V O2>4︰3时,过量,剩余练习:1、将O2与NO按3:4体积比充满烧瓶,将烧瓶倒置于水中,最后烧瓶内溶液的体积占整个烧瓶体积的,所得溶液浓度为:2、由O2和NO组成的混合气体10mL,装入试管中,在倒置于水中,一段时间后,试管内剩余气体为1 mL,求原混合气体中O2和NO各为多少?②反应物为NO2、O2、H2O时,用方程式:4NO2+O2+2H2O=4HNO3a、当V NO2︰V O2 = 4︰1时,完全反应,气体剩余。
b、当V NO2︰V O2<4︰1时,过量,剩余c、当V NO2︰V O2>4︰1时,过量,剩余,但是由于所以,剩余物为练习:1、将O2与NO2按1:4体积比充满烧瓶,将烧瓶倒置于水中,最后烧瓶内溶液的体积占整个烧瓶体积的,所得溶液浓度为:2、由O2和NO2组成的混合气体10mL,装入试管中,在倒置于水中,一段时间后,试管内剩余气体为1 mL,求原混合气体中O2和NO2各为多少?3、将相同情况下的NO 和O 2按体积5︰3充满一干燥烧瓶,倒置水中,最后烧瓶内剩余 A 、剩余NO B 剩余O 2 C 剩余NO 2 D 充满水4、已知:3NO 2+H 2O=2HNO 3+NO ,NO+ NO 2 +2 NaOH == 2 Na NO 2 + H 2O ,将 20 mL NO 和 30 mL NO 2 的混合气体缓慢通过过量的 NaOH 溶液,最后剩余 气体 mL注: NO 2是一种强氧化剂,能将I -、SO 2、H 2S 等氧化2KI+4NO 2=2KNO 3+I 2+2NO SO 2+NO 2=NO+SO 3 H 2S+NO 2=S+NO+H 2O5、区分某红棕色气体是溴蒸气还是NO 2气体,可采用的试剂是A 、蒸馏水B 、KI -淀粉试纸 C 、AgNO 3溶液 D 、NaOH 溶液6.某集气瓶呈红棕色,加入足量水,盖上玻璃片,振荡,得橙色溶液,气体颜色消失,再打开玻璃片后,瓶中气体又变为红棕色。
该气体可能是下列混合气体中的 A 、N 2、NO 2、Br 2 B 、NO 2、NO 、N 2 C 、NO 2、O 2、NO D 、N 2、O 2、Br 27.将容积为18mL 的试管盛满水,倒置于水槽里,然后慢慢依次通入6mL NO 2,6mL O 2和,6mL NO 最终试管里气体的体积是A 、没有气体B 、12mLC 、4mLD 、2mL 8.有A 、B 、C 、D 四种气体,能发生下列变化A+D −→−E+H 2O , E+O 2−→−D ,C+D −→−B+F , B+O 2−→−C 。
且已知其中:C 为红棕色,D 能使石灰水变浑浊,E 常温下是固体,F 是一种酸酐。
(1)写出四种气体的化学式:A_________、B_________、C_________、D_________。
(2)写出C+D −→−B+F 所表示的反应方程式_____________________________。
(3)写出D 使石灰水变浑浊的反应方程式_______________________________。
8.(1)H 2S 、NO 、NO 2、SO 2。
(2)NO 2+SO 2=NO+SO 3。
(3)SO 2+Ca(OH)2=CaSO 3↓+H 2O 。
二、磷的化学性质可相互转化。
1.与O 2反应2.与Cl 2反应:现象:白色烟雾三、氨气(NH 3) 1.氨分子的结构电子式 ,结构式 ,空间构型 , 性分子。
键角: ,由 键构成的 分子。
2.物理性质: 色,而有 气味的气体,比空气 , 溶于水,易液化。
溶于水( ︰ ),可做 实验, 3. 化学性质 (1离子: 氨水的浓度越大,密度 。
密度为0.91g •cm -3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液的质量分数为( )A.等于12.5%B.大于12.5%C.小于12.5%D.无法确定喷泉实验成败的关键:① 装置必须密闭 , ② 仪器必须干燥 , ③ 气体尽量集满 。
(2)氨跟酸的反应,酸溶液均吸收NH 3而生成铵盐。
NH 3 + HCl === (现象) (3)氨跟氧气反应(氨的催化氧化)(放热反应,工业上制HNO 3的第一步反应) [氨的催化氧化实验]现象:红棕色气体产生 原因: 有烟生成 原因: 铂丝保持红热 原因:注意:氨对多种金属都具有强烈的腐蚀作用,一般将不能直接用金属器皿保存(4)氨气与氧化剂反应(如:Cl 2 ,氨气中N 为-3价,可以被氧化到0价 ,表现还原性) (5)侯氏制碱法中,NH 3 的作用: 使溶液呈碱性,增大CO 2 的溶解度 练习:1、把含硫酸铵和硝酸铵的混合液分成两等份。
一份加入bmol NaOH 并加热,恰好把NH 3全部Aa2c -b 4a b 原理: 四、铵盐 1 铵盐的物理性质 均是______化合物,均是___溶于水的晶体 2 化学性质 (1)铵盐受热分解NH 4Cl== (NH 3+HCl== ) (假升华现象) 特殊的:NH 4I== NH 4I 受热时会有紫色气体产生。
NH 4HCO 3== (NH 4)2CO 3== (2):铵盐跟碱反应:溶液较稀生成________;溶液较浓或加热生成______ NH 4Cl+NaOH (浓溶液)____________________ NH 4Cl+NaOH (稀溶液)____________________磷白磷 红磷 :白色或黄色固体,正四面体,键角60。
,易溶于CS 2,不溶于水,剧毒, 着火点40℃,少量保存在水里:红棕色固体,结构复杂,不溶于水,也不溶于CS 2,无毒,着火点比白磷高。
4 P +5 02 == 2 P 2O 5点燃2 P +3 Cl 2==2 PCl 3 (Cl 2不足)点燃 点燃2 P +5 Cl 2 === 2PCl 5 (Cl 2过量) 固态 液态 △ NH 4Cl+NaOH ===五、硝酸的性质1.物理性质:纯净硝酸是色、挥发,有气味的液体,与水任意比互溶。
硝酸不稳定易分解,常用浓硝69%(约为16 mol·L-1),98%以上的浓硝酸叫“_____________”。
2.化学性质,硝酸是一种强酸,除具有酸的通性外还有它本身的特性。
(1)酸的通性:使指示剂变色:稀硝酸使紫色石蕊试液;浓硝酸使紫色石蕊试液(2)硝酸的不稳定性:硝酸的浓度越大越易分解,温度越高分解越快,光越强分解越快。
为了防止硝酸的分解,必须把它盛在_______色瓶里密封贮放在黑暗而且温度低(冷暗处)的地方。
常用浓硝酸略带黄色,是因为____________________________________________。
如果将浓硝酸加热分解产生的气体收集起来再溶于水时,该混合气可被水完全吸收,无残留气体。
这是因为(用反应式表示)________________________用什么方法去掉硝酸中的黄色?(3)硝酸的氧化性硝酸是一种很强的剂,不论稀硝酸还是浓硝酸都有性。
硝酸越浓越强。
同浓度的硝酸温度越高越强。
a、与金属(除Au、Pt):在反应中硝酸均既表现氧化性又表现酸性。
Cu + HNO3(浓)=__________________________离子方程式:_______________________________;Cu + HNO3(稀)= __________________________离子方程式:______________________________注:收集NO2的方法:收集NO的方法:铝、铁遇硝酸产生________现象,即浓硝酸将它们表面氧化成一层薄而致密的氧化物薄膜、阻止了进一步反应的缘故。
Fe(少)+ HNO3(稀)= __________________________Fe(过)+ HNO3(稀)= __________________________Fe(少)+ HNO3(浓)= __________________________Fe(过)+ HNO3(浓)= __________________________b、与非金属C+ HNO3(浓)= __________________________c、与有还原性的物质如H2S(S2-、HS-)、Na2SO3(SO32-、HSO3-)、SO2、HBr(Br-) 、HI(I-)、Fe2+注:NO3-本身没有强氧化性,而当NO3-和H+在一起时则形成硝酸,不能和Fe2+、SO32-、I-、Br-、S2-共存d.王水(浓硝酸和浓盐酸体积比_________)能使Pt、Au溶解。