第四章 配合物
- 格式:ppt
- 大小:2.65 MB
- 文档页数:114

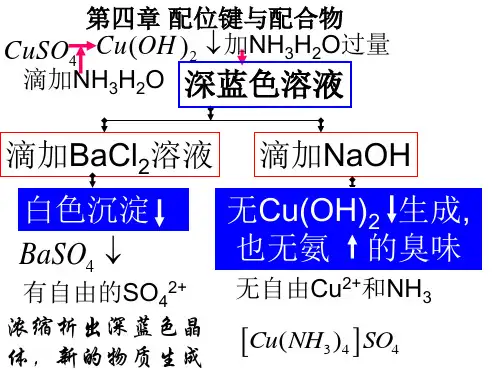


第4章:配合物一.配合物的组成(1)配位体:是含有孤电子对的分子或离子,如NH3、Cl-、CN-等。
配位体中直接同中心原子配合的原子,叫做配位原子。
如上例[Cu(NH3)4]2+配离子中,NH3是配位体,其中N原于是配位原子。
配位原子经常是含有孤对电子的原子。
(2)中心离子(或原子):一般是金属离子,特别是过渡金属离子,但也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。
此外,少数高氧化态的非金属元素也能作为中心原子存在,如SiF62-中的Si(Ⅳ)及PF6-中的P(V)等。
(3)配位数:直接同中心离子(或原子)配合的配位原子的数目,叫做该中心离子(或原子)的配位数,一般中心离子的配位数为2、4、6、8(较少见),如在[Pt(NH3)6]C14中,配位数为6,配位原子为NH3分子中的6个氮原子。
(4)配离子的电荷:配离子的电荷数等于中心离子和配位体电荷的代数和。
如[Cu(NH3)4]2+的电荷是+2+(0)×4=+2。
二.配合物的分类配位化合物的范围极广,主要可以分为以下几类:(1)单核配合物这类配合物是指一个中心离子或原子的周围排列着一定数量的配位体。
中心离子或原子与配位体之间通过配位键而形成带有电荷的配离子或中性配合分子。
如[Cu(NH3)4]SO4、K4[Fe(CN)6]等皆属于此类配合物。
(2)螯合物这类配合物是由多齿配位体以两个或两个以上的配位原子同时和一个中心离子配合并形成具有环状结构的配合物。
例如乙二胺H2N-CH2-CH2-NH2和Cu2+形成的如下螯合物:三.配合物的命名配合物的命名与一般无机化合物的命名原则相同。
若配合物的外界是一简单离子的酸根,便叫某化某;若外界酸根是一个复杂阴离子,便叫某酸某(反之,若外界为简单阳离子,内界为配阴离子的配合物也类似这样叫法)。
若配离子的内界有多种配体,须按下列顺序依次命名:简单离子—复杂离子—有机酸根离子;而中性分子配位体的命名次序为:H2O—NH3—有机分子。


第四章配合物一、判断题1. 所有八面体构型的配合物比平面四方形的稳定性强。
.()2. 所有金属离子的氨配合物在水中都能稳定存在。
.()3. 价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物,又能形成外轨型配合物。
()4. 所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。
.()5. 内轨型配合物往往比外轨型配合物稳定,螯合物比简单配合物稳定,则螯合物必定是内轨型配合物。
.()6. 内轨型配合物的稳定常数一定大于外轨型配合物的稳定常数。
.()7. 不论配合物的中心离子采取d2sp3或是sp3d2杂化轨道成键,其空间构型均为八面体形。
.()8. [Fe(CN)6]3-和[FeF6]3-的空间构型都为八面体形,但中心离子的轨道杂化方式不同。
()9. [Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0。
()10. K3[FeF6]和K3[Fe(CN)6]都呈顺磁性。
()11. Fe2+的六配位配合物都是反磁性的。
.()12. 在配离子[AlCl4]-和[Al(OH)4]-中,Al3+的杂化轨道不同,这两种配离子的空间构型也不同。
()13. 已知E(Cu2+/Cu)=0.337V,E([Cu(NH3)4]2+/Cu)=-0.048V,则E([Cu(CN)4]2-/Cu)<-0.048V。
()14. Ni2+的四面体构型的配合物,必定是顺磁性的。
()15. 已知E(Ag+/Ag)=0.771V,E([Ag(NH3)2]+/Ag)=0.373V,则E([Ag(CN)2]-/Ag)>0.373V。
()16. 按照价键理论可推知,中心离子的电荷数低时,只能形成外轨型配合物,中心离子电荷数高时,才能形成内轨型配合物。
.()17. 以CN-为配体的配合物,往往较稳定。
()18. Ni2+的平面四方形构型的配合物,必定是反磁性的。
.()19. 所有Fe3+的八面体配合物都属于外轨型配合物。




第四章配合物之练习参考答案1解:取少量粗盐酸,适当稀释,则黄色消失,说明配离子[FeCl4]-不稳定,已分解为Fe3+和Cl-。
再加入KSCN溶液,有血红色溶液生成,说明有自由的Fe3+存在。
而取未稀释的粗盐酸加入KSCN溶液却无现象,证明无自由的Fe3+存在,这时的Fe(Ⅲ)是以[FeCl4]-形式存在。
2解:对于配离子FeF63-和FeCl4-,中心离子相同,配体不同,因半径:F-<Cl-,配体半径增大,相互间的排斥作用增大,要使配离子稳定,则只有减小配位数,所以Fe3+与Cl-形成配离子时只能是4配位。
3解:4解:该配合物无几何异构。
因只有一种配体,且由于乙二胺分子本身的大小决定了它不能采用对位结构(张力太大),则无几何异构。
但它有一对对映异构体。
5解:因为双齿配体C2O42-的碳链很短,不可能对位配位。
其顺式有极性,且水溶性大,而反式无极性,不溶于水。
6解:由于只有外界离子在水中可完全电离而与Ag+生成AgCl沉淀,由沉淀所需AgNO3的量可推出:黄色CoCl3·6NH3应为[Co(NH3)6]Cl3;紫红色CoCl3·5NH3应为[Co(NH3)5Cl]Cl2;绿色CoCl3·4NH3应为[Co(NH3)4Cl2]Cl;紫色CoCl3·4NH3应为[Co(NH3)4Cl2]Cl。
(它与绿色配合物互为几何异构体)它们的电导之比约为4:2:1:1。
7解:Fe2+的价电子构型为3d64s0,Co3+的也为3d64s0。
由于CN-为强场配体,可使Fe2+的3d轨道上的电子重排而空出2条轨道,则在[Fe(CN)6]4-中Fe2+采用d2sp3杂化。
同理,NH3也可使Co3+重排形成内轨型配合物,则也采用d2sp3杂化。
8解:RuCl2(H2O)4+有2个立体异构体,它们是:RuCl3(H2O)3有2个立体异构体,它们是:它们水解后均转化为一种异构体A,则只能是顺式的结构.10解:(1)[CoCl2(H2O)(NH3)3]Cl (2) K2[PtCl6](3) (NH4)3[Cr(SCN)4Cl2] (4) Ca[Co(C2O4)2(NH3)2]211解:这五种配合物的化学式均为K2[CoCl2I2(NH3)3],它们互为几何异构体,中心离子氧化态为+2。