第六章单组元相图及纯晶体的凝固
- 格式:ppt
- 大小:11.85 MB
- 文档页数:45
第6章单组元相图及纯晶体的凝固6.1 复习笔记一、单元系相变的热力学及相平衡1.相平衡条件和相律组元:组成一个体系的基本单元,如单质(元素)和稳定化合物,称为组元。
相:体系中具有相同物理与化学性质的且与其他部分以界面分开的均匀部分,称为相。
相律:F=C-P+2;式中,F为体系的自由度数,它是指不影响体系平衡状态的独立可变参数(如温度、压力、浓度等)的数目;C为体系的组元数;P为相数。
常压下,F=C-P+1。
2.单元系相图单元系相图是通过几何图像描述由单一组元构成的体系在不同温度和压条件下可能存在的相及多相的平衡。
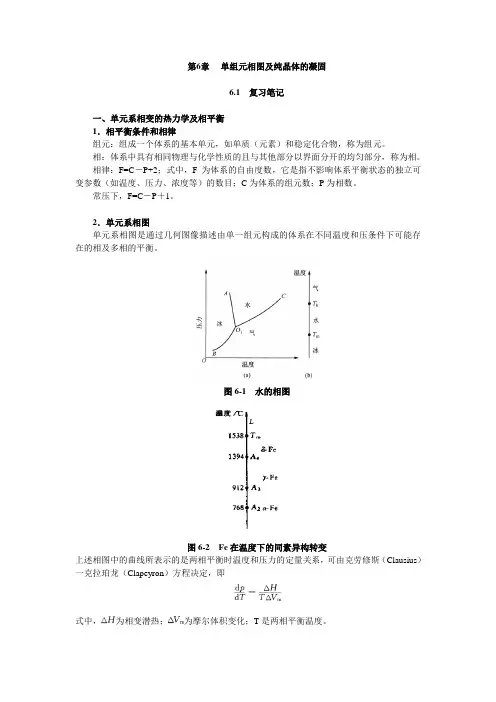
图6-1 水的相图图6-2 Fe在温度下的同素异构转变上述相图中的曲线所表示的是两相平衡时温度和压力的定量关系,可由克劳修斯(Clausius)一克拉珀龙(Clapeyron)方程决定,即式中,为相变潜热;为摩尔体积变化;T是两相平衡温度。
有些物质在稳定相形成前,先行成自由能较稳定相高地亚稳定相。
二、纯晶体的凝固1.液态结构(1)液体中原子间的平均距离比固体中略大;(2)液体中原子的配位数比密排结构晶体的配位数减小;(3)液态结构的最重要特征是原子排列为长程无序,短程有序,存在结构起伏。
2.晶体凝固的热力学条件(6.1)式中,,是熔点T m与实际凝固温度T之差;L m是熔化热。
晶体凝固的热力学条件表明,实际凝固温度应低于熔点T m,即需要有过冷度△T。
3.形核晶体的凝固是通过形核与长大两个过程进行的,形核方式可以分为两类:均匀形核和非均匀形核。
(1)均匀形核①晶核形成时的能量变化和临界晶核新相晶核是在母相中均匀地生成的,即晶核由液相中的一些原子团直接形成,不受杂质粒子或外表面的影响假定晶胚为球形,半径为r,当过冷液中出现一个晶胚时,总的自由能变化:(6.2)由,可得晶核临界半径:(6.3)代入公式(1),可得:(6.4)由式可知,过冷度△T越大,临界半径则越小,则形核的几率越大,晶核数目增多。








第6章单组元相图及纯晶体的凝固物质由液态转变为固态的过程称为凝固。
物质由液态转变为晶态的过程称为结晶材料的性能组织结构相种类数量尺寸形状分布C ONTENTS6.1 单元系相变的热力学及相平衡6.2纯晶体的凝固6.1单元系相变的热力学及相平衡1. 相(Phase)在一个系统中,成分、结构相同,性能一致的均匀的组成部分叫做相,不同相之间有明显的界面分开,该界面称为相界面。
注意:相在物理性能和化学性能上是均匀的。
相界面和晶界的区别。
6.1单元系相变的热力学及相平衡2. 组元(Component)组元通常是指系统中每一个可以单独分离出来,并能独立存在的化学纯物质,在一个给定的系统中,组元就是构成系统的各种化学元素或化合物。
按组元数目,将系统分为:一元系二元系三元系……化学元素:Cu, Ni, Fe 等化合物:Al 2O 3, MgO, Na 2O, SiO 2等6.1单元系相变的热力学及相平衡3. 相平衡在某一温度下,系统中各个相经过很长时间也不互相转变,处于平衡状态,这种平衡称为相平衡。
各组元在各相中的温度、压力和化学势相同。
A B热力学动态平衡6.1单元系相变的热力学及相平衡4.吉布斯相律(Gibbs Phase Rule)处于热力学平衡状态的系统中自由度与组元数和相数之间的关系定律,通常简称为相律。
f = C-P+N只考虑温度和压力对系统平衡状态的影响:f = C-P+2凝聚系统:f = C-P+1式中:f(freedom)是自由度数;C(component)是组成材料系统的独立组元数;P(phase)是平衡相的数目。
吉布斯相律的应用和局限性相律是检验、分析和使用相图的重要工具,利用它可以分析和确定系统中可能存在的相数,检验和研究相图。
注意使用相律有一些限制:(1)只适用于热力学平衡状态,各相温度相等、压力相等、化学势相等(化学平衡)。
(2)只表示体系中组元和相的数目,不能指明组元和相的类型和含量。

凝固4.1.2相律4.1 相图的基本知识相律:在平衡条件下,一个系统的组成物的组元数、相数、和自由度数之间的关系可以由相律来确定。
相律的数学表达式如下:F ——系统的自由度数C ——组成物的组元数P ——系统中能够同时存在的相数2 ——表示温度和压力两个变量,对于不含气相的凝聚体系,压力的影响极小,可以不把压力当作变量而看作常量:1个大气压(atm),因此自由度数减少一个,相律的表达式为:4.1.2 相律☐在压力不变(1atm )的条件下,F = C –P +1 = 2–P。
F = 0的含义是:在保持系统平衡状态不变的条件下,没有可以独立变化的变量。
即,任何变量的变化都会造成系统平衡状态的变化。
◼自由度数F 的最小值为0,当F = 0时,P = 2。
◼这说明,在压力不变(1atm)条件下,单元系统最多只能有二相同时存在。
(表现为??图形)☐如果压力可变,◼F = 0时,由公式F = C -P + 2 可知P = 3,◼单元系统最多可以有三相共存。
(表现为??图形)4.1.2 相律☐在压力不变(1atm)的条件下,F = C–P+1 = 3–P。
◼自由度数F的最小值为0,当F= 0时,P= 3。
◼这说明,当二元合金系统同时出现三个相时,就没有可以变化的因素了☐也就是说,只有在一定的温度、成分所确定的某一点才会出现三相同时存在的状态。
☐表现为??图形4.1.2 相律☐在压力不变(1atm)的条件下,F = C–P+1 = 3–P。
◼可以推断出,二元合金系统存在“三相共存状态”的平衡反应,仅有二大类型:A→B+C,A+B→C。
☐由于自由度数为0,这些平衡反应都是恒温反应,并且反应中的三个相(无论是反应相,还是生成相)的化学成分都是固定的。
☐只有当反应结束后(相数小于3时),随着温度的变化,相的化学成分才可能发生变化。
❶液体中原子间的平均距离比固体中略大;液态结构的特征❷液体中原子的配位数•对于密排结构晶体,液态时配位数减小——导致熔化时体积略为增加,•但对非密排结构的晶体,则液态时配位数反而增大,故熔化时体积略为收缩。
