第四章-结构化学
- 格式:doc
- 大小:42.00 KB
- 文档页数:10




《结构化学》第四章习题答案4001C3+i; C3+σh4002(非)4003(非)4004不对4005(D)4006(B)4008i; n个C24009(C)4010(否)4011①C2h: C2(1), σh(1),i②C3v: C3(1),σv(3)③S4 : I4或S4④D2: C2(3)⑤C3i: C3(1),i4012(1) C3v(2) C2v(3) C s(4) C2v(5) D2d4013D3h4014有2 种异构体; 其一属于C2v,另一属于D4h。
4015D3h4016①平面六元环; ②D3h ; ③平面,有两个双键; ④C2h4017(1) D4h(2) C4v(3) C2v(4) D5h(5) C s4018C3v; C34019(C)4020(E)4022是4023D34024SO3: D3h;SO32-: C3v;CH3+: D3h;CH3-: C3v;BF3: D3h。
4025(1) D2h;(2) D2d;(3) D2。
4026C3v; D2h; O h; C3v; C3v。
4027(B)4028C2和D2h4029C2v; ∏344030SO2: C2v;CO2: D∞h;304031C s; C3v; C s。
4032D4h; C3v; C2; C s; D2h; T d。
4033C2v; C2v;。
4034I84035(A)4036(D)4037(D)4038(A)4039(B)4041(C)40424043C n;D n; T; O。
4044I n:分子有I n,无旋光;分子无I n,可能观察到旋光。
4045(E)4046(1) C3v,有(2) C2v,有(3) D3h,无(4) D2d,无(5) C s,有4047(1) C s,有(2) D∞v,有(3) C2,有(4) D5h,无(5) C2v,有4048C n4049点群旋光性偶极矩C i无无C n有有C nh无无C nv无有S n无无D n有无D nh无无D nd无无T d无无O h无无4050D n或T或O ; C nv40514052D3h; D3d; D3。


2组长:070601314组员:070601313070601315070601344070601345070601352第四章 双原子分子结构与性质1.简述 LCAO-MO 的三个基本原则,其依据是什么?由此可推出共价键应具有什么样的特征?答:1.(1)对称性一致(匹配)原则: φa = φs 而φb = φ pz 时, φs 和φ pz 在σˆ yz 的操作下对称性一致。
故 σˆ yz ⎰φs H ˆφ pz d τ = β s , pz ,所以, β s , pz ≠ 0 ,可以组合成分子轨道(2)最大重叠原则:在 α a 和α b 确定的条件下,要求 β 值越大越好,即要求 S ab 应尽可能的大(3)能量相近原则: 当α a = α b 时,可得 h = β ,c 1a = c 1b , c 1a =- c 1b ,能有效组合成分子轨道;2.共价键具有方向性。
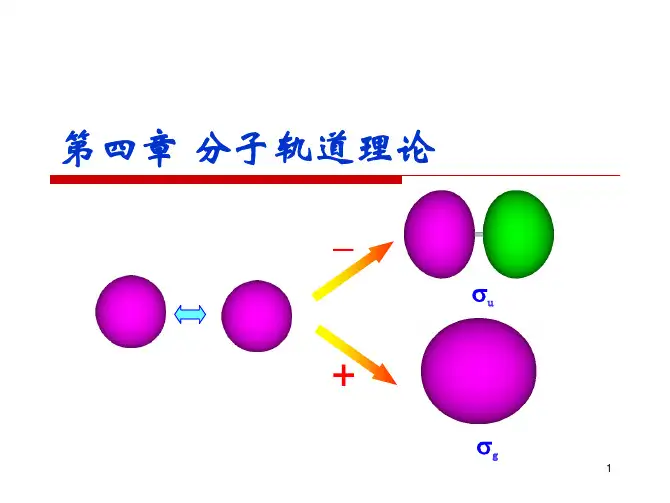
2、以 H 2+为例,讨论共价键的本质。
答:下图给出了原子轨道等值线图。
在二核之间有较大几率振幅,没有节面,而在核间值则较小且存在节面。
从该图还可以看出,分子轨道不是原子轨道电子云的简单的加和,而是发生了波的叠加和强烈的干涉作用。
图 4.1 H + 的 ψ 1(a)和 ψ 2(b)的等值线图研究表明,采用 LCAO-MO 法处理 H 2+是成功的,反映了原子间形成共价键 的本质。
但由计算的得到的 Re=132pm ,De=170.8kJ/mol ,与实验测定值Re=106pm、De=269.0 kJ/mol 还有较大差别,要求精确解,还需改进。
所以上处理方法被称为简单分子轨道法。
当更精确的进行线性变分法处理,得到的最佳结果为Re=105.8pm、De=268.8 kJ/mol,十分接近H2+的实际状态。
成键后电子云向核和核间集中,被形象的称为电子桥。
通过以上讨论,我们看到,当二个原子相互接近时,由于原子轨道间的叠加,产生强烈的干涉作用,使核间电子密度增大。



2组长:070601314 组员:070601313070601315 070601344 070601345070601352第四章 双原子分子结构与性质1.简述 LCAO-MO 的三个基本原则,其依据是什么?由此可推出共价键应具有什么样的特征?答:1.(1)对称性一致(匹配)原则: φa = φs 而φb = φ pz 时, φs 和φ pz 在σˆ yz 的操作下对称性一致。
故 σˆ yz ⎰φs H ˆφ pz d τ = β s , pz ,所以, β s , pz ≠ 0 ,可以组合成分子轨道(2)最大重叠原则:在 α a 和α b 确定的条件下,要求 β 值越大越好,即要求 S ab 应尽可能的大(3)能量相近原则: 当α a = α b 时,可得 h = β ,c 1a = c 1b , c 1a =- c 1b ,能有效组合成分子轨道;2.共价键具有方向性。
2、以 H 2+为例,讨论共价键的本质。
答:下图给出了原子轨道等值线图。
在二核之间有较大几率振幅,没有节面,而在核间值则较小且存在节面。
从该图还可以看出,分子轨道不是原子轨道电 子云的简单的加和,而是发生了波的叠加和强烈的干涉作用。
图 4.1 H +的 ψ 1(a)和 ψ 2(b)的等值线图研究表明,采用 LCAO-MO 法处理 H 2+是成功的,反映了原子间形成共价键的本质。
但由计算的得到的Re=132pm,De=170.8kJ/mol,与实验测定值Re=106pm、De=269.0 kJ/mol 还有较大差别,要求精确解,还需改进。
所以上处理方法被称为简单分子轨道法。
当更精确的进行线性变分法处理,得到的最佳结果为Re=105.8pm、De=268.8 kJ/mol,十分接近H2+的实际状态。
成键后电子云向核和核间集中,被形象的称为电子桥。
通过以上讨论,我们看到,当二个原子相互接近时,由于原子轨道间的叠加,产生强烈的干涉作用,使核间电子密度增大。
《结构化学》第四章第四章:结构化学结构化学是化学中的一个重要概念,是关于物质结构的研究。
在化学中,物质的性质与其分子或原子的结构紧密相关。
因此,理解和研究物质的结构对于进一步探索其性质、制备新材料和开发新药具有重要意义。
结构化学的研究主要涉及化学键、分子空间排列、晶体结构等方面。
在化学键中,主要包括共价键和离子键。
共价键是通过共享电子对来连接原子的,离子键是由带正电荷的阳离子和带负电荷的阴离子之间的静电力相互作用形成的。
共价键通常具有较强的稳定性,而离子键较易解离。
分子空间排列是指分子中各原子之间的相对位置关系。
这是由于原子之间的相互作用力所决定的,包括库仑引力、范德华力、氢键等。
这些相互作用力会导致分子在空间中呈现出不同的三维结构,如线性、平面、立体等。
这些结构决定了分子的性质,如极性、非极性、溶解度等。
晶体结构是指晶体中各原子或分子之间的空间排列模式。
晶体可以看作是由大量重复排列的单元结构单元组成的周期性结构。
晶体结构的研究为合成新材料和功能材料提供了重要依据。
例如,金刚石的硬度和光学性质与其密排的晶格结构有关。
此外,有机化学中的分子结构也是结构化学的重要内容之一、有机化合物中的碳原子可以通过共价键连接在一起,形成不同的碳骨架结构,如直链、支链、环和螺旋等。
这些结构决定了有机物的化学性质和反应性,如稳定性、活性、亲核性和电荷云的分布等。
总之,结构化学是化学中一个重要的研究领域,它关注物质的结构与性质之间的关系。
通过研究物质的结构,可以深入理解和解释其性质,为新材料和新药的设计和开发提供理论指导。
因此,结构化学在化学学科中具有重要的地位和作用。
第四章结构化学1一个电子排布式为1s22s22p63s23p1的元素,其热力学最稳定的氧化态是:(A) +1 (B) +2 (C) +3 (D) –1 (E) –22 将一个基态氢原子的电子转移到无限远的地方,需要2.179⨯10-18J。
若将一个电子由n = 3的能级激发到n = ∞的能级,所需要的能量为:(A) 2.42⨯10-19J (B) 3.63⨯10-19J(C) 7.26⨯10-19J (D)4.84⨯10-19J3下列哪个离子中的半径最小?(A) K+(B) Ca2+ (C) Sc3+ (D) Ti3+ (E) Ti4+4 由偶极诱导产生的分子间作用力称为:(A)离子键 (B) 氢键 (C) 配位键 (D)范德华力5密立根(Millikan)油滴实验测定了:(A) 荷质比 (B) K层的电子数 (C) 电子的电荷值 (D) 普朗克常数 (E) 阿伏加德罗常6 OF2分子的电子结构是哪种杂化?(A)sp2 (B) sp (C) sp3 (D) spd3 (E) sd27任一原子的s轨道:(A)与角度无关 (B) 与sinθ有关 (C) 与cosθ有关 (D) 与sinθcos θ有关(E) 与sinθcosθ无关8电子位于确定的轨道或能级的最好的证明(或观察)是:(A)原子光谱是由不连续的谱线组成的,不含连续带(B)β射线中的电子有很高的动能(C)阴极射线电子的穿透能力决定于产生阴极射线的电压(D)电子围绕原子核旋转(E) 金属中的电子一般是自由电子9如果一个原子的主量子数是3,则它:(A)只有s电子和p电子(B)只有s电子(C)只有s,p和d电子(D)只有s,p,d和f电子(E) 只有p电子10 下列哪一个化合物为极性共价化合物:(A) B2H6(B) NaCl (C) CCl4(D)H 2S (E) CH411 下列描述配合物的配位数与空间构型关系的说法不正确的是:(A)中心离子配位数为2的配合物均为直线形;(B) 中心离子配位数为3的配合物均为三角形;(C) 中心离子配位数为4的配合物均为四面体型;(D) 中心离子配位数为6的配合物均为八面体型。
12碱金属元素锂、钠、钾、铷、铯的熔点最低的金属是:(A) 钠 (B) 钾 (C) 铷 (D) 铯 (E) 锂13 下列哪一个分子或离子不是直线形的:(A) CO2 (B) [Ag(CN)2]- (C) I3- (D)BeCl2(g) (E) O314 具有1s22s22p63s23p4电子结构的原子是:(A) Mg (B) Fe (C) Cr (D) Al (E) S15 下列化合物中,哪一个氢键表现得最强?(A) NH3 (B) H2O (C) H2S (D) HCl (E) HF16⎪ψ⎪2的物理意义是:(A) 电子云的角度分布图 (B) 核外电子运动的轨道(C) 核外电子的数学表达式 (D) 电子在微体积元中出现的几率密度(E) 电子在空间某点(r,θ,ϕ)出现的几率17根据量子力学,一个原子轨道是指:(A) 含义与玻尔理论中所指的原子轨道相同(B) n具有一定数值的一个波函数(C) n,l,m三个量子数都具有一定数值的一个波函数(D) n,l,m,m s四个量子数都具有一定数值的一个波函数18有关“镧系收缩”的下列陈述中,正确的是:(A) f区元素的原子半径递变幅度比其它周期大(B) “镧系收缩”是指镧系元素随着原子序数的增加,原子半径递减(C) “镧系收缩”是指镧系元素随着原子序数的增加,原子半径呈快速减小的趋势(D) 由于“镧系收缩”效应,Nb、Ta的原子半径相近,它们的分离困难(E) 除f区外,其它区元素随着元素原子序数增加,原子半径没有收缩现象19下列有关元素的氧化数的叙述中,不正确的是:(A)s区元素不呈负氧化数 (B) p区元素一般有两种或两种以上的氧化数(C) d区元素一般有两种或两种以上的氧化数(D) f区元素一般有两种或两种以上的氧化数20石墨中的碳原子层是由连接在一起的。
(A)配位键 (B) 共价键 (C) 双键 (D) 自由电子 (E) 范德华力21下列叙述中,哪一个是正确的陈述?(A)金属的离子半径和它的原子半径相同 (B) 金属的离子半径大于它的原子半径 (C) 非金属离子半径与其原子半径相等(D) 非金属的原子半径大于其离子半径 (E) 金属离子半径小于其原子半径22根据鲍林近似能级图,在多电子原子中,基态时,下列电子均处于一定的能级,其中占据能级最高轨道的电子是:(A) 2,1,-1,+1/2 (B) 2,0,0,+1/2(C) 3,1,-1,+1/2 (D) 3,2,-1,+1/2 (E) 4,0,0,-1/223氨分子的结构是:(A) 平面的 (B) 线型的 (C) 三角锥 (D) 正方形 (E) 四面体24化学键的离子性程度最好是从下列哪一种性质来测定?(A) 沸点 (B) 在适当溶剂中的电离度 (C) 转动光谱 (D) 熔点 (E) 偶极矩25 Co2+离子的价层电子构型的是:(A) 3d7 (B) 3d74s2 (C) 3d54s2 (D)3d10 (E) 4s226 与碱土金属相比,碱金属表现出(A) 较大的硬度 (B) 较高的熔点 (C) 较小的离子半径 (D) 较低的电离能 (E) 较高的沸点27水分子的键角最接近于:(A) 90︒ (B) 105︒ (C) 109︒ (D)120︒ (E) 180︒28 基态时,28号元素的核外电子构型是:(A)1s22s22p63s23p63d10(B) 1s22s22p63s23p63d24s24p64d10(C) 1s22s22p63s23p64s24p65s2(D) 1s22s22p63s23p63d84s2(E) 1s22s22p63s23p63d14s24p64d129根据核外电子排布规则,可以肯定:(A)原子的价层电子数不超过8(B)周期数等于基态原子的能级最高轨道的主量子数(C)族数等于基态原子的价层电子数(D)一个原子中,没有两个电子具有四个完全相同的量子数(E) 在多电子原子中,3d轨道的能级高于4s轨道的能级30下面哪一种分子的偶极矩最大?(A) HCl (B) H2(C) HI (D)HBr (E) HF31溴水中,Br2分子与水分子之间存在:(A) 取向力、诱导力 (B) 诱导力、色散力(C) 取向力、色散力 (D) 诱导力 (E) 色散力32 下列哪一种化合物含有叁键?(A) H2SO4(B) HCN (C) CO2(D)HNO3 (E) C6H633 下列哪一种元素的电负性最大?(A) He (B) Cl (C)O (D) At (E) F34下列化合物中,存在分子间氢键的是:(A) 乙醚 (B) 丙酮 (C) 乙醇 (D) 氟里昂22 (E) 甲烷35 含有奇数电子的原子是:(A) 顺磁性的 (B) 逆磁性的 (C) 铁磁性的 (D) 超磁性的 (E) 反铁磁性的36 下列分子或离子中,中心原子不采取sp3杂化的是:(A) NH3 (B) H2S (C) NO3(D)B 2H6(E) CCl437哪一种惰性气体的沸点最低?(A)He (B) Ne (C) Ar (D) Kr (E)Xe38下列哪一个分子的空间构型为三角锥?(A) BCl3 (B) I3- (C) H3O+ (D)CO32- (E) N3-39下列化合物中属于共价型化合物的是:(A) AlF3 (B) HgCl2(C) FeCl2(D)CaO (E) SnCl440 下列有机化合物中,沸点最低的是:(A) 氯甲烷 (B) 氯乙烷 (C) 氯丙烷 (D) 氯丁烷(E) 氯戊烷41下列分子中,极性最弱的是:(A) NH3 (B) PH3(C)AsH3 (D) SbH342 下列配合物中,中心离子的杂化轨道类型属于外轨型的是:(A) d2sp3 (B) dsp3 (C) dsp2 (D) sp3d243 下列配合物中,不属于外轨型配合物的是:(A) [Ag(CN)2]- (B) [Zn(CN)4]2- (C) [Cu(NH3)4]+ (D)[Cu(CN)2]-44 在下列配合物中,磁距最大的配合物是:(A) [CoF6]3-(B) [Co(en)2Cl2]+ (C) [Fe(EDTA)]-(D) [Cr(NH3)6]3+ (E) [Mn(H2O)6]2+45 用杂化轨道理论预测下列分子的空间构型,其中为正四面体的是:(A) SiH4 (B) CH3Cl (C) SF4(D) XeO4(E)CHCl346下列物质中,含有一个未成对电子的物质是:(A) SO2 (B) SiO2(C) NO2+ (D) NO2(E)N 2O 447 下列分子按键角由大到小的排列顺序,正确是的:(A) NH3 > NH4+ > NO3- (B) NO3- > NH4+ > NH3(C) NH4+ > NO3- > NH3(D) NO3- > NH3> NH4+48同一系列化合物(如HX)的分子间力的影响因素是:(A) 温度 (B) 电子数 (C) 离子半径 (D) 键的极性 (D) 电负性49 配离子的稳定性与其配位键类型有关。
根据价键理论可以判断下列配合物稳定性的大小,其中正确的是:(A) [Fe(CN)6]3-< [Fe(H2O)6]3+ (B) [Fe(CN)6]3-> [Fe(H2O)6]3+(C) [Ag(CN)2]-< [Ag(NH3)2]- (D) [Ni(en)3]2+< [Ni(NH3)6]3+50通过测定AB2型分子的偶极距,能够判断:(A) 分子的空间构型 (B) 两元素的电负性之差(C) A—B键的极性 (D) A—B键的键长4-1为什么BCl3与NCl3的水解过程不同,理由何在?4-2 在下列情况下,要克服哪种类型的吸引力:(A) 冰融化 (B) NaCl溶于水 (C) MgCO3分解为MgO (D) 硫溶于CCl4中4-3试从原子结构解释以下各项:(1)逐级电离能总是I1<I2<I3……。
(2)第二、第三周期的元素由左到右第一电离能逐渐增大并出现两个转折点。
(3)电离能总为正,且数值上大于电子亲和能。
4-4 讨论BF3和BF4-、NH3和NH4+、H2O和H3O+几何构型的差别及其原因。
4-5解释下列问题(1)CCl4是液体,CH4和CF4是气体,而CI4是固体。
(2)NaF的熔点高于NaCl。
参考答案:4-1 C 4-2 A 4-3 E4-4 D 4-5 C4-6 C 4-7 A 4-8 A4-9 C 4-10 D4-11 C 4-12D 4-13E 4-14 E 4-15 B4-16 D 4-17 C 4-18 D4-19 A 4-20 E4-21 E 4-22 D 4-23 C 4-24 E4-25 A4-26 D 4-27 B 4-28 D4-29 D 4-30 E4-31 B 4-32 B 4-33 E 4-34 B4-35 A4-36 C 4-37 A 4-38 C 4-39 B 4-40 A4-41 D4-42 D 4-43 C 4-44 E 4-45 A4-46 D 4-47 B 4-48 C4-49 B 4-50 A4-2 (A)氢键、色散力、诱导力、取向力;(B)离子键;(C)共价键;(D)色散力。