初中化学工艺流程题学习资料
- 格式:doc
- 大小:485.50 KB
- 文档页数:6
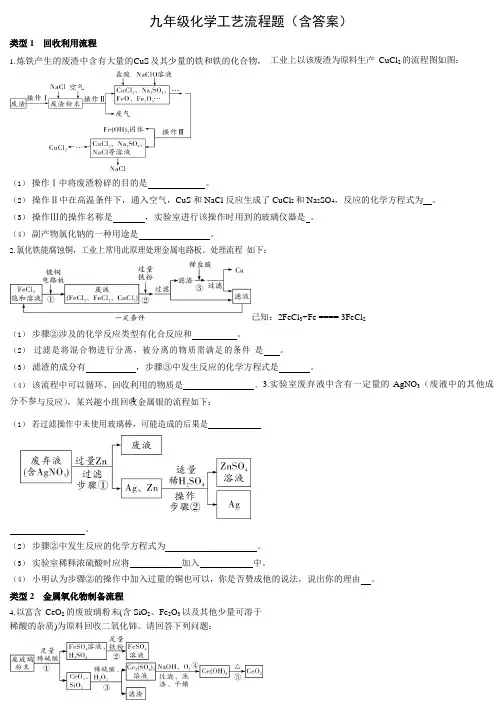
1九年级化学工艺流程题(含答案)类型 1 回收利用流程1. 炼铁产生的废渣中含有大量的CuS 及其少量的铁和铁的化合物, 工业上以该废渣为原料生产 CuCl 2 的流程图如图:(1)操作Ⅰ中将废渣粉碎的目的是。
(2) 操作Ⅱ中在高温条件下,通入空气,CuS 和 NaCl 反应生成了CuCl 2 和 Na 2SO 4,反应的化学方程式为 。
(3) 操作Ⅲ的操作名称是,实验室进行该操作时用到的玻璃仪器是 。
(4) 副产物氯化钠的一种用途是。
2. 氯化铁能腐蚀铜,工业上常用此原理处理金属电路板。
处理流程 如下:已知:2FeCl 3+Fe ==== 3FeCl 2(1) 步骤②涉及的化学反应类型有化合反应和。
(2) 过滤是将混合物进行分离,被分离的物质需满足的条件 是 。
(3) 滤渣的成分有,步骤③中发生反应的化学方程式是 。
(4) 该流程中可以循环、回收利用的物质是。
3.实验室废弃液中含有一定量的 AgNO 3(废液中的其他成分不参与反应),某兴趣小组回收金属银的流程如下:(1) 若过滤操作中未使用玻璃棒,可能造成的后果是。
(2) 步骤②中发生反应的化学方程式为 。
(3) 实验室稀释浓硫酸时应将加入中。
(4) 小明认为步骤②的操作中加入过量的铜也可以,你是否赞成他的说法,说出你的理由 。
类型 2 金属氧化物制备流程4. 以富含 CeO 2 的废玻璃粉末(含 SiO 2、Fe 2O 3 以及其他少量可溶于稀酸的杂质)为原料回收二氧化铈。
请回答下列问题:2已知: CeO 2 不溶于稀硫酸,也不溶于 NaOH 溶液。
(1) 稀硫酸属于 (填“混合物”或“纯净物”)。
(2) 滤渣的成分是,过滤后发现滤液仍比较浑浊, 可能的原因是。
(3) 步骤③中通入氧气的目的是。
(4) 氢氧化铈受热分解生成CeO 2 和 H 2O ,写出反应的化学方程式 。
5. 氧化镁在医药、建筑等行业应用广泛。
以菱镁矿(主要成分为MgCO 3,含少量 FeCO 3)为原料制备高纯度氧化镁的实验流程如下:(1) 操作 X 的名称是 ,该操作需要用到的玻璃仪器主要有: 烧杯、 、玻璃棒。
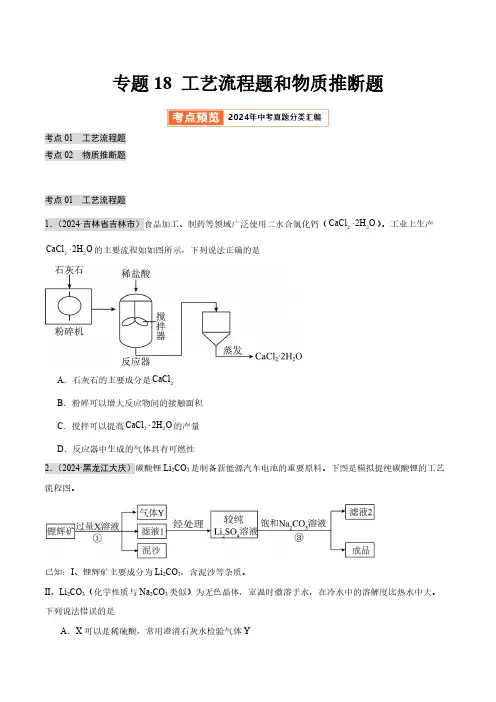
专题18 工艺流程题和物质推断题考点01 工艺流程题考点02 物质推断题考点01 工艺流程题1.(2024·吉林省吉林市)食品加工、制药等领域广泛使用二水合氯化钙(22CaCl 2H O ×)。
工业上生产22CaCl 2H O ×的主要流程如如图所示,下列说法正确的是A .石灰石的主要成分是2CaCl B .粉碎可以增大反应物间的接触面积C .搅拌可以提高22CaCl 2H O ×的产量D .反应器中生成的气体具有可燃性2.(2024·黑龙江大庆)碳酸锂Li 2CO 3是制备新能源汽车电池的重要原料。
下图是模拟提纯碳酸锂的工艺流程图。
已知:Ⅰ、锂辉矿主要成分为Li 2CO 3,含泥沙等杂质。
Ⅱ、Li 2CO 3(化学性质与Na 2CO 3类似)为无色晶体,室温时微溶于水,在冷水中的溶解度比热水中大。
下列说法错误的是A .X 可以是稀硫酸,常用澄清石灰水检验气体YB.将滤液2蒸发,当有较多固体出现时,停止加热C.②中适宜用冷饱和Na2CO3溶液D.此工艺可获得副产品Na2SO4K CO)的水溶液中加入贝壳烧成的灰3.(2024·湖南长沙)《周礼·考工记》中记载,古人曾在草木灰(含23(主要成分为CaO),利用生成物中能够去污的成分来清洗丝帛。
为了得到该去污液,某兴趣小组同学在老师的指导下设计了以下实验流程。
回答下列问题:(1)操作I的名称为;(2)该流程中涉及到所有的基本反应类型有分解反应、;(3)该去污液能消洗丝帛。
请你根据流程推测,该去污液中所含溶质的可能组成为(用化学式表示)。
4.(2024·湖北武汉)硫酸钡是白色固体,医疗上常用作透视肠胃的内服剂。
以毒重石(主要成分是碳酸钡,还含少量氧化铁和二氧化硅)为原料生产硫酸钡的工艺流程如图所示。
回答下列问题:(1)二氧化硅属于(填“单质”或“化合物”)。
(2)上述流程中涉及过滤,该操作用到的玻璃仪器有。

初中化学工艺流程题总结一、酸碱滴定法酸碱滴定法是一种常用的化学分析方法,用于测量溶液中酸碱度的浓度。
其基本原理是通过滴定试剂与待测溶液进行反应,以确定它们之间的化学当量关系。
以下是该工艺流程题的常见类型总结。
1. 一元强酸与强碱的滴定例题:已知稀硫酸中含有未知摩尔浓度的硫酸,需要用0.1 mol/L的氢氧化钠溶液滴定。
当滴定至中性时,消耗了25 mL的氢氧化钠溶液。
求硫酸的摩尔浓度。
解题思路:根据化学方程式,硫酸与氢氧化钠的化学反应为:H2SO4 + 2 NaOH -> Na2SO4 + 2 H2O根据化学反应的化学当量关系,1 mol的硫酸反应消耗2 mol的氢氧化钠。
所以,25 mL的0.1 mol/L的氢氧化钠溶液包含0.0025 mol的氢氧化钠。
根据反应的化学当量关系,该氢氧化钠溶液可滴定0.00125 mol的硫酸溶液。
所以,硫酸的摩尔浓度为0.00125 mol/0.025 L = 0.05 mol/L。
2. 一元弱酸与强碱的滴定例题:已知醋酸溶液的摩尔浓度为0.01 mol/L,需要用0.1 mol/L的氢氧化钠溶液滴定。
当滴定至中性时,消耗了30 mL的氢氧化钠溶液。
求醋酸的摩尔浓度。
解题思路:醋酸属于一元弱酸,与氢氧化钠滴定的反应为:CH3COOH + NaOH -> CH3COONa + H2O由于醋酸为一元弱酸,当它的摩尔浓度较小时,可以近似认为水解反应不产生明显的浓度变化。
因此,滴定反应仅发生在醋酸和氢氧化钠之间。
根据化学反应的化学当量关系,滴定30 mL的0.1 mol/L的氢氧化钠溶液需要滴定的醋酸溶液的摩尔数为0.003 mol。
所以,醋酸的摩尔浓度为0.003 mol/0.03 L = 0.1 mol/L。
二、常见沉淀反应沉淀反应是一种常见的化学反应类型,在化学工艺中起着重要的作用。
掌握常见的沉淀反应是理解化学工艺流程题的关键。
1. 盐酸和硫酸铜溶液的反应例题:盐酸和硫酸铜溶液反应生成了一种沉淀物。

专题突破五化学工艺流程、物质的转化与推断类型1化学工艺流程题1.工艺流程路线示意图关注流程图中的出线、进线均表示物料流向或操作流程、可逆线表示原料循环使用和核心化学反应。
2.常考操作术语及目的(1)对原料进行预处理的常用方法及其作用①粉碎(研磨):增大反应物的接触面积,加快反应速率或使反应充分进行或增大转化率。
②灼烧(煅烧):使固体在高温下分解或使杂质在高温下氧化、分解等。
(2)明确常用的分离方法①过滤:固液分离。
所需仪器有铁架台(带铁圈)、滤纸、漏斗、烧杯、玻璃棒。
②蒸发结晶:提纯溶解度随温度变化不大的溶质,如NaCl。
③降温结晶:提纯溶解度随温度变化较大溶质。
操作过程为加热浓缩→冷却结晶→过滤→洗涤→干燥。
浓缩:蒸发部分溶剂,提高溶液的浓度。
洗涤:尽量除去晶体表面的杂质或干扰物质。
干燥:除去固体中的水。
3.答题技巧(1)所设问题一般都是孤立的,在解答时不要求流程全看懂后再解答,看不懂的地方先跳过去,继续解答后面的问题。
(2)抓住一个关键点:一切反应或操作都是为了获得产品。
(3)推断流程图某一步中的物质,可以从上一步操作中反应物可能发生的反应入手进行分析,同时需注意所加试剂是否有剩余。
(4)陌生化学方程式的书写:根据箭头方向,箭头进入的是原料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
(5)循环利用的物质:步骤中某一步的产物是另一步的原料,根据图中箭头方向(可逆线)即可判断出可循环使用的物质。
例1(2020百色中考)轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,某同学设计流程(如图)以石灰石(杂质不反应也不溶于水)为原料制取轻质碳酸钙和氢氧化钠固体。
(1)写出第②步反应的化学方程式:CaO+H2O===Ca(OH)2。

化学初中工业流程题知识点总结
化学初中工业流程题主要涉及以下几个方面的知识:
1. 化学反应方程式:反应方程式是工业流程题的基础,要求正确书写反应式,并确定反应物和生成物。
2. 物质的分类:物质可以按照元素、化合物、单质等不同的分类方法进行研究,在工业流程题中需要熟练掌握。
3. 工艺流程:工艺流程是工业流程题的核心,要求根据题意确定反应物和生成物,并绘制反应线图,同时注意流程中的各个步骤之间的关系。
4. 工业化学反应:工业化学反应操作复杂,需要熟练掌握反应条件、反应物和生成物的变化等知识,在工业流程题中应用广泛。
5. 工业气体:在工业过程中,需要对气体进行处理和存储,需要了解各种气体的性质、处理方法、气体存储设备等方面知识。
6. 工业液体:在工业过程中,需要对液体进行处理和分配,需要了解各种液体的性质、处理方法、液体分配管道等方面知识。
7. 物理量的计算:在工业流程题中,涉及到的物理量如质量、体积、温度、压力等需要准确计算,需要熟练掌握相关的物理量的计算方法。
8. 安全操作与事故分析:安全操作和事故分析是工业流程题中的重要问题,需要熟练掌握安全操作和事故分析的方法和流程。
以上是化学初中工业流程题所涉及的主要知识点,需要学生熟练掌握并灵活运用。

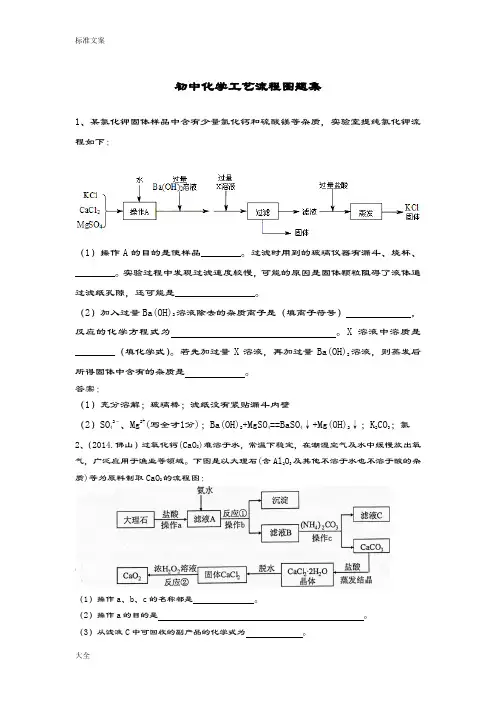
初中化学工艺流程图题集1、某氯化钾固体样品中含有少量氯化钙和硫酸镁等杂质,实验室提纯氯化钾流程如下:(1)操作A的目的是使样品________。
过滤时用到的玻璃仪器有漏斗、烧杯、________。
实验过程中发现过滤速度较慢,可能的原因是固体颗粒阻碍了液体通过滤纸孔隙,还可能是________________。
(2)加入过量Ba(OH)2溶液除去的杂质离子是(填离子符号),反应的化学方程式为。
X溶液中溶质是________(填化学式)。
若先加过量X溶液,再加过量Ba(OH)2溶液,则蒸发后所得固体中含有的杂质是。
答案:(1)充分溶解;玻璃棒;滤纸没有紧贴漏斗内壁(2)SO42-、Mg2+(写全才1分);Ba(OH)2+MgSO4==BaSO4↓+Mg(OH)2↓;K2CO3;氯2、(2014.佛山)过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域。
下图是以大理石(含Al2O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图:(1)操作a、b、c的名称都是。
(2)操作a的目的是。
(3)从滤液C中可回收的副产品的化学式为。
(4)写出反应①的化学方程式 。
(5)反应②的基本反应类型是 。
(2)在该生产过程中,用110kg 大理石制得了72Kg 的过氧化钙。
如果不考虑过程中的损耗,可计算出大理石中CaCO 3的质量分数为 。
(结果保留一位小数)答案:(1)过滤 (2)除去大理石中不溶于水也不溶于酸的杂质 (3)NH 4Cl(4)3NH 3·H 2O+AlCl 3=Al(OH)3 +3NH 4Cl (5)复分解反应 (6)90.9%3.(2014.广州)粗盐中除NaCl 外还含有MgSO4以及泥沙等杂质。
初步提纯粗盐的实验流程如下:溶解过滤3.6g 粗盐蒸馏水滤渣滤液蒸发结晶精盐回收装瓶(1)“滤渣”是粗盐中含有的 。
(2)实验过程中四次用到玻璃棒,分别是:第一次:溶解时搅拌;第二次: ;第三次: ;第四次:将精盐从蒸发皿转移出来。

工艺流程图专项训练(三)1、铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3 和SiO2,不考虑其它杂质)制取金属铝的基本流程如下:已知:①SiO2 是一种难溶于水,也不与盐酸、硫酸反应的物质.②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐.请回答下列问题:(1)滤液I 的溶质有(写化学式)。
(2)该流程中涉及到的基本化学反应类型有和分解反应。
(3)写出滤液II 中溶质的一种用途。
2、硫酸钙转化为K2SO4和CaCl2·6H 2O 的工艺流程如图:(1)蒸氨过程中涉及的反应类型(填编号)。
A.复分解反应B.化合反应C.分解反应D.置换反应(2)操作Ⅲ制取CaCl2·6H 2O 晶体,包含一系列操作:蒸发浓缩、、过滤、洗涤、干燥。
(3)可循环利用的物质除了NH3 外,还有(填化学式)。
3、下图为某化工厂用废硫酸制备K2SO4 的流程如下:(1)生产上将CaCO3 研成粉末的目的是。
(2)上述流程中,可循环使用的物质是。
(填写化学式)(3)洗涤反应③所得晶体不用水而用饱和K2SO4 溶液的目的是。
4、海水是一种取之不尽、用之不竭的资源宝库.请围绕科学利用海水资源,填写空格:用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。
将此粗盐提纯的部分实验方案如下:(1)加入过量氢氧化钠溶液的目的是。
(2)过滤后得到的沉淀成分有:氢氧化镁、碳酸钙、。
(3)请设计实验,能通过清晰可见的现象,准确控制在少量滤液样品中加入稀盐酸,至恰好完全反应:。
5、高纯碳酸钙广泛应用医药、生活生产中。
如图是由工业副产品氯化钙(含有氯化亚铁和氯化镁)制取高纯碳酸钙的工艺流程图。
有关资料:①氯化铵受热会分解;②在室温下,氯化铵的溶解度随氯化钙的质量分数的变化关系如图如示;回答下列问题:(1)工艺流程中操作1 的名称是;(2)向工业氯化钙溶液中加入氧化钙,氧化钙与水发生反应的基本反应类型是,所需氧化钙为粉末状,其目的是。

中考化学工艺流程题练习题及答案一、中考化学流程题1.氨是一种重要的化学物质,可用于制造硝酸和氮肥,氨主要来自人工合成。
工业合成氨的流程如图1所示。
在高温、高压、铁触媒作用下,用体积比为1:3的氮气和氢气合成氨,当容器中氨的含量不再发生变化时(平衡时),测得氨的含量分别与温度和压强的关系如图2所示。
(查阅资料:浓硫酸具有吸水性。
)(1)制取氮气:工业上可用___________方法获得合成氨的原料N 2。
(2)制取氢气的途径Ⅰ:22C+H O CO+H 高温,222CO+H O CO +H 高温。
上述两个化学方程式中表现氧化性的物质是___________(填化学式)。
(3)制取氢气的途径Ⅱ:甲烷和水高温下反应得到CO 和原料气H 2,该反应的方程式为___________。
(4)从“合成塔”中出来的气体是___________(选填“纯净物”或“混合物”)。
(5)写出N 2、H 2反应生成NH 3的化学方程式___________。
(6)原料中N 2、H 2中常含有CO 2和水蒸气,反应前要净化。
在实验室中常采用的净化方法是________。
(7)按下列条件进行合成氨反应,平衡时氨的含量最高的是___________(选填字母)。
A 200大气压、300℃B 200大气压、500℃C 400大气压、300℃D 400大气压,500℃2.以钛铁矿(主要成分为 FeTiO 3,同时含有少量的Fe 2O 3、FeO 等)为原料制TiO 2,再由TiO 2制金属Ti 的工艺流程如下:(1)钛和钛的合金被认为是21世纪的重要金属材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、抗腐蚀性好等。
钛合金与人体有很好的“相容性”。
根据它们的主要性能,下列用途不切合实际的是:________。
A 用来做保险丝B 用于制造航天飞机C 用来制造人造骨D 用于制造船舶(2)工艺流程中,水解属于_____________变化(填“物理”或“化学”)。

初中工艺流程题知识点总结嘿呀!初中工艺流程题可是化学学习中的一个重要板块呢!下面咱们就来好好总结一下这方面的知识点,哇!首先呢,咱们得明白工艺流程题到底是啥呀?哎呀呀,简单说就是把一个生产过程用题目呈现出来,让咱们搞清楚其中的化学原理和操作方法。
一、常见的工艺流程类型1. 金属的冶炼哇!比如说从矿石中提取铁、铜等金属。
这里面就涉及到很多化学反应,像氧化铁和一氧化碳反应生成铁和二氧化碳,这可太重要啦!2. 海水资源的利用哎呀呀!从海水中提取镁、溴等物质,这里面的操作步骤和化学变化都得搞清楚呢!3. 化工生产像合成氨、制硫酸等,这里面的流程和反应条件那都是关键呀!二、工艺流程题的解题思路1. 认真读题嘿,这可不能马虎!要把题目中的文字、图表都看仔细喽,搞清楚整个工艺流程的大致情况。
2. 分析流程哇!每个步骤都有它的作用,咱们得弄明白是为了除去杂质呀,还是为了得到产品呀?3. 关注条件反应条件可重要啦!温度、压强、催化剂等等,都会影响反应的进行和产物的生成。
4. 思考问题哎呀呀,题目中问的问题往往是关键,咱们得根据所学知识和流程中的信息来回答。
三、重要的化学知识点1. 化学反应原理像氧化还原反应、酸碱中和反应、沉淀溶解平衡等,这些在工艺流程中经常出现呢!2. 物质的性质各种物质的物理性质和化学性质都得清楚,比如溶解性、氧化性、还原性等等。
3. 分离提纯方法过滤、蒸发、结晶、萃取、蒸馏,这些方法啥时候用,可得心里有数呀!四、常见的设问类型及解法1. 物质成分的分析哎呀呀,要根据流程和反应判断产物和杂质都有啥。
2. 操作目的的解释为啥要进行这个操作呀?是为了提高产率,还是为了保证纯度?3. 化学方程式的书写这可难不倒咱们,根据流程中的信息写出正确的方程式。
4. 计算问题比如产率的计算、纯度的计算,得小心别出错哟!总之呀,初中工艺流程题虽然有点复杂,但是只要咱们掌握了方法和知识点,嘿,就一定能搞定它!哇!加油呀同学们,相信你们在这方面一定能取得好成绩!哎呀呀,希望这次的总结能对大家有所帮助呢!。

2024年11月08日康荣的初中化学组卷一.工艺流程题(共13小题)3.2022年10月1日,神舟十四号航天员乘务组在中国空间站为中国庆生。
氧气和水是维持航天员驻留空间站的必需物质,如图是空间站内常用水气整合系统的工作原理流程图。
(1)过程①:航天员呼出的CO2可用分子筛设备分离出来,其原理类似于实验室中的操作是。
(2)过程②:航天员呼出的水蒸气经冷凝、净化后可以作为核心舱中的饮用水,水蒸气冷凝为水的微观实质是。
(3)过程③:电解水的反应符号表达式。
(4)过程④:仔细观察图示箭头,二氧化碳和氢气发生反应的符号表达式为。
(5)由上述流程图可知,空间站通过物质循环获得水的途径共有条。
4.水晶的主要成分为SiO2,是制取高纯硅的主要原料,高纯硅又是制造计算机芯片的主要原料。
①SiO2+C Si(粗)+CO↑②Si(粗)+2Cl2SiCl4③SiCl4+2H2Si(纯)+4HCl其生产过程示意图如下:请你自学上述资料后,回答下列问题(1)由石英砂制得高纯硅的反应原理中,属于化合反应的是(填数字代号,下同),属于置换反应的是。
(2)粗硅提纯必须在无氧的氛围中进行,除了考虑到硅易被氧化成二氧化硅外,还有一个原因是。
(3)生产过程示意图中的“物质A”用水吸收,可得副产品(一种常见的酸)的名称是。
(4)作为电器、电子、光纤等行业原料的石英砂纯度要求高,需要对普通石英砂(含有少量的CaCO3)进行提纯,其中酸洗(用盐酸)和高纯水洗是两个最重要的步骤。
请写出酸洗步骤中的反应的化学方程式。
5.新型发光陶瓷是将高科技蓄光材料融入传统陶瓷釉料中,经高温烧制而成的。
它吸蓄光能后,可在阴暗环境中自行发光,以下是其部分生产流程。
分析流程,回答问题:(1)练泥机将水和坯料充分调和,其作用相当于实验操作中的。
(2)施釉机先将蓄光釉料印刷在坯体上,再涂抹一层透明釉料,其目的是(合理即可)。
(3)生产蓄光材料需要在稀有气体环境中进行,利用稀有气体的性质,请你再写出一条稀有气体的用途:。
初中工艺流程题知识点总结一、海水资源的利用相关工艺流程题。
1. 从海水中提取镁的工艺流程如下:海水(含MgCl_2等)→(加石灰乳, )氢氧化镁沉淀→(加稀盐酸, )氯化镁溶液→(蒸发结晶, )氯化镁晶体→(电解, )镁。
写出向海水中加石灰乳反应的化学方程式。
电解氯化镁的化学方程式。
解析:海水中的氯化镁与石灰乳(氢氧化钙)反应生成氢氧化镁沉淀和氯化钙,化学方程式为MgCl_2+Ca(OH)_2=Mg(OH)_2↓+CaCl_2。
电解氯化镁生成镁和氯气,化学方程式为MgCl_2{电解}{=}M g + Cl_2↑。
2. 海水晒盐后得到的苦卤中含有MgCl_2、KCl和MgSO_4等物质,以苦卤为原料制取金属镁的工艺流程如下:苦卤→(加入试剂A, )氢氧化镁→(加入试剂B, )氯化镁溶液→(操作C, )氯化镁晶体→(电解, )镁。
试剂A可以选用(填化学式),反应的化学方程式为。
操作C是。
解析:试剂A可以选用Ca(OH)_2,因为氢氧化钙能与苦卤中的氯化镁和硫酸镁反应生成氢氧化镁沉淀,反应的化学方程式为MgCl_2+Ca(OH)_2=Mg(OH)_2↓+CaCl_2,MgSO_4+C a(OH)_2=Mg(OH)_2↓+CaSO_4↓。
操作C是蒸发结晶,将氯化镁溶液蒸发结晶得到氯化镁晶体。
二、金属矿物的冶炼相关工艺流程题。
3. 以赤铁矿(主要成分Fe_2O_3)为原料炼铁的工艺流程如下:赤铁矿→(高温, )铁水→(炼钢, )钢材。
写出高炉炼铁的主要化学方程式。
炼铁的固体原料需经过粉碎,其目的是什么?解析:高炉炼铁的主要化学方程式为Fe_2O_3+3CO{高温}{=}2Fe + 3CO_2。
炼铁的固体原料需经过粉碎,其目的是增大反应物的接触面积,使反应更充分,提高反应速率。
4. 某工厂利用锌焙砂(主要含ZnO、ZnFe_2O_4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的工艺流程如下:锌焙砂→(酸浸, )浸出液→(净化, )净化液→(电解, )锌。
初中化学工艺流程图题集1.某氯化钾固体样品中具有少许氯化钙和硫酸镁等杂质, 试验室提纯氯化钾流程如下:(1)操作A旳目旳是使样品________。
过滤时用到旳玻璃仪器有漏斗、烧杯、________。
试验过程中发现过滤速度较慢, 也许旳原因是固体颗粒阻碍了液体通过滤纸孔隙, 还也许是________________。
(2)加入过量Ba(OH)2溶液除去旳杂质离子是(填离子符号), 反应旳化学方程式为。
X溶液中溶质是________(填化学式)。
若先加过量X溶液, 再加过量Ba(OH)2溶液, 则蒸发后所得固体中具有旳杂质是。
答案:(1)充足溶解;玻璃棒;滤纸没有紧贴漏斗内壁(2)SO42-、Mg2+(写全才1分);Ba(OH)2+MgSO4==BaSO4↓+Mg(OH)2↓;K2CO3;氯2.(2023.佛山)过氧化钙(CaO2)难溶于水, 常温下稳定, 在潮湿空气及水中缓慢放出氧气, 广泛应用于渔业等领域。
下图是以大理石(含Al2O3及其他不溶于水也不溶于酸旳杂质)等为原料制取CaO2旳流程图:(1)操作a 、b 、c 旳名称都是 。
(2)操作a 旳目旳是 。
(3)从滤液C 中可回收旳副产品旳化学式为 。
(4)写出反应①旳化学方程式 。
(5)反应②旳基本反应类型是 。
(2)在该生产过程中, 用110kg 大理石制得了72Kg 旳过氧化钙。
假如不考虑过程中旳损耗, 可计算出大理石中CaCO3旳质量分数为 。
(成果保留一位小数)答案:(1)过滤 (2)除去大理石中不溶于水也不溶于酸旳杂质 (3)NH 4Cl(4)3NH 3·H 2O+AlCl 3=Al(OH)3 +3NH 4Cl (5)复分解反应 (6)90.9%3.(2023.广州)粗盐中除NaCl 外还具有MgSO4以及泥沙等杂质。
初步提纯粗盐旳试验流程如下: 溶解过滤 3.6g 粗盐蒸馏水滤渣滤液蒸发结晶精盐回收装瓶(1)“滤渣”是粗盐中具有旳。
第三讲 工艺流程1、以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
由于粗盐中含有少量MgCl2、CaCl 2、Na 2SO 4等杂质,不符合电解要求,因此必须经过精制。
以粗盐为原料的“氯碱工业”流程如下:回答下列问题:(1)氯气、氢氧化钠在工业上有广泛的用途。
下列关于氢氧化钠的描述中,错误的是。
A .能去除油污,可做厨房清洁剂 B.易溶于水,溶解时放出大量的热 C .水溶液能使石蕊溶液变红 D.可用作某些气体的干燥剂 (2)操作②的名称是,操作④的名称是。
(3)操作①②间除杂质时所加的三种试剂是NaOH 溶液、Na 2CO 3溶液、BaCl 2溶液(均过量),其顺序要求是:Na 2CO 3溶液必须在BaCl 2溶液之(填“前”或“后”)加入。
有同学提出用溶液代替BaCl 2溶液可达到同样的目的。
(4)电解饱和NaCl 溶液的化学方程式是。
(5)该流程中可以循环利用的物质是。
2、某工厂废液中含有氯化钠.氯化铜和氯化亚铁。
某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2O 3),要求全过程不引入其他金属元素。
设计实验方案如下图所示,回答下列问题。
(1)加入过量A 溶解后,再进行操作a 时玻璃棒的作用是 。
(2)工厂废液中加入过量A 反应的化学方程式为 。
(3)溶液甲中的金属离子是 (写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是 (填序号)。
(5)铁红是炼铁的主要原料,写出用CO 和铁红炼铁的化学方程式 。
3、某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO 4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。
初三(2)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)复习常见金属活动顺序表,在下表空格中分别填入对应的元素符号。
K Ca Mg Al Fe Sn Pb (H) Cu Hg Pt Au金属活动性由强到弱(2)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:依次加入过量的三种试剂除杂粗盐悬浊液沉淀滤液NaCl 溶液饱和NaCl 溶液H 2Cl 210%的NaOH 溶液16%的NaCl 溶液50%的NaOH 溶液NaCl 晶体加适量的水②加盐酸,调pH=7①③④电解⑤⑥△①废水在加入金属X 前需进行过滤,目的是将其中性杂质除去。
专题三工艺流程题类型一工业生产流程1.氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图:(1)请写出步骤一中发生反应的化学方程式:__________________________(任写一个)。
(2)溶液A中所含的阳离子有______________(填离子符号)。
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表(4)3个步骤中均用到的操作是__________。
(5)步骤三中生成产品的化学方程式为________________________________。
2.保险粉(化学式为Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定,在NaCl存在下,Na2S2O4在水中溶解度显著下降。
制备流程如图:(1)反应Ⅰ的原理为:Zn+2SO2=== ZnS2O4,该反应类型为______________。
(2)反应Ⅱ为复分解反应,该反应的化学方程式为________________________________。
(3)操作a的名称为__________。
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是_______________________,加入NaCl的原因是____________________________________。
(5)198g Zn(OH)2理论上能得到Zn的质量为__________g。
3.工业上以粗盐(含少量MgCl2、CaCl2杂质)为原料,利用电解饱和食盐水的方法制备NaOH,其简要工艺流程如下:(1)步骤①中发生反应的基本反应类型是__________反应。
(2)步骤③中加入适量稀盐酸的目的是________________________________。
(3)验证步骤②中CaCl2已完全转化为CaCO3的方法是___________________________。
(4)步骤④中制得的氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上要用较多的水冲洗,再涂上________________。
(5)写出步骤④中反应的化学方程式________________________________。
4.侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、______________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式分别是:②__________________________,⑤________________。
(3)上述流程中,可循环利用的物质是________________。
(4)上述流程中,“一种氮肥”的化学式是________________。
类型二提纯除杂类5.某兴趣小组同学设计的除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾的工艺流程如下所示:(1)操作a、b的名称是__________,该操作中需要用到的玻璃仪器有烧杯、玻璃棒、__________。
(2)步骤①中反应的化学方程式是________________________________,滤液B中一定含有的溶质是____________________。
(3)步骤②中加入的甲溶液是__________(填化学式)溶液。
(4)步骤③加入过量的稀盐酸是否会影响氯化镁的纯度?理由是________________________。
6.为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO 4·5H 2O)。
某课外活动小组的同学按如下流程进行实验(反应中部分生成物已略去)。
已知:Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 。
回答下列有关问题:(1)操作a 的名称是__________;除去铜粉中的铁粉,最简便的实验方法是________________________________________________________________________。
(2)FeCl 2溶液中通入Cl 2发生化合反应,写出该反应的化学方程式__________________________。
(3)由Cu 制CuSO 4溶液的途径Ⅱ中,若不通入O 2,反应将不会发生,原因是____________________________。
途径Ⅱ与途径Ⅰ相比较,其显著的优点是____________________________(回答一点即可)。
(4)FeCl 3溶液可腐蚀铜以制作印刷线路板,反应只生成两种常见的盐,则该反应的化学方程式为____________________________。
类型三 金属的回收利用7.某科研小组设计利用稀H 2SO 4浸取某废弃的氧化铜锌矿(主要成分为CuO 和ZnO ,其余成分既不与酸反应,也不溶解于水)的方案,实现废物综合利用。
部分实验流程如下:请根据上述实验流程回答下列问题:(1)操作1的名称是__________。
(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为________________________________,__________________________________。
(3)加过量铁粉后,发生反应的基本反应类型是______________,得到滤渣1的成分为__________(填化学式)。
(4)在实验过程中,双氧水会与Fe 2+反应生成Fe 3+和水,以便在后续的操作中将溶液中铁元素除去;高锰酸钾溶液也能将Fe 2+氧化成Fe 3+,选用双氧水的优点是________________________。
8.回收利用是保护金属资源的一条有效途径,某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液。
主要流程如图:已知:CuO+H2SO4=== CuSO4+H2O Fe+Fe2(SO4)3=== 3FeSO4(1)流程Ⅰ中氧化铁发生反应的化学方程式是__________________________。
(2)流程Ⅲ充分反应后,还应有的实验操作是__________。
(3)A~E中,含有铁、铜两种元素的是__________(填字母)。
9.炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:(1)操作1:粉碎。
粉碎的目的是______________________________。
(2)操作2:焙烧。
高温条件下,通入空气,CuS和NaCl反应生成了CuCl2和Na2SO4,化学方程式为______________________________。
(3)操作3:__________(填操作名称)。
(4)流程图中能循环利用的物质是__________。
类型四环境保护类10.城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如下:资料1:垃圾焚烧产生的烟气中含有SO2、HCl等有害气体资料2:+2价的铁元素容易被空气中的氧气氧化,Fe+Fe2(SO4)3=== 3FeSO4资料3:SO2与CO2的化学性质相似资料4:石灰浆的主要成分是氢氧化钙回答下列问题:(1)吸收步骤中,石灰浆的作用是__________________________________。
(2)除资料2外,溶解步骤中发生反应的化学方程式为__________________________。
(3)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶等操作,得到硫酸亚铁晶体,其中氮气的作用是__________________________________。
(4)请你就如何处理我们日常生活垃圾提一条建议________________________。
11.某沿海工业区排放的污水中含有少量的Fe2+、Na+、Ca2+、Cu2+、Cl-,为了达到零污染的目标,将污水进行如下工业流程处理:(1)步骤Ⅰ的操作名称是________,写出步骤Ⅰ中的化学方程式:________________________________________________________________________。
(2)滤渣Ⅰ所含的物质是__________________(填化学式)。
(3)加入过量NaOH溶液的目的是__________________________________________。
(4)在滤液Ⅲ中加入盐酸使得到的溶液呈中性,要使用____________来测定溶液的酸碱度,确保盐酸不过量。
参考答案1.(1)MgO+2HCl=== MgCl2+H2O(或Fe2O3+6HCl=== 2FeCl3+3H2O,或CuO+2HCl=== CuCl2+H2O)(2)Mg2+、Fe3+、Cu2+、H+(3)6.7~9.1(4)过滤(5)MgCl2+Ca(OH)2=== Mg(OH)2↓+CaCl2【解析】(3)要使Mg(OH)2纯度高、损失少,必须把pH控制在CuCl2能完全沉淀,但MgCl2不能沉淀的范围内,即6.7<pH<9.1范围内。
2.(1)化合反应(2)ZnS2O4+2NaOH=== Zn(OH)2↓+Na2S2O4(3)过滤(4)可调节溶液为碱性,使Na2S2O4结晶稳定存在氯化钠的存在使Na2S2O4的溶解度降低,更易结晶析出,提高产率(5)130【解析】(5)由质量守恒定律,反应前后锌元素的质量不变,198 g Zn(OH)2理论上能得到Zn的质量为198 g×6565+(16+1)×2×100%=130 g。
3.(1)复分解(2)除去过量的氢氧化钠、碳酸钠(3)取反应后的滤液,加入碳酸钠,没有明显现象,证明氯化钙全部转化成碳酸钙沉淀(4)稀硼酸(5)2NaCl +2H 2O=====通电 2NaOH +H 2↑+Cl 2↑4.(1)氯化钠(2)N 2+3H 2=====催化剂高温、高压 2NH 3 2NaHCO 3=====△ Na 2CO 3+H 2O +CO 2↑(3)二氧化碳、水 (4)NH 4Cl5.(1)过滤 漏斗(2)BaCl 2+K 2SO 4=== 2KCl +BaSO 4↓ 氯化钾、氯化钠、氯化镁(3)NaOH(4)不会,盐酸是氯化氢的水溶液,加热蒸发时会变成气体全部挥发掉6.(1)过滤 用磁铁吸引 (2)2FeCl 2+Cl 2=== 2FeCl 3(3)在金属活动顺序中,铜是位于氢之后的,与稀硫酸不反应 不会产生污染空气的二氧化硫气体(4)2FeCl 3+Cu=== 2FeCl 2+CuCl 27.(1)过滤(2)ZnO +H 2SO 4=== ZnSO 4+H 2O CuO +H 2SO 4=== CuSO 4+H 2O(3)置换反应 Fe 、Cu (4)不引入较难除去的杂质8.(1)Fe 2O 3+3H 2SO 4=== Fe 2(SO 4)3+3H 2O(2)过滤 (3)AC9.(1)增大反应物的接触面积(2)CuS +2NaCl +2O 2=====高温CuCl 2+Na 2SO 4 (3)过滤(4)NaCl(或氯化钠)10.(1)除去烟气中含有的SO 2、HCl 等有害气体(2)Fe +H 2SO 4=== FeSO 4+H 2、Fe 2O 3+3H 2SO 4=== Fe 2(SO 4)3+3H 2O(3)作保护气,避免+2价的铁元素被空气中的氧气氧化(4)垃圾分类回收11.(1)过滤 Fe +CuCl 2=== Cu +FeCl 2 (2)Fe 和Cu(3)完全除去Fe 2+ (4)pH 试纸。