医疗器械质量方针目标检查表
- 格式:doc
- 大小:55.50 KB
- 文档页数:11

《医疗器械生产质量管理规范》
自查报告
医疗器械生产质量管理规范自查/检查表
注解:
本指导原则条款编号的编排方式为:X1。
X2。
X3,其中X1为章节的顺序号,如1.1.1的第一位X1表示“机构与人员”章节,2.1.1的第一位X1表示“厂房与设施”章节;X2为同一章节内条款的顺序号,如1.1.1的第二位X2表示“机构与人员”章节第一条要求,1.2.1的第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如1.1.1的第三位X3表示“机构与人员”章节对第一条要求细化的第一个检查要点,1.1.2的第三位X3表示“机构与人员”章节对第一条要求细化的第二个检查要点。
其他章节编号规则相同。
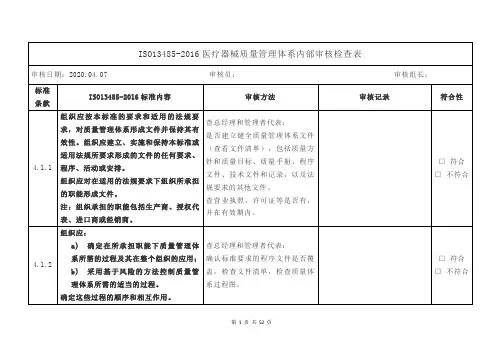
4.2. 4质量管理体系所要求的文件应予以控制。
记录是一种特殊类型的文件,应依据4.2.5的要求进行控制。
应编制形成文件的程序,以规定以下方面所需的控制:a)文件发布前得到评审和批准,以确保文件是充分的;b)必要时对文件进行评审与更新,并再次批准;c)确保文件的更改和现行修订状态得到识别d)确保在使用处可获得适用文件的有关版本;e)确保文件保持清晰、易于识别;f)确保组织所确定的策划和运行质量管理体系所需的外来文件得到识别,并控制其分发g)防止文件退化或遗失;h)防止作废文件的非预期使用,并对这些文件进行适当的标识。
组织应确保文件的更改得到原审批部门或指定的其他审批部门的评审和批准,查品管部:检查文件清单,从中抽查5份文件,核对文件的发放记录;检查文件修订的评审和批准记录;抽查5份现场使用的文件,核对其现行版本和标识;检查外来文件清单;抽查5份外来文件的最新版本(是否现行有效文件);抽查5份外来文件的发放记录和标识;抽查已经过期外来文件的保□符合□不符合7.1 产品实现产品实现的策划组织应策划和开发产品所需的过程,产品实现的策划应与质量管理体系的其他过程的要求一致在产品的实现过程中,组织应对风险管理的一个或多个过程形成文件。
应保持风险管理活动的记录(见 4.2.5)。
在对产品实现进行策划时,组织应确定以下方面的适当内容:a)产品的质量目标和要求;b)建立过程和文件(见 4.2.4)的需求,以及为特定的产品提供资源(包括基础设施和工作环境)的需求;c)特定的产品所要求的验证、确认、监视、测量、检验和试验、处理、贮存、销售和追溯活动,以及产品接收准则;d)为实现过程及其产品满足要求提供证据所需的记录(见 4.2.5).检查研发部:查看《产品实现的策划控制程序文件》,抽查一个产品的策划和开发过程;查看风险管理报告,是否符合要求;检查产品采购规范、工艺流程图、生产工艺、检验工艺、接收准则、对资源和设备的要求等。
质量管理制度执行情况检查考核表记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法知识法合 格记录法知识法合 格记录法知识法合 格不合格记录法现场法合 格不合格记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法合 格知识法记录法现场法知识法合 格记录法知识法合 格不合格记录法现场法合 格不合格记录法现场法知识法合 格不合格记录法知识法合 格不合格不合格记录法合 格现场法不合格记录法合 格不合格记录法合 格现场法不合格记录法现场法知识法合 格不合格现场法知识法合 格。

医疗器械内审检查表XXX内部审核检查表KS/JL8.2.2-03受审核部门/场所过程要求4.2.3程序办公室部门负责人检查清单审核日期页码审核记录(不符合描述用N标记)体系文件管理有序,如:文件受控分发、收回、销毁等按规定实施。
外来文件收集到位,新法规能及时向公司各部门贯彻实施。
程序文件1.质量管理体系文件在发放前编制、审核、批准是否符合审批要求?2.是否对文件的评审、修改和更新有书面的规定?修改更新的文件是否要重新批准?3.能否提供一份受控的所有文件清单?5.作废文件的保存期限是否作了规定。
6.查作废文件记录和作废文件,是不是符合文件规定的要求。
7.受控文件是不是都加盖有红色“受控”印章?是不是有使用复印文件的现象?8.对文件领用部门和个人是不是要求其坚持清晰,不得随意涂划。
9.外来文件控制是否符合规定的要求。
程序文件1.请出示《质量记录清单》文件控制4.文件的发放是不是经过审批、文件是不是有发放号、文件领用是不是有记录。
质量记录清单及时更新,质量记录的保存期限与文件规定相符。
2.记录是不是有涂改和点窜现象,点窜是不是符合程序的要求。
4.2.43.质量记录的保存是否有适宜的贮存方法和贮存环境。
记录控制4.质量记录的检索是不是轻易?是不是编制了记录的检索目录?当有需要借阅或检索某些程序记录时,是不是在很短工夫内即可查到所需要的记录?5.质量记录的保存期限是否符合文件规定的要求?6.记录的销毁是否符合要求。
7.外来记录的控制是不是符合要求。
质量手册1.请谈谈公司的质量方针是什么?5.32.公司的质量目标是什么?能准确回答质量方针。
制定有质量目标,也进行了统计、分析。
质量方针3.是否建立了本部门的质量目标,目标是否可测量?如何评审质量目标是否达到要5.4.1求?质量目标露台县康生医疗器械内部审核检查表KS/JL8.2.2-03受考核部门/场所过程要求5.5.1限办公室部门负责人检查清单审核日期页码考核记录(不符合描述用N标记)制订有部门职责及部门负责人的岗位职责质量手册1.本部门共有多少人?如何分工?2.你部门在公司的质量管理体系中主要负责哪些过程的控制?4.查看组织机构图、部门职责要求、岗位人员任命等文件确认是不是符合要求。

医疗器械质量方针和质量目标情况检查表一、引言医疗器械质量方针和质量目标是医疗器械生产企业质量管理体系的核心内容,也是确保医疗器械质量安全的关键。
医疗器械质量方针和质量目标情况检查表是企业在质量管理中评估和监控医疗器械质量方针和质量目标实施情况的一项重要工具。
本文将从医疗器械质量方针的含义、制定和实施过程、质量目标的设定及其关联性、医疗器械质量方针和质量目标情况检查表的内容和作用等方面展开探讨。
二、医疗器械质量方针的含义1. 什么是医疗器械质量方针?医疗器械质量方针是医疗器械生产企业为了提高医疗器械质量安全性和符合性而确定的质量方向和目标,是企业质量管理的宗旨和宣言。
医疗器械质量方针一般由医疗器械生产企业的高层管理层确定,并向全体员工宣传和传达。
2. 医疗器械质量方针的制定和实施医疗器械质量方针的制定要与企业的经营理念和战略目标相一致,要注重体现医疗器械生产企业的产品特点和市场需求,要与国家法律法规和相关标准相符合。
医疗器械质量方针的实施需要通过相关培训和宣传,要求全体员工都能理解和落实医疗器械质量方针。
三、医疗器械质量目标的设定及其关联性1. 医疗器械质量目标的设定医疗器械质量目标是在医疗器械质量方针的指导下,为了实现质量方针而确定的具体、可衡量、可达成的目标。
医疗器械质量目标的设定应该符合SMART原则,即具体(Specific)、可衡量(Measurable)、可达成(Achievable)、相关(Relevant)和时限(Time-bound)。
2. 医疗器械质量方针与质量目标的关联性医疗器械质量方针和质量目标是相辅相成、相互关联的。
医疗器械质量方针是企业对质量目标的总体要求和引领,而质量目标是医疗器械质量方针的具体实施和落实。
只有质量目标与医疗器械质量方针保持一致,企业才能实现医疗器械质量方针所制定的目标。
四、医疗器械质量方针和质量目标情况检查表1. 检查表的内容医疗器械质量方针和质量目标情况检查表主要包括医疗器械质量方针实施情况、医疗器械质量目标达成情况、存在的问题及改进措施等内容。

医疗器械质量控制执行情况检查表一、背景医疗器械质量控制是保障患者安全和医疗质量的重要环节。
为了确保医疗器械质量控制工作的有效开展,本文档制定了医疗器械质量控制执行情况检查表,以便对医疗机构的质控工作进行检查和评估。
二、检查内容1. 质量控制机构的设置与人员配备:质量控制机构的设置与人员配备:- 检查质量控制机构是否合理设置,人员配备是否充足。
- 检查质量控制机构工作人员的资质和专业知识。
2. 质量控制体系的建立与实施:质量控制体系的建立与实施:- 检查医疗机构是否建立了完善的质量控制体系。
- 检查质量控制体系的文件和工作流程是否得到有效执行。
3. 医疗器械安全保障:医疗器械安全保障:- 检查医疗器械的购进、验收和清点工作是否规范。
- 检查医疗器械的标识、包装和储存是否符合要求。
- 检查医疗器械的维护和保养工作是否得到有效开展。
4. 医疗器械质量评价与监测:医疗器械质量评价与监测:- 检查医疗机构是否对医疗器械进行质量评价和监测。
- 检查医疗机构对医疗器械质量问题的处理和报告。
5. 医疗器械故障和事故的应对与处理:医疗器械故障和事故的应对与处理:- 检查医疗机构是否建立了医疗器械故障和事故的应对和处理机制。
- 检查医疗机构对医疗器械故障和事故的调查和处理情况。
三、检查方式和标准1. 检查方式:- 随机抽取样本进行检查。
- 查阅质量控制文件和记录资料。
- 与质量控制人员进行访谈。
2. 检查标准:- 根据相关法律法规和标准要求进行检查。
- 检查过程中,发现的问题要记录并提出整改意见。
四、检查结果和整改措施1. 检查结果:- 将检查结果进行分类汇总,包括合格、不合格和待整改等情况。
- 对检查中发现的问题进行详细的描述和记录。
2. 整改措施:- 对不合格和待整改的问题,由医疗机构提出整改计划,并按时进行整改。
- 对于重大问题,要及时报告和采取紧急措施。
五、检查有效性评估根据检查结果和整改措施的执行情况,对医疗机构的质量控制工作进行评估,并提出改进意见。

委托方对受托方医疗器械生产企业质量体系审核检查表(委托生产)
委托企业名称:受托企业名称:
审核地点:委托地址:
产品名称:产品类别:
质量体系审核记录:
1 / 11
2 / 11
3 / 11
4 / 11
5 / 11
6 / 11
7 / 11
8 / 11
9 / 11
10 / 11
注:(1)“相应条款”指《医疗器械生产企业质量体系考核办法》中规定的考核项目的条款。
(2)“重点考核项目”应全部合格。
其它考核项目,不符合项不能超过五项。
(3)委托生产可根据实际情况必要时可对受托方的质量体系进行现场核查,核查委托方的对受托方质量管理体系审查记录的真实性和有效性。
考核人员签字:职务:是否经过ISO13485培训年月日
11 / 11。

医疗器械质量方针和质量目标情况检查表医疗器械质量方针和质量目标情况检查表 - 建立高质量医疗保障体系的重要步骤【导言】医疗器械是现代医学中不可或缺的工具,它们对诊断、治疗和监测疾病起着关键作用。
在保证医疗器械质量的前提下,医疗保障体系才能有效运作并提供可靠的医疗服务。
建立医疗器械质量方针和质量目标是一项至关重要的任务,本文将全面探讨这一主题,帮助你深入了解医疗器械质量管理的重要性及相关知识。
【一、医疗器械质量方针】1. 定义和重要性医疗器械质量方针是指医疗机构或医疗器械经营企业为提高医疗器械质量,并满足法律、法规及相关技术规范要求而制定的质量管理原则和政策。
它对于确保医疗器械的可持续发展和保障患者安全起着至关重要的作用。
2. 主要内容医疗器械质量方针应包括但不限于以下几个方面:(1) 组织结构和职责分工:明确各职能部门在医疗器械质量工作中的具体职责和权限,确保各环节的协同与配合;(2) 风险管理和监测:建立风险管理制度,及时发现、评估和控制医疗器械安全问题,确保及时采取措施降低潜在风险;(3) 质量培训与提升:制定培训计划,提高员工对医疗器械质量的认知和操作标准,确保技术人员具备必要的专业知识和技能;(4) 合规和法规要求:遵守相关法规和规定,确保医疗器械的注册、生产和销售符合规定的程序和标准。
【二、质量目标情况检查表】1. 定义和应用范围质量目标情况检查表是一种系统评估工具,用于检查医疗器械质量目标的实施情况。
它有助于医疗机构或医疗器械经营企业了解自己的质量目标是否得以落地,并对不足之处进行改进。
2. 主要内容质量目标情况检查表包括但不限于以下几个方面:(1) 目标设定与管理:评估医疗机构或医疗器械经营企业是否明确制定了质量目标,并将其与组织目标相结合,确保质量目标的有效性和可操作性;(2) 监测与评估:检查医疗机构或医疗器械经营企业是否建立了科学的监测和评估体系,能够及时了解质量目标的实际达成情况,并对不达标的情况进行响应;(3) 持续改进:评估医疗机构或医疗器械经营企业是否采取措施鼓励持续改进,包括但不限于内部培训、员工参与和优秀经验分享等;(4) 信息管理:检查医疗机构或医疗器械经营企业是否建立了有效的信息管理系统,能够提供准确、及时和可追溯的相关数据,便于质量目标的跟踪和分析。
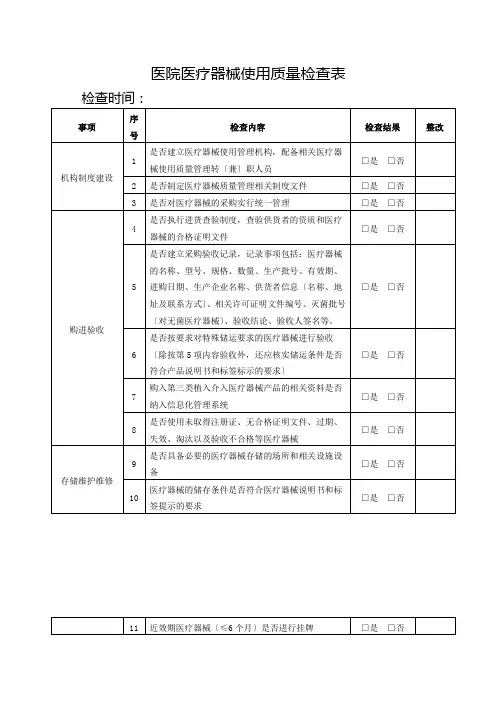
4.2. 4
质量管理体系所要求的文件应予以控
制。
记录是一种特殊类型的文件,应依据
4.2.5的要求进行控制。
应编制形成文件的程序,以规定以下方
面所需的控制:
a)文件发布前得到评审和批准,以确
保文件是充分的;
b)必要时对文件进行评审与更新,并
再次批准;
c)确保文件的更改和现行修订状态
得到识别
d)确保在使用处可获得适用文件的
有关版本;
e)确保文件保持清晰、易于识别;
f)确保组织所确定的策划和运行质
量管理体系所需的外来文件得到识
别,并控制其分发
g)防止文件退化或遗失;
h)防止作废文件的非预期使用,并对
这些文件进行适当的标识。
组织应确保文件的更改得到原审批部
门或指定的其他审批部门的评审和批准,
查品管部:
检查文件清单,从中抽查5份文
件,核对文件的发放记录;检查
文件修订的评审和批准记录;抽
查5份现场使用的文件,核对其
现行版本和标识;检查外来文件
清单;抽查5份外来文件的最新
版本(是否现行有效文件);抽
查5份外来文件的发放记录和标
识;抽查已经过期外来文件的保
□符合
□不符合。
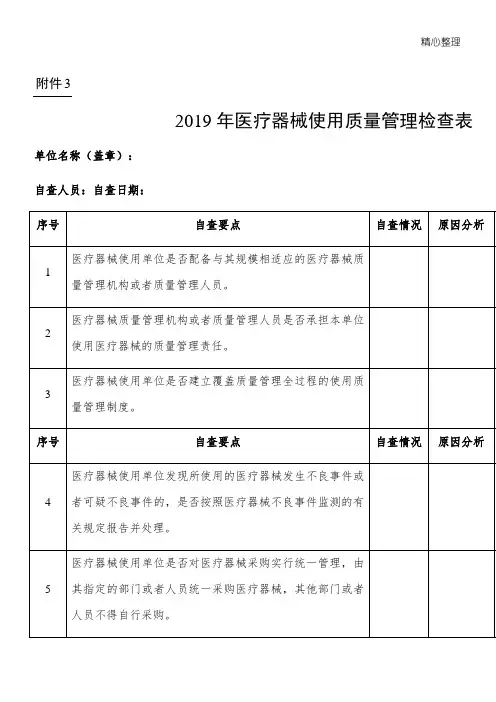
附件 32019 年医疗器材使用质量管理检查表单位名称(盖印):自查人员:自查日期:序号自查重点自查状况原由剖析整顿举措整顿结果医疗器材使用单位能否装备与其规模相适应的医疗器材质1量管理机构或许质量管理人员。
医疗器材质量管理机构或许质量管理人员能否肩负本单位2使用医疗器材的质量管理责任。
3医疗器材使用单位能否成立覆盖质量管理全过程的使用质序号4 5 6量管理制度。
自查重点自查状况原由剖析整顿举措整顿结果医疗器材使用单位发现所使用的医疗器材发生不良事件或者可疑不良事件的,能否依据医疗器材不良事件监测的有关规定报告并办理。
医疗器材使用单位能否对医疗器材采买推行一致管理,由其指定的部门或许人员一致采买医疗器材,其余部门或许人员不得自行采买。
医疗器材使用单位能否从拥有资质的医疗器材生产经营企业购进医疗器材,讨取、检验供货者资质、医疗器材注册证或许存案凭据等证明文件。
对购进的医疗器材应该验明产品合格证明文件,并按规定进行查收。
对有特别储运要求的医疗器材还应该核实储运条件能否切合产品说明书和标签标示的要求。
序号自查重点自查状况原由剖析整顿举措整顿结果医疗器材使用单位能否真切、完好、正确地记录进货检验状况。
进货检验记录能否保留至医疗器材规定使用限期届7满后 2 年或许使用停止后 2 年。
大型医疗器材进货检验记录能否保留至医疗器材规定使用限期届满后 5 年或许使用停止后 5 年;植入性医疗器材进货检验记录能否永远保留。
医疗器材使用单位能否妥当保留购入第三类医疗器材的原8始资料,保证信息拥有可追忆性。
医疗器材使用单位储存医疗器材的场所、设备及条件能否与医疗器材品种、数目相适应,切合产品说明书、标签标9示的要求及使用安全、有效的需要;对温度、湿度等环境条件有特别要求的,能否监测和记录储存地区的温度、湿度等数据。
序号自查重点自查状况原由剖析整顿举措整顿结果医疗器材使用单位应该依据储存条件、医疗器材有效限期10等要求对储存的医疗器材进行按期检查并记录。
医疗器械质量方针和质量目标情况检查表1. 简介医疗器械质量方针和质量目标是医疗器械行业中非常重要的文件,它们对于保障医疗器械的安全性、有效性和可靠性具有至关重要的作用。
本文将围绕医疗器械质量方针和质量目标情况检查表展开讨论,分析其内容和应用。
2. 医疗器械质量方针医疗器械质量方针是企业制定的对于医疗器械质量管理的总体要求和指导原则。
它体现了企业对于产品质量的追求和承诺,为企业提供了一个明确的发展方向。
2.1 质量方针内容一份好的医疗器械质量方针应该具备以下几个要素:2.1.1 安全性安全性是医疗器械最基本的要求之一。
在制定质量方针时,企业应明确强调产品安全性,并承诺不会以任何方式妥协产品的安全性。
2.1.2 有效性医疗器械的有效性直接关系到产品是否能够发挥预期的治疗效果。
质量方针应明确要求企业在设计、生产和销售过程中要保证产品具备良好的有效性。
2.1.3 可靠性可靠性是医疗器械质量的重要指标之一,它体现了产品在正常使用情况下的稳定性和可信赖程度。
质量方针应强调企业对于可靠性的追求,并承诺不断提升产品可靠性。
2.1.4 合规性医疗器械行业有着严格的法律法规和标准要求,企业必须确保其产品符合相关规定。
质量方针应明确要求企业遵守法律法规,并建立健全的合规体系。
2.2 质量方针制定过程制定医疗器械质量方针需要经过以下几个步骤:2.2.1 确定参与者确定参与制定质量方针的各个相关方,包括高层管理人员、技术人员、市场人员等。
他们应具备相关的专业知识和经验,以确保质量方针的全面性和可行性。
2.2.2 审查现状对企业现有的质量管理体系进行审查,了解企业目前的优势和不足之处。
这将为制定质量方针提供重要的参考依据。
2.2.3 制定草案根据参与者的意见和审查结果,制定医疗器械质量方针的草案。
草案应包括对安全性、有效性、可靠性和合规性等要素的明确表述。
2.2.4 内外部沟通将制定好的草案与内外部相关方进行沟通,并征求他们的意见和建议。
山东XXXX器械有限公司
质量方针与目标检查记录
(2014年)
内容
1.质量方针目标展开表
2.质量方针目标检查表
.
3.2014年部门分解质量目标
.
山东xx器械有限公司
公司质量方针目标展开表
质量方针:坚持“质量第一”的原则,加强基础管理,完善质量体系,为客户提供质量合格的医疗器械和文明满意的服务。
日期:年月日
.
.
.
.
.
质管部经理:质量负责人:总经理:
.
山东xxx器械有限公司
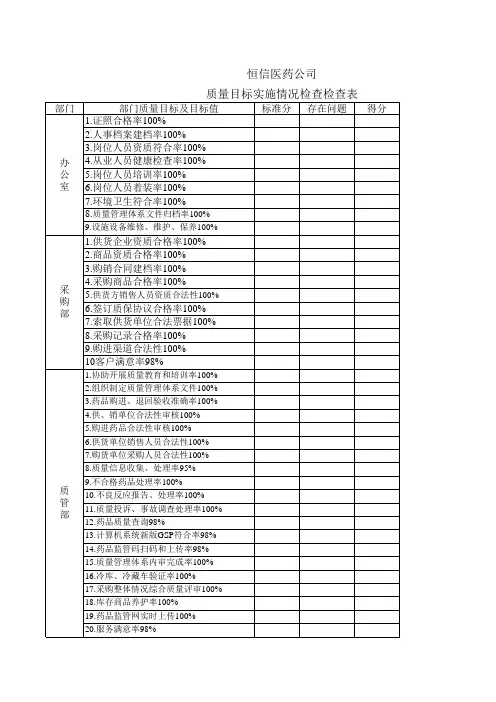
公司质量方针目标检查表
质量方针:坚持“质量第一”的原则,加强基础管理,完善质量体系,为客户提供质量合格的器械和文明满意的服务。
填表日期:年月日
.
.
精选
质管部经理:质量负责人:总经理:记录人:本文档部分内容来源于网络,如有内容侵权请告知删除,感谢您的配合!
.。