同核双原子分子的结构同核双原子分子举例
- 格式:ppt
- 大小:1.10 MB
- 文档页数:30

学校工作总结本学期,我校工作在全体师生的大力支持下,按照学校工作计划及行事历工作安排,紧紧围绕提高教育教学质量的工作思路,不断强化学校内部管理,着力推进教师队伍建设,进一步提高学校办学水平,提升学校办学品位,取得了显著的成绩。
现将我校一学期来的工作总结如下:一、德育工作本学期我校德育工作围绕学校工作中心,精心安排了“文明守纪”、“良好习惯养成”、“光辉的旗帜”、“争先创优”等主题教育月活动,从培养学生的行为规范,狠抓养成教育入手,注重务实,探索途径,加强针对性、实效性和全面性,真正把德育工作落到实处。
1.强化学生养成教育,培养学生良好习惯。
本学期,我校德育工作十分注重学生的常规管理,尤其重视对学生的养成教育。
一是利用班队会、红领巾广播站、国旗下演讲对学生进行品德熏陶。
二是以文明监督岗为阵地,继续强化了“文明班集体”的创建评比活动,通过卫生、纪律、两操等各项常规的评比,增强了学生的竞争意识,同时也规范了学生的行为。
三是继续加大值周检查的力度,要求值周领导、教师、学生按时到岗,在校门口检查、督促学生有秩序出入校园,从而使学生的行为规范时时有人抓,处处有人管,形成了良好的局面。
2.抓好班主任队伍建设,营造全员育人氛围。
班主任是学校德育工作最重要的力量,为了抓好班主任队伍建设,提高班主任素质水平,学校在第十二周组织开展了班主任工作讲座,在学期末举行了班主任工作交流,在活动中探索行之有效的工作方法,总结经验,交流心得,使班级管理工作更上新台阶。
3.充分发挥主题班队会的教育功能。
主题班队会,是对学生进行德育教育的一种特殊而卓见成效的方式之一。
为了充分发挥主题班队会的教育意义,第十三周,四(3)中队举行了“祖国美,家乡好”主题队会观摩活动,有效规范了我校主题中队会程序,强化了主题队会对学生的思想教育作用。
二、学校管理工作1.建立健全规章制度。
学期初,学校制定了出明确的目标计划及管理措施,做到了目标明确、工作具体,有效地增强了全体教师参与学校管理的主人翁意识,充分调动了全体教师的工作积极性,保障了教育教学工作的顺利开展。



同核双原子分子双原子分子是由一个原子核和两个电子构成的。
但是,两个原子核中的电子数目不一定相等。
如氢分子由一个原子核和两个质子构成,而其中的电子数却为三个,即电子层数为三。
但还有一些化合物,它们的两个原子核都是由一个质子和一个中子构成,但它们的电子层数却都为七个。
又如氯分子由一个原子核和三个质子构成,而其中的电子数却为六个,即电子层数为六。
当一个正离子与一个负离子结合时,就会出现多种同核双原子分子。
例如,二氧化硅分子由两个硅原子和一个氧原子构成,但这两个原子核中的电子数目并不相等,其中氧原子有四个电子,硅原子却只有一个电子。
二氧化硅分子由于存在多种同核双原子分子,才使得单晶硅片具有很高的折射率,可以应用于制造光学仪器和电子工业中,还可用于制作防辐射玻璃、 X射线屏幕等。
此外,二氧化硅还能被人们制成大理石和各种装饰品,如普通的文石可做成各种台面。
将精制的文石切磨成很小的薄片,贴到墙上,就变成了精美的壁纸。
把文石晶体掺进玛瑙里,经过加工后,便形成了非常美丽的珠宝——玛瑙珠。
还有,天然放射性铀235的衰变产物三铀氧钒具有“闪闪发光”的奇异色彩,很像黄金,所以又称三铀氧钒为黄金金属,即黄金铀。
一些黄金矿藏、铀矿床或冶炼厂的废水中,常含有大量的黄金铀,工业上可提取黄金,故而常被称为“天然放射性元素”。
此外,其它类似的有关黄金的同核双原子分子还有:铀、钍、镤、铒、铥、镱、镥等。
同样的事例也发生在含有稀有气体元素的化合物中,例如,氙原子的电子层结构为7S2,有3个电子层,所以有3个电子,由于含有稀有气体元素,因此有强烈的放射性,其放射性比镭强15倍。
在放射源中,它是强射线。
稀有气体元素还有氪、氡、氙、氡等,它们都是放射性元素,具有放射性。
虽然由于它们在空气中含量很少,但在人体内累积到一定程度时,仍可引起疾病。
此外,许多稀有气体元素在特定条件下还能够互相转化。
例如,氟有5个价态,即正5价、负5价、正4价、负4价和零价。






应用分子轨道理论处理双原子分子结构1101班阮赛摘要:分子轨道理论(MO理论)是处理双原子分子及多原子分子结构的一种有效的近似方法,是化学键理论的重要内容。
它注重于分子轨道的认知,即认为分子中的电子围绕整个分子运动,注意了分子的整体性,因此较好地说明了多原子分子的结构。
目前,该理论在现代共价键理论中占有很重要的地位。
本文就分子轨道理论介绍及应用于双原子分子的一些内容作简单介绍。
关键词:分子轨道理论、、成建轨道、反键轨道、对称性匹配、最大重叠、能量相近, σ键、π键、键级、顺磁性、反磁性等。
背景:从20世纪30年代初,由Hund,Mulliken,Lennard-Jones开创,Slater,Hückel,Pople发展至今。
该方法的分子轨道具有较普通的数学形式,较易程序化。
六十年代以来,随着计算机的发展,该方法得到了很大的发展。
如Pople等研制的Gaussian从头算程序, 已成为当今研究化学键理论的主流方法.一、分子轨道理论(Molecular orbital theory)要点1、分子轨道理论的基本观点是把分子看作一个整体,其中电子不再从属于某一个原子而是在整个分子的势力场范围内运动。
正如在原子中每个电子的运动状态可用波函数(ψ)来描述那样,分子中每个电子的运动状态也可用相应的波函数来描述。
2、分子轨道是由分子中原子的原子轨道线性组合而成,简称LCAO (linear combination of atomic orbitals 的缩写)。
组合形成的分子轨道数目与组合前的原子轨道数目相等。
如两个原子轨道ψa和ψb线性组合后形成两个分子轨道ψ1和ψ2ψ1 = c1ψa +c2ψb ;ψ2= c1ψa -c2ψb这种组合和杂化轨道不同,杂化轨道是同一原子内部能量相近的不同类型的轨道重新组合,而分子轨道却是由不同原子提供的原子轨道的线性组合。
原子轨道用s、p、d、f……表示,分子轨道则用σ、π、δ……表示。
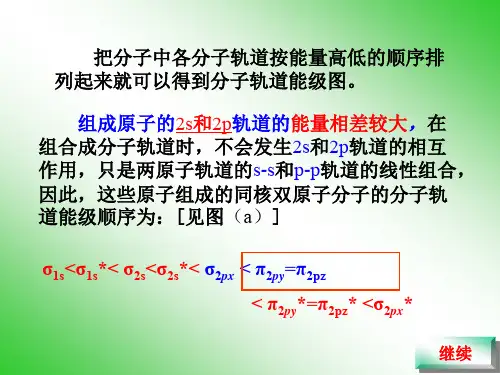
第一、二周期元素的同核双原子分子(或离子)及其分子轨道键的参数分析每个分子轨道都有相应的能量,把分子中各分子轨道按能级高低顺序排列起来,可得到分子轨道能级图。
现以第二周期元素形成的同核双原子分子为例予以说明。
在第二周期元素中,因它们各自的2s、2p轨道能量之差不同,所形成的同核双原子分子的分子轨道能级顺序有两种:一种是组成原子的2s和2p轨道的能量相差较大,在组合成分子轨道时,不会发生2s和2p轨道的相互作用,只是两原子的ss和pp轨道的线性组合,因此,由这些原子组成的同核双原子分子的分子轨道能级顺序为s*1s〈s*1s〈s2s〈s*2s〈s2px〈p2py= p2pz〈p*2py=p*2pz〈s*2px图(9-12)同核双原子分子的分子轨道的两种能级顺序(a)π2p >σ2p (b)σ2p >π2pO2、F2分子的分子轨道能级排列符合此顺序。
另一种是组成原子的2s和2p轨道的能量相差较小,在组合成分子轨道时,一个原子的2s轨道除能和另一个原子的2s轨道发生重叠外,还可与其2p 轨道重叠,其结果是使σ2p x分子轨道的能量超过π2p y和π2p z分子轨道。
由这些原子组成的同核双原子分子的分子轨道能级顺序为图[9-12(b)]即是此能级顺序的分子轨道能级图。
第二周期元素组成的同核双原子分子中,除O2、F2外,其余Li2、Be2、B2、C2、N2等分子的分子轨道能级排列均符合此顺序。
实例分析1:试分析氢分子离子H2+和He2分子能否存在。
解:氢分子离子是由1个H原子和1个H原子核组成的。
因为H2+中只有1个1s电子,所以它的分子轨道式为(σ1s)1。
这表明1个H 原子和1个H+离子是通过1个单电子σ键结合在一起的,其键级为。
故H2+可以存在,但不很稳定。
He原子的电子组态为1s2。
2个He原子共有4个电子,若它们可以结合,则He2分子的分子轨道式应为(σ1s)2(σ*1s)2,键级为零,这表明He2分子不能存在。