限制性片段长度多态性
- 格式:ppt
- 大小:1.06 MB
- 文档页数:10

末端限制性片段长度多态性分析技术在鸭肠道微生物群落结构研究中的应用杨为敏,孟玉学*(汝州市中等专业学校,河南汝州467500)文章编号:1004-2342(2023)03-0019-04中图分类号:S834文献标识码:A随着人们对动物消化道微生物的认识不断深入,鸭肠道微生物群落的研究也变得越来越重要。
鸭肠道微生物群落是指生活在鸭肠道内的微生物群体,是鸭消化系统的重要组成部分[1]。
鸭肠道微生物群落的组成和功能对于鸭的健康和生产性能具有重要影响。
因此,深入研究鸭肠道微生物群落的结构和功能,对于提高鸭的生产性能和保障鸭肉质量具有重要意义。
鸭肠道微生物群落是由细菌、真菌、古菌、原生动物等多种微生物组成的[2]。
这些微生物在鸭肠道内形成复杂的生态系统,相互作用,共同参与鸭的消化、吸收和免疫等生理过程。
鸭肠道微生物群落有多种功能。
一是促进鸭的消化和吸收:鸭肠道微生物群落中的一些细菌能够分解鸭无法消化的食物成分,产生一些有益的代谢产物,如短链脂肪酸、氨基酸和维生素等,这些代谢产物能够被鸭吸收利用,提高鸭的营养水平;二是维持肠道健康:鸭肠道微生物群落中的一些细菌能够抑制有害菌的生长,保持肠道微生态平衡,减少肠道疾病的发生;三是调节免疫功能:鸭肠道微生物群落中的一些细菌能够调节鸭的免疫功能,增强鸭的免疫力,提高鸭的抗病能力[3]。
末端限制性片段长度多态性分析(Terminal Restriction Fragment Length Polymorphism ,TRFLP )是一种基于PCR 扩增的DNA 指纹技术,可用于研究微生物群落的结构和多样性[4]。
该技术利用末端限制性酶对PCR 扩增产物进行酶切,得到一系列不同长度的DNA 片段,然后通过聚丙烯酰胺凝胶电泳分离,最终形成一条DNA 指纹图谱。
TRFLP 技术具有高通量、高灵敏度、高分辨率等优点,已广泛应用于微生物群落结构的研究[5]。
本研究旨在通过TRFLP 技术分析鸭肠道微生物群落的结构和多样性,探究不同饲养方式和饲料对鸭肠道微生物群落的影响,为鸭肠道微生物群落的调控提供理论依据。
限制性片段长度多态性(Restriction Fragment of Length Polymorphism,RFLP)一基本原理各种限制性酶能识别特定的碱基序列,并将其切开。
碱基的变异可能导致切点的消失或新切点的出现,从而引起DNA片段长度和数量的差异。
用特定的限制性内切酶消化目标DNA并通过电泳将长度不同的片断分开,并印记于硝酸纤维滤膜上,再与相应的探针杂交,就可以检测限制性片段长度多态性(RFLP).二主要材料DNA抽提用试剂,限制性内切酶,dNTP及Taq聚合酶电泳用琼脂糖或聚丙烯酰胺配制试剂,PCR扩增仪,水浴锅,电泳仪和电泳槽,硝酸纤维素滤膜或尼龙膜,探针标记物等。
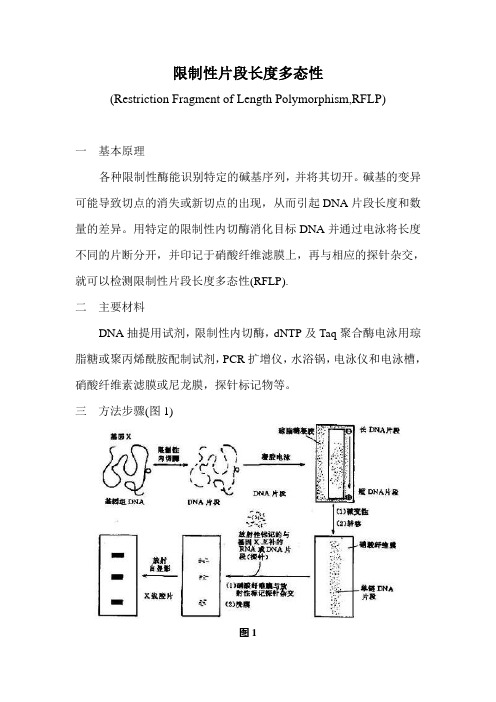
三方法步骤(图1)图1(一) 样本DNA制备采用常规DNA抽提的方法或DNA抽提试剂盒提取样本DNA,置低温下保存。
对大多数样本而言,用于分析的样本DNA片段须先从总DNA中分离获取,并制备足够的量。
为此,RFLP分析常先用PCR方法扩增目标片段。
无论怎么做,必须保证DNA样本的纯度,这一点是非常重要的。
(二) 限制性内切酶降解样本DNA根据不同的目标DAN,选择合适的限制性内切酶。
目前常用的限制性内切酶有EcoRⅠ和HindⅢ等。
该步骤必须保证酶解完全。
如果有必要,可以用琼脂糖凝胶电泳溴化乙锭分析酶解结果。
酶解的时间根据实际情况而定。
(三) 电泳电泳的主要目的是把DNA片段按大小(长短)分离开来,得到一个根据分子量排列的连续带谱。
电泳可采用琼脂糖凝胶电泳,也可采用聚丙烯酰胺凝胶电泳。
时间由几小时到24小时不等。
(四) 转印所谓转印,就是将已经电泳的DNA片段通过一定的方法转到固相支持物上。
常用的固相支持物有硝酸纤维素滤膜或尼龙膜。
转印前需经过碱变性溶液处理,将双链DNA变性为单链DNA。
转印的方法一般有三种。
根据DNA分子的复杂度转移2―12小时。
1 盐桥法;也叫毛细管转移法。
先把硝酸纤维素滤膜放在20×SSC 溶液中浸透,然后把滤膜平铺在凝胶上,再在滤膜上放上浸过20×SSC溶液的滤纸3张,再在该滤纸层上铺上干燥的滤纸3张,由于滤纸的吸附作用,胶下的缓冲液透过凝胶被吸附上来,同时胶中的DNA 分子就转移到滤膜上。

限制性片段长度多态性(RFLP,Restriction Fragment Length Polymorphism)RFLP技术于1980年由人类遗传学家Bostein提出。
它是第一代DNA分子标记技术。
Donis—Keller利用此技术于1987年构建成第一张人的遗传图谱。
DNA 分子水平上的多态性检测技术是进行基因组研究的基础。
RFLP(Restriction Fragment Length Polymorphism,限制片段长度多态性)已被广泛用于基因组遗传图谱构建、基因定位以及生物进化和分类的研究。
RFLP是根据不同品种(个体)基因组的限制性内切酶的酶切位点碱基发生突变,或酶切位点之间发生了碱基的插入、缺失,导致酶切片段大小发生了变化,这种变化可以通过特定探针杂交进行检测,从而可比较不同品种(个体)的DNA水平的差异(即多态性),多个探针的比较可以确立生物的进化和分类关系。
所用的探针为来源于同种或不同种基因组DNA的克隆,位于染色体的不同位点,从而可以作为一种分子标记(Mark),构建分子图谱。
当某个性状(基因)与某个(些)分子标记协同分离时,表明这个性状(基因)与分子标记连锁。
分子标记与性状之间交换值的大小,即表示目标基因与分子标记之间的距离,从而可将基因定位于分子图谱上。
分子标记克隆在质粒上,可以繁殖及保存。
不同限制性内切酶切割基因组DNA后,所切的片段类型不一样,因此,限制性内切酶与分子标记组成不同组合进行研究。
常用的限制性内切酶一般是HindⅢ,BamHⅠ,EcoRⅠ,EcoRV,XbaⅠ,而分子标记则有几个甚至上千个。
分子标记越多,则所构建的图谱就越饱和。
构建饱和图谱是 RFLP 研究的主要目标之一。
1 原理该技术是利用限制性内切酶能识别DNA分子的特异序列,并在特定序列处切开DNA分子,即产生限制性片段的特性,对于不同种群的生物个体而言,他们的DNA序列存在差别。
如果这种差别刚好发生在内切酶的酶切位点,并使内切酶识别序列变成了不能识别序列或是这种差别使本来不是内切酶识别位点的DNA序列变成了内切酶识别位点。

分⼦标记介绍分⼦标记是指可遗传的并可检测的DNA序列或蛋⽩质。
即DNA⽚段即能反映⽣物个体或种群间基因组中某种差异特征的DNA ⽚段;能受基因控制并且能够稳定遗传的,能代表个体或群体的遗传特征,并可被⽤作遗传分析的物质。
它能够直接反映基因组间DNA间的差异。
常⽤的分⼦标记有RFLP、RAPD、AFLP、SSR、ISSR、EST等。
RAPD、AFLP属于以PCR为基础的分⼦标记;RFLP属于以Southern为基础的分⼦标记;SSR、ISSR属于以重复序列为基础的分⼦标记;EST以mRNA为基础的分⼦标记。
1 主要的分⼦标记介绍1.1 限制性⽚段长度多态性(RFLP)RFLP是应⽤Southern杂交技术检测DNA在限制性内切酶酶切后形成的特定DNA⽚段的⼤⼩。
所以对于引起酶切位点变异的突变如点突变或部分DNA⽚段的缺失、插⼊、倒位⽽引起酶切位点缺失或获得等均可应⽤。
此⽅法的基本步骤包括:DNA的提取、⽤限制性内切酶酶切DNA、凝胶电泳分开DNA⽚段、把DNA⽚段转移到滤膜上、利⽤放射性标记的探针显⽰特定的DNA⽚段、分析结果。
探针⼀般选择单拷贝的。
其优点为共显性标记,稳定且可重复但耗时,昂贵且需应⽤同位素。
⽤该技术可作出植物的RFLP图谱,并应⽤于植物遗传和育种研究。
杨长红等采⽤PCR-RFLP技术,对库尔勒⾹梨等19个主要梨品种的cpDNA遗传多态性进⾏研究,其利⽤10对通⽤引物对总DNA进⾏扩增,并且采⽤7种限制性内切酶对PCR产物进⾏酶切,通过软件分析得出:7对引物(cp01、cp02、cp03、cp04、cp06、cp09、cp10)能在梨属植物上扩增出1条特异性谱带,cp09/MvaI,cp03/Hin6I的酶切位点有显著差异。
根据结果分析,库尔勒⾹梨与鸭梨、砀⼭梨、苹果梨、早酥、慈梨、⾦川雪梨、锦丰、新疆句句梨的平均距离系数较⼩,与其他梨的平均距离系数较⼤。
1.2 随机扩增多态性DNA(RAPD)RAPD是以8-10个碱基的随机寡聚核苷酸序列为引物,利⽤PCR技术⾮特异性扩增DNA⽚段,然后⽤凝胶电泳分开扩增⽚段,即得到⼀系列多态性DNA⽚段.染⾊后即可进⾏多态性分析。

第9章 动物DNA限制性片段长度多态性分析9.1 动物DNA限制性片段长度多态性基本概况DNA限制性片段长度多态性(restriction fragment length polymorphism,简称RFLP)是进行动物物种分化和群体遗传多样性研究的一项重要经典技术,而线粒体DNA和核糖体DNA 则是动物RFLP研究中最为常用的两种遗传标记(Nei,Tajima 1981)。
动物线粒体DNA是一种共价闭环的环状双链DNA,具有严格的母系遗传方式,每个细胞中有 1 000~10 000个拷贝,容易从组织中分离、提纯(Brown等 1979;Avise等 1983;Lansman 1983)。
提取线粒体DNA的实验技术比较简单,且重复性好(王文,施立明 1993)。
mtDNA的基因结构比较简单、稳定,分子量小(15.7~19.5kb),处于限制性内切酶分析范围,因此易于进行结果分析(Brown 1979)。
在脊椎动物中,mtDNA无组织特异性,即个体内的线粒体DNA具有高度的均一性(Avise等 1983),这就有利于限制性内切酶分析。
更为重要的是,mtDNA进化速度快,是单拷贝核DNA的5~10倍,因而是进行近缘种间和种内群体间分化关系研究的良好遗传标记(Brown等 1979,1983;Wilson 1985;Avise 1986;Harrison 1989)。
生物多样性研究中基本保护单元----进化显著性单元(evolutionary significant units,简称ESUs)(Ryder 1989)的确定,就极大地依赖于不同动物群体线粒体DNA单倍型的系统发育关系(Moritz 1994)。
ESUs的定义为:在mtDNA单倍型上互为单系群(monophyly)、在核基因座位上等位基因频率有显著差别的群体即称为ESUs。
强调mtDNA的互为单系群,不仅因为它在进化上的重要性,而且因为理论上和模拟实验均说明隔离群体在一定时间后能达到这种状态。
如何用PCR法检测基因的多态性多态性(polymorphism)是指处于随机婚配的群体中,同一基因位点可存在2种以上的基因型。
在人群中,个体间基因的核苷酸序列存在着差异性称为基因(DNA)的多态性(gene polymorphism)。
这种多态性可以分为两类,即DNA位点多态性(site polymorphism)和长度多态性(longth polymorphism)。
基因多态性的主要检测方法简述如下:1.限制性片段长度多态性(Restriction Fragment Length Polymorphism,RFLP):由DNA 的多态性,致使DNA 分子的限制酶切位点及数目发生改变,用限制酶切割基因组时,钠问亢兔扛銎蔚某ざ染筒煌此降南拗菩云纬ざ榷嗵裕贾孪拗破纬ざ确⑸谋涞拿盖形坏悖殖莆嗵晕坏恪W钤缡怯肧outhern Blot/RFLP方法检测,后来采用聚合酶链反应(PCR)与限制酶酶切相结合的方法。
现在多采用PCR-RFLP法进行研究基因的限制性片段长度多态性。
2.单链构象多态性(SSCP):是一种基于单链DNA构象差别的点突变检测方法。
相同长度的单链DNA如果顺序不同,甚至单个碱基不同,就会形成不同的构象。
在电泳时泳动的速度不同。
将PCR产物经变性后,进行单链DNA凝胶电泳时,靶DNA中若发生单个碱基替换等改变时,就会出现泳动变位(mobility shift),多用于鉴定是否存在突变及诊断未知突变。
3.PCR-ASO探针法(PCR-allele specific oligonucleotide, ASO):即等位基因特异性寡核苷酸探针法。
在PCR扩增DNA片段后,直接与相应的寡核苷酸探杂交,即可明确诊断是否有突变及突变是纯合子还是杂合子。
其原理是:用PCR扩增后,产物进行斑点杂交或狭缝杂交,针对每种突变分别合成一对寡核苷酸片段作为探针,其中一个具有正常序列,另一个则具有突变碱基。
突变碱基及对应的正常碱基匀位于寡核苷酸片段的中央,严格控制杂交及洗脱条件,使只有与探针序列完全互补的等位基因片段才显示杂交信号,而与探针中央碱基不同的等位基因片段不显示杂交信号,如果正常和突变探针都可杂交,说明突变基因是杂合子,如只有突变探针可以杂交,说明突变基因为纯合子,若不能与含有突变序列的寡核苷探针杂交,但能与相应的正常的寡核苷探针杂交,则表示受检者不存在这种突变基因。