长宁初中补习班 新王牌化学物质量的运算
- 格式:doc
- 大小:1012.00 KB
- 文档页数:4

中考化学计算知识点总结化学计算知识点总结如下:
一、摩尔概念
1. 摩尔的概念
2. 摩尔质量的计算
3. 摩尔体积的计算
二、物质的量与质量关系
1. 物质的量与质量的关系
2. 质量分数
3. 气体电荷的计算
三、化学方程式的平衡
1. 化学方程式的平衡及平衡常数
2. 压力和浓度对平衡的影响
3. 平衡常数和平衡浓度的计算
四、氧化还原反应的计算
1. 氧化还原反应的基本概念
2. 氧化还原反应的平衡
3. 氧化数和半反应方程式的计算
五、溶液及其计算
1. 溶解度的计算
2. 浓度的计算
3. 溶解过程中的热效应计算
六、电解质溶液的电导率计算
1. 电解质溶液的电导率
2. 电导率与浓度的关系
3. 电导率和电导率浓度的计算
七、化学反应的速率及动力学
1. 化学反应速率的概念
2. 反应速率的计算
3. 反应动力学的基本概念
总之,化学计算是化学学科中非常重要的一部分,它涵盖了很多知识点和内容。
掌握化学计算的知识将对化学学科的学习和实际应用产生积极的影响。
希望同学们能够认真学习化学计算知识,提高自己的化学水平。

初中中考化学技巧型计算化学技巧型计算是指在化学学科中,涉及到以计算为主要内容的题目,主要包括化学计量、化学反应平衡、溶液配制和浓度计算等方面的计算题目。
掌握这些计算技巧,可以有效提高学习化学的效率和解答相关题目的准确性。
本文将针对初中中考化学技巧型计算进行讲解,希望对学生们的学习有所帮助。
一、化学计量计算化学计量计算是基于化学方程式和化学反应原理进行计算的一种技巧。
它主要涉及到物质的量、质量和体积之间的计算关系。
下面以一些典型题目为例,介绍相应的计算技巧。
1.给出物质的量和相应的化学方程式,计算其他物质的量或质量。
例如:已知甲烷(CH4)和氧气(O2)按完全反应所得到的化学方程式是:CH4+2O2→CO2+2H2O题目:如果甲烷的物质的量为2mol,求氧气的物质的量和质量。
解题思路:根据化学方程式可以看出,甲烷和氧气的摩尔比为1:2、所以氧气的物质的量为4mol,根据氧气和甲烷的摩尔质量可以计算出氧气的质量。
2.根据始末物质的量或质量和相应的化学方程式,计算反应中消耗或生成的物质的量或质量。
例如:已知铁与硫按完全反应所得到的化学方程式是:Fe+S→FeS题目:如果铁的质量为10g,硫的质量为20g,求反应中生成的硫化铁的质量。
解题思路:根据化学方程式可以看出,铁和硫的摩尔比为1:1,所以铁的物质的量为铁的质量除以铁的摩尔质量,即10g / 56g/mol =0.1786mol;硫的物质的量为硫的质量除以硫的摩尔质量,即20g /32g/mol = 0.625mol。
根据摩尔比可以求得生成的硫化铁的物质的量为0.1786mol,再根据硫化铁的摩尔质量可以计算出硫化铁的质量。
二、化学反应平衡计算化学反应平衡计算是基于化学反应平衡原理进行计算的一种技巧。
它主要涉及到不同物质的量之间的比例关系。
下面以一些典型题目为例,介绍相应的计算技巧。
1.根据给定的化学方程式和部分物质的量,计算其他物质的量。
例如:已知二氧化硫(SO2)与氧气(O2)按完全反应所得到的化学方程式是:2SO2+O2→2SO3题目:如果已知SO2的质量为10g,求SO3的物质的量。
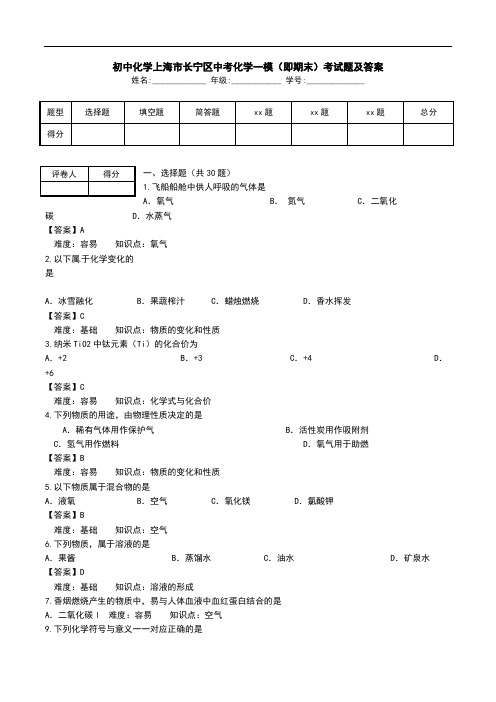
初中化学上海市长宁区中考化学一模(即期末)考试题及答案姓名:_____________ 年级:____________ 学号:______________题型选择题填空题简答题xx题xx题xx题总分得分一、选择题(共30题)评卷人得分1.飞船船舱中供人呼吸的气体是A.氧气B.氮气C.二氧化碳D.水蒸气【答案】A难度:容易知识点:氧气2.以下属于化学变化的是A.冰雪融化 B.果蔬榨汁C.蜡烛燃烧D.香水挥发【答案】C难度:基础知识点:物质的变化和性质3.纳米TiO2中钛元素(Ti)的化合价为A.+2B.+3C.+4D.+6【答案】C难度:容易知识点:化学式与化合价4.下列物质的用途,由物理性质决定的是A.稀有气体用作保护气B.活性炭用作吸附剂C.氢气用作燃料D.氧气用于助燃【答案】B难度:容易知识点:物质的变化和性质5.以下物质属于混合物的是A.液氧 B.空气C.氧化镁D.氯酸钾【答案】B难度:基础知识点:空气6.下列物质,属于溶液的是A.果酱B.蒸馏水C.油水D.矿泉水【答案】D难度:基础知识点:溶液的形成7.香烟燃烧产生的物质中,易与人体血液中血红蛋白结合的是A.二氧化碳l 难度:容易知识点:空气9.下列化学符号与意义一一对应正确的是A.N2:两个氮原子B.SO3:硫酸根C.2H2:2个氢分子D.:+3价的铝【答案】C难度:中等知识点:化学式与化合价10.下列实验操作正确的是A.滴加液体B.取用固体C.测溶液pH D.读数据【答案】C难度:容易知识点:走进化学实验室11.为了保持身体健康,人体不同器官内的体液需保持一定的酸碱度:体液尿液胃液血液pH4.7—8.40.9—1.57.35—7.45根据上表可知,在正常情况下A.人体的尿液一定呈酸性B.广泛pH试纸可精确测得以上体液的pH C.人体的胃液能使紫色石蕊试液变蓝色D.人体的血液一定呈碱性【答案】D难度:中等知识点:酸和碱单元测试12.氢氧化钙是一种建筑材料,它的俗名是A.生石灰B.石灰石C.大理石D.熟石灰【答案】D难度:容易知识点:生活中常见的盐13.下列实验现象的描述正确的是A.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁B.硫在氧气中燃烧,发出微弱的淡蓝色火焰,产生有刺激性气味的气体C.木炭在氧气中剧烈燃烧,发出白光,放出热量D.在大理石上滴加稀盐酸,产生二氧化碳气体【答案】C难度:中等知识点:我们周围空气单元测试14.在 Fe2O3 + 3CO2Fe + 3CO2中,作还原剂的物质是A.Fe2O3B.CO C.Fe D.CO2 【答案】B难度:容易知识点:化学方程式单元测试15.某物质R燃烧的化学方程式为: 2R+5O2 4CO2+2H2O ,则R的化学式是A.C2H4B.C2H2C.CH4D.C2H6O【答案】B难度:容易知识点:质量守恒定律16.对化学方程式2H2+O22H2O的含义叙述正确的是A.氢气加氧气点燃等于水B.氢气和氧气在点燃条件下反应生成水C.两个氢分子加一个氧分子等于两个水分子D.2mol氢气和1mol氧气生成2mol水【答案】B难度:容易知识点:如何正确书写化学方程式17.2013年6月11日,“神州十号”成功发射。

2024年中考化学关于物质的量与摩尔计算在 2024 年的中考化学中,物质的量与摩尔计算是一个重要的知识点。
对于很多同学来说,初次接触这部分内容可能会感到有些困惑,但只要我们掌握了其核心概念和计算方法,就能轻松应对相关的考题。
首先,让我们来了解一下什么是物质的量。
物质的量是一个用于衡量一定数目粒子集合体的物理量,它就像是一个“大口袋”,把众多的微观粒子装在一起进行计量。
我们用符号“n”来表示物质的量。
那摩尔又是什么呢?摩尔是物质的量的单位,就像我们用“米”来衡量长度,用“千克”来衡量质量一样,我们用“摩尔”来衡量物质的量。
1摩尔任何粒子所含的粒子数均为阿伏伽德罗常数个,约为602×10²³个。
比如说,1 摩尔氧气分子,就含有 602×10²³个氧气分子;1 摩尔氢原子,就含有 602×10²³个氢原子。
接下来,我们看看物质的量(n)、阿伏伽德罗常数(NA)和粒子数(N)之间的关系。
它们之间的关系式为:n = N/NA 。
这个公式就像是一把钥匙,能帮助我们在物质的量、粒子数和阿伏伽德罗常数之间自由转换。
举个例子,如果我们知道某种物质的粒子数是 1204×10²⁴个,阿伏伽德罗常数约为 602×10²³个/摩尔,那么物质的量 n 就可以通过计算得出:n = 1204×10²⁴÷(602×10²³) = 2 摩尔。
再来说说物质的量与物质质量之间的关系。
对于任何物质,物质的量(n)、物质的摩尔质量(M)和物质的质量(m)之间存在这样的关系:n = m/M 。
摩尔质量在数值上等于该物质的相对原子质量或相对分子质量,单位是克/摩尔。
例如,氧气(O₂)的相对分子质量约为 32,那么氧气的摩尔质量就是 32 克/摩尔。

初中化学计算知识点汇总化学计算是初中化学的重要内容之一,它是运用数学方法解决化学实际问题的过程。
掌握化学计算知识点对于学好化学课程和提高化学实验能力都至关重要。
下面将对初中化学计算的知识点进行汇总和总结。
一、化学计算的基本单位和换算1. 物质的量:物质的量是指物质中含有的粒子数目,用摩尔(mol)表示。
2. 摩尔质量:摩尔质量是指一个物质的摩尔数含有的质量,用单位g/mol表示。
3. 摩尔体积:摩尔体积是指一个物质的摩尔数所占据的体积,常用单位是升/摩尔(L/mol)。
二、摩尔质量的计算1. 元素的相对原子质量:元素的相对原子质量是指元素相对于碳-12同位素的质量。
2. 分子的相对分子质量:分子的相对分子质量是指分子中所有原子相对原子质量之和。
3. 组成物质的质量的计算:根据元素在化学式中的个数和相对原子质量,可以计算出物质的质量。
三、物质的计量关系1. 化学方程式和反应物的摩尔比:化学方程式描述了化学反应中反应物和生成物之间的摩尔比关系。
2. 反应物的计量关系:根据反应物的摩尔比,可以计算反应物的消耗量和生成物的产生量。
3. 溶液的浓度计算:溶液的浓度是指溶质的质量与溶液体积的比值。
四、气体的计算1. 气体的摩尔体积:理想气体状态方程PV=nRT中的V为气体的摩尔体积。
2. 压强和摩尔体积的计算:理想气体状态方程PV=nRT中的P为气体的压强,R为气体常数,T为气体的温度。
3. 气体的混合计算:根据气体的分压比例关系,可以计算气体的混合物体积。
五、溶液的计算1. 溶液的质量分数:溶液的质量分数是指溶质的质量与溶液总质量的比值。
2. 溶液的摩尔浓度:溶液的摩尔浓度是指溶质的摩尔数与溶液体积的比值。
六、能量计算1. 化学反应的能量变化:化学反应的能量变化可以通过反应物和生成物的摩尔质量以及反应热(或焓变)来计算。
2. 燃烧热的计算:燃烧热是燃料燃烧时释放的热量,可以通过燃料的燃烧产生的能量和摩尔质量计算。
1、掌握物质的量相关的计算公式D 、H 2S 中氢、硫元素的质量之比为(1×2):32≠2:1,故错误。
知识点二 填空题综合考察 【典型例题】例1(2021·上海杨浦·二模)已知2gH 2、20gHF 中所含分子数均为a 。
一定条件下,某反应中所有物质的分子数随反应过程的变化如图所示(H 2和物质X 的变化曲线重合)。
下列说法正确的是A .物质X 的分子式为F 2B .一个F 原子的质量为19g aC .t 时刻,H 2和HF 的质量相等D .反应开始时,物质X 的质量为19g 【答案】AB【详解】A 、由图可知,a 个氢气和a 个X 反应生成2a 个HF ,根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含2个H ,生成物中含2个H ,2个F ,故反应物中还应含2个F ,故X 的化学式为F 2,符合题意;B 、因为2g 氢气所含的分子式为a ,则所含的氢原子数为2a ,故a 个氢原子的质量为1g ,20gHF 所含分子数为a ,所含氢原子数为a ,氟原子数为a ,故a 个氟原子的质量为:20g -1g=19g ,故一个氟原子的质量为19g a,符合题意;C 、t 时刻,氢气和HF 的分子数相同,则质量比为:2:20=1:10,质量不相等,不符合题意;D 、该反应的化学方程式为:22H +F 2HF 一定条件,由图可知,氢气的分子数为a ,生成HF 的分子数为2a ,故氢气的质量为2g ,生成HF 的质量为2×20g=40g ,根据质量守恒定律,化学反应前后,物质的总质量不变,可得,反应开始时,物质X 的质量为40g -2g=38g ,不符合题意。
故选AB 。
例2(2021·上海虹口·二模)向盛有一定量大理石粉末的烧杯中滴加稀盐酸,生成二氧化碳的物质的量与加入稀盐酸体积的变化关系如下图所示。
(假设二氧化碳全部逸出,杂质不溶于水也不参加反应)相关分析正确的是A.稀盐酸的体积为V1时,烧杯中溶液的溶质为amolB.实验过程中,烧杯内物质的质量,先变小再变大C.稀盐酸的体积为V3时,烧杯中的溶液只含有一种溶质D.大理石中碳酸钙为bmol【答案】AD【详解】A、稀盐酸体积为V1时,生成二氧化碳的量为amol,由方程式可知氯化钙和二氧化碳的物质量只比为1:1,则产生氯化钙的量也为amol,正确;B、根据化学方程式可以看出:73份氯化氢参加反应,可以生成44份二氧化碳,则溶液质量增加,当碳酸钙反应完后,加入的盐酸也使溶液质量增大,B说法错误;C、稀盐酸的体积为V3时,盐酸过量,则溶液中的溶质有反应生产的氯化钙和剩下的氯化氢,C错;D、反应最终产生bmol的二氧化碳,由方程式可知碳酸钙和二氧化碳的物质量只比为1:1,则碳酸钙的量也为bmol。
第7课时物质的量【知识回顾】−−→K2MnO4+ MnO2+ O2↑(1) KMnO4∆(2) Al + CuSO4−−→Al2(SO4)3 + Cu(3) Zn + HCl−−→ZnCl2 + H2↑(4) Al2O3 + H2SO4−−→Al2(SO4)3 + H2O(5) Fe2(SO4)3+NaOH−−→Na2SO4+ Fe(OH)3↓(6) Fe(OH)3+ H2SO4−−→Fe2(SO4)3+ H2O(7) CH4+ O2−−→CO2 + H2O(8) C + CO2−−→CO(9) NH3+ O2−−→NO + H2O(10) CO + Fe2O3−−→Fe + CO2教学目标:1.知道物质的量的概念、单位及引入物质的量的意义2.理解摩尔质量的概念、单位和它的数值3.会根据物质的量,计算微粒数;会根据微粒数,计算物质的量4.会进行物质的量、质量和摩尔质量三者间的简单换算5.会根据化学方程式进行物质的量的计算教学重点:1.会进行物质的量、质量和摩尔质量三者间的简单换算2.会根据化学方程式进行物质的量的计算教学过程:在前面的学习中,我们知道分子、原子等肉眼看不见的微粒,可以构成客观存在的、具有一定质量的物质。
这说明我们肉眼看不见的粒子与物质的质量之间,必定存在着某种联系,事实上,构成物质的分子、原子数目巨大,可以采用集合的形式来表示。
“物质的量”就是采用集合的形式来表示物质微粒集体的基本量;它是沟通物质的微粒数目与质量的“桥梁”,通过“物质的量”可以将微观世界与宏观世界联系在一起。
一、物质的量1.定义:表示物质所含微粒数目多少的物理量。
符号为:n,它是国际单位制中的七个基本物理量之一,“物质的量”这四个字是一个整体,不能分开。
2.单位:摩尔,简称摩,符号mol3.大小:1摩尔任何物质都约含6.02×1023个微粒。
我们把6.02×1023这个数字又叫做阿伏伽德罗常数,符号为N A,即N A≈6.02×10234.公式:物质的量(n )、与微粒数(N )、阿伏伽德罗常数(N A )三者间的换算关系 物质的量=物质的微粒数/阿伏伽德罗常数公式表示为: n = AN N 5.注意:使用物质的量时,必须指明粒子的种类,可以是分子、原子、电子等,物质的量是个巨大数量粒子集合体,系数可以不是整数,如 0.5mol ,0. 01mol ,2.3mol 等。
初一化学基本化学计算方法与技巧清单化学是一门实验性科学,它涉及到很多实验和计算。
在初一学习化学的过程中,我们需要掌握一些基本的化学计算方法与技巧。
下面是一个清单,介绍了初一化学中常用的计算方法和技巧。
一、摩尔计算方法1. 摩尔质量计算:摩尔质量是指一个物质的相对分子质量或者相对分子质量的平均值,在计算时,可以用化学式查找元素的相对原子质量,然后按摩尔的数目比较、求和。
2. 用摩尔关系式解题:在化学方程式中,元素、离子和分子的系数,代表的是它们的摩尔比例关系。
根据方程式的系数和所给条件,可以求解未知的物质的摩尔个数。
二、溶液的浓度计算方法1. 质量分数计算:质量分数是指溶液中溶质质量与溶液总质量之比。
计算时,可以用溶质质量除以溶液总质量,然后乘以100%。
2. 摩尔浓度计算:摩尔浓度是指溶质的摩尔数与溶液体积的比值。
计算时,可以用溶质的摩尔数除以溶液的体积,得到摩尔/升的单位。
三、化学反应的计算方法1. 实验室反应物质量计算:根据化学方程式的系数和所给条件,可以通过计算摩尔质量和摩尔比例,来计算所需反应物的质量。
2. 燃烧反应计算:在燃烧反应中,可以使用化学方程式的系数和摩尔质量,结合物质的质量和摩尔比例来计算产物的质量。
四、气体的计算方法1. 理想气体状态方程计算:理想气体状态方程可以用于计算气体的体积、压强、温度和摩尔数之间的关系。
根据方程式PV=nRT,可以进行气体的计算。
2. 气体摩尔体积计算:在气体反应和气体性质的计算中,常常需要计算气体的摩尔体积。
计算方法是根据理想气体状态方程,将气体的体积和摩尔数代入计算。
五、溶解度计算方法1. 饱和溶液的溶解度计算:溶解度是指单位体积溶剂在一定温度下可以溶解溶质的最大质量,可以用质量分数、摩尔浓度或溶解度来表示。
2. 溶解度曲线计算:溶解度曲线表示在不同温度下饱和溶液的溶解度随温度变化的关系。
通过溶解度曲线,可以计算在给定温度下的溶液的溶解度。
以上是初一化学基本化学计算方法与技巧的清单。
化学方程式的意义
质量比 __________________________
分子个数比 __________________________
化学反应C+O 2−−−→点燃
CO 2的说法中错误的是( )
A .该反应中O 2是氧化剂
B .碳在氧气中燃烧,发出白光
C .每1 g 碳和1 g 氧气点燃后反应生成2 g 二氧化碳
D .每1 mol 碳和1 mol 氧气点燃后反应生成1 mol 二氧化碳 化学方程式的计算题
(1)有关反应物和生成物的计算
1、已知5gA 与2gB 恰好完全反应生成3gC 和若干克D 。
若制取8gD ,则需__________g A
2、
3、甲醇(CH 3OH )是一种有毒、有酒的气味的可燃性液体。
甲醇在氧气中不完全燃烧可发
生如下反应:8CH 3OH+nO 2 mCO 2+2CO+16H 2O 。
若反应生成3.6g 水,请计算: ⑴m 值是__________。
⑵参加反应的氧气质量是多少克?
(2)含有杂质的反应物和生成物的计算
1、某炼铁厂用含氧化铁80%的赤铁矿冶炼生铁。
若要炼出1120t 含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?
2、将100g 含 CaCO 3质量分数为80%的石灰石样品(杂质不发生化学反应也不含钙),高温灼烧一段时间....
后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成CaO 的质量约为________________________
2、一氧化碳能在高温下还原铁矿石中的氧化铁。
现用200t 含氧化铁80%的铁矿石炼铁,可炼出含铁95%的生铁多少吨?
⑴请你根据化学方程式进行计算。
⑵本题还有其他解法吗?若有,只要求说明依据并列出算式。
若没有,可不回答此问。
(3)和实验相结合的计算题
1、化学兴趣小组对某石灰石样品中碳酸钙的含量进行实验探究。
该小组取用4g 样品,测定该石灰石的纯度,用未知溶质质量分数的稀盐酸40g 分4次加入。
每次充分反应后,经过滤、干燥等操作后称量固体的质量。
(假设过滤、干燥等操作过程,固体物质的质量不受损耗;石灰石中的杂质不与盐酸反应,也不溶于水。
)实验结果见下表:
请计算:(1) 该石灰石样品中碳酸钙的质量分数是多少?
(2) 所用的稀盐酸中,溶质的质量分数是多少?
(3) 4g石灰石样品与足量的稀盐酸反应,生成二氧化碳多少克?
2、小东从海边捡来一些嵌有沙砾的贝壳(主要成分为碳酸钙),为测定碳酸钙的含量,他做
了如下实验:首先称取50 g贝壳样品,然后将150 mL的盐酸分5次加入(假设其余杂质均不与盐酸反应)。
实验过程中的数据记录如下:
(1)X =g;
(2)小东测得贝壳样品中碳酸钙的质量分数是;
(3)若把二氧化碳收集起来,共有_____________g。
某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样
(1)
(2)上表中m的数值是___________
(3)试计算这种石灰石矿中碳酸钙的质量分数。
3、石灰石是主要矿产,小江同学为了寻找纯度超过85%的石灰石,对样品进行了定量实验。
烧杯的质量为烧杯和盐酸的石灰石样品样品的质量为
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)(4)标签型化学方程式的计算
鸡蛋壳(
12.5g ) 剩余的混合物(48.6g ) 至质量不减少 稀盐酸(40.5g ) 鸡蛋壳
稀盐酸1、消化药片所含的物质能中和胃里过多的胃酸。
某种消化药品的标签如图4所示。
医生给某胃酸过多的患者开出服用此药的处方为:每日3次,每次2片。
试计算,患者按此处方服用该药一天,理论上可中和HCl
2、况,取5g 该溶液共制得0.64g 液在保存过程中已经分解的过氧化氢的质量。
(5)有关字母型化学反应方程式计算题 1、 A 、B 、C 三种物质各15 g ,它们化合时只能生成30 g 新物质D 。
若增加10 g A ,则反应停止后,原反应物中只余C 。
根据上述条件推断下列说法中正确的是
A .第一次反应停止后,
B 剩余9 g B .第二次反应后,D 的质量为50 g
C .反应中A 和B 的质量比是3∶2
D .反应中A 和C 的质量比是5∶2
2、在反应2A+5B=2C+4D 中,C 、D 的相对分子质量之比为9∶22.若2.6 gA 与B 完全反应后.生成8.8gD 。
则在此反应中B 与D 的质量比为( )
A .4∶9 B.8∶1 C.10 ∶ 11 D.31∶44
(6)综合题
1、小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了
如下实验探究。
【实验过程】小张同学组装了右图装置。
将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入 足量的稀盐酸充分反应(假设其他杂质不与盐酸反应)。
测得相关数据如图所示: + 【数据处理】
(1)根据质量守恒定律,反应生成二氧化碳的质量为 g 。
(2)请用化学方程式计算鸡蛋壳中碳酸钙的物质的量是多少?并求此蛋壳中碳酸钙的质量分数是多少?(写出计算过程)
【实验反思】用该装置制取二氧化碳,反应进行较长时间后,小张用燃着的火柴放在集气瓶口,火焰仍不熄灭。
请从实验装置上分析,你认为原因是 。
07年闸北:某同学为测定某石灰石中碳酸钙的质量 (杂质不与酸反应),向6.0g 石灰石样品
中逐滴加入稀盐酸至不再产生气泡为止,共生成二氧化碳气体1.11L (该条件下二氧化碳气体的密度为1.977g/L )。
试计算:
(1)该反应生成二氧化碳的质量为 g ;(精确到0.1g )
(2)该石灰石样品中碳酸钙的质量为多少g?(写出计算过程)
2、下图是实验室制取气体的常用装置。
①写出仪器a的名称:a 。
②用氯酸钾和二氧化锰的混合物制取O2可选择的装置组合是(只写一组)。
③实验室用B装置可制CO2气体,反应的化学方程式为:__________。
B装置图示的
是反应(填“发生”或“停止”)。
用二氧化锰和双氧水混合制氧气时,(填“能”或“不能”)用B装置,理由是。
④取相同质量的粉末碳酸钙和块状碳酸钙分别与相同质量的稀盐酸在烧杯中混合,绘
制出烧杯内物质总质量随反应时间的变化情况,如下图所示,则粉末碳酸钙和盐酸反应所对应的曲线是(填“①”或“②”)。
⑤50g过氧化氢溶液和3g MnO2充分反应后,剩余物质52.2g,
则产生氧气的质量是克.求参加反应的过氧化氢的
物质的量?
3、根据下列装置图回答问题。
A B C D E F G
(1)标出仪器名称:①是;②是
(2)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为_______________________;制取二氧化碳时应选择的发生装置和收集装置为(填字母序号),选择此收集装置的理由是;若将产生的二氧化碳通入紫色石蕊试液,试液变色,原因是(用化学方程式表示)。
(3)实验室用一定质量的氯酸钾和二氧化锰制取氧气,通过排水量测定所收集到的氧气体积(装置选用A、F、G)。
(4)其中二氧化锰的作用是___________________________;
(5)若各装置的连接顺序是:a→b→c→d,F装置内导管(“b”或“c”)该怎样延伸?请在装置F中画出;
(6)根据氯酸钾的质量算出的氧气体积为理论值。
如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因可能是。
(7)实验室用1.36克H2O2溶液和一定量的MnO2也能制取氧气,试计算完全反应后产生氧气的物质的量。
(根据化学方程式列式计算)。