专题二化学常用计量
- 格式:doc
- 大小:44.50 KB
- 文档页数:2


专题二化学常用计量[最新考纲]1.了解物质的量的单位——摩尔( mol)、摩尔质量、气体摩尔体积、物质的量浓度,阿伏加德罗常数的含义。
2.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.了解溶液的含义,了解溶解度、饱和溶液的概念。
4.了解溶液的组成;理解溶液中溶质的质量分数的概念,并能进行有关计算。
5.了解配制一定溶质质量分数、物质的量浓度溶液的方法。
考点一有关阿伏加德罗常数的综合判断[重温真题]1.(2016·课标全国Ⅰ,8)设N A为阿伏加德罗常数值。
下列有关叙述正确的是() A.14 g乙烯(C2H4)和丙烯(C3H6)混合气体中的氢原子数为2N AB.1 mol N2与4 mol H2反应生成的NH3分子数为2N AC.1 mol Fe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24 L CCl4含有的共价键数为0.4N A2.(2016·四川理综,4)N A为阿伏加德罗常数的值。
下列说法正确的是() A.2.4 g Mg在足量的O2中燃烧,转移的电子数为0.1N AB.标准状况下,5.6 L CO2气体中含有的氧原子数为0.5N AC.氢原子数为0.4N A的CH3OH分子中含有的共价键数为0.4N AD.0.1 L 0.5 mol/L CH3COOH溶液中含有的H+数为0.05N A3.(2015·全国卷Ⅰ,8)N A为阿伏加德罗常数的值。
下列说法正确的是() A.18 g D2O和18 g H2O中含有的质子数均为10N AB.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2N AC.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2N AD.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2N A4.(2015·全国卷Ⅱ,10)N A代表阿伏加德罗常数的值。


专题二化学常用计量1.设N A为阿伏加德罗常数的数值,下列说法正确的是()A.23 g Na与足量H2O反应完全后可生成N A个H2分子B.1 mol Cu和足量热浓硫酸反应可生成N A个SO3分子C.标准状况下,22.4 L N2和H2混合气中含N A个原子D.3 mol单质Fe完全转变为Fe3O4,失去8N A个电子答案D解析由化学方程式2Na+2H2O===2NaOH+H2↑知,23 g(即1 mol)Na与足量H2O反应可生成0.5N A个H2分子,故A错误;Cu和足量热浓硫酸反应生成的是SO2而不是SO3,故B错误;标准状况下,22.4 L(即1 mol)N2和H2的混合气体,含有2N A个原子,故C错误;Fe―→Fe3O4,可以看作铁元素的化合价由0价升高到+83价,故3 mol Fe失去电子数为(83-0)×3N A=8N A,故D正确。
2.N A表示阿伏加德罗常数的值,下列叙述中正确的是()A.20.0 g重水(2H2O)中所含质子数和中子数均为10N AB.标准状况下,11.2 L戊烷中含有的共价键数目为8N AC.1.0 L 0.1 mol·L-1 Cu(NO3)2溶液中含有的Cu2+数目为0.1N AD.常温常压下,22.4 L C2H4中含有的氢原子数目为4N A答案A解析2H2O分子中质子数和中子数均为10,20.0 g 2H2O为1 mol,所含质子数和中子数均为10N A,A项正确;戊烷在标准状况下为液体,B项错误;由于部分Cu2+发生水解,故1.0 L 0.1 mol·L-1 Cu(NO3)2溶液中含有的Cu2+数目小于0.1N A,C项错误;题述条件不是标准状况,不能用标准状况下的气体摩尔体积进行计算,D项错误。
3.设N A为阿伏加德罗常数的值,下列叙述不正确的是()A.1 mol Cl2与足量NaOH反应,转移的电子数为N AB.常温常压下,11.2 L甲烷中含有的氢原子数小于2N AC.1 mol碳烯(··CH2)所含电子数目为6N AD.t℃时,1 L pH=6的纯水中含有OH-的个数为10-6N A答案C解析Cl2和NaOH的反应为歧化反应,1 mol Cl2完全反应转移1 mol电子,即转移的电子数为N A,A正确;常温常压下,11.2 L甲烷的物质的量小于0.5 mol,则含有的氢原子个数小于2N A,B正确;1 mol碳烯中含8 mol 电子,即含8N A 个电子,C错误;pH=6的纯水中c(H+)=10-6mol·L-1,而纯水显中性,故纯水中c(OH-)=10-6 mol·L-1,则OH-的物质的量为n=cV=10-6 mol·L-1×1 L =10-6 mol,个数为10-6N A,D正确。

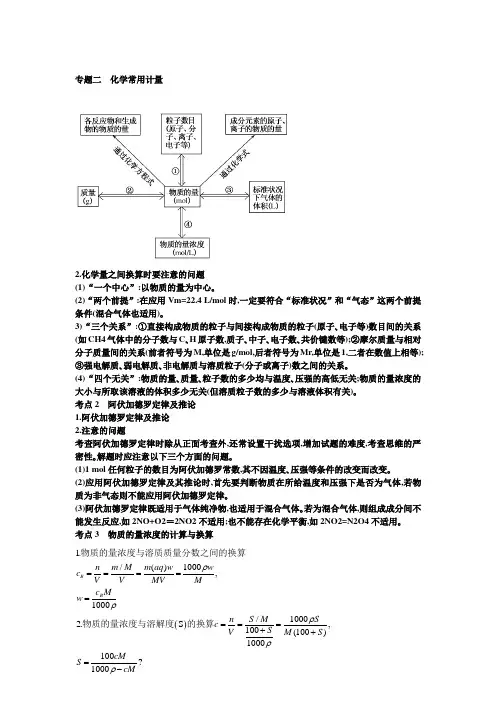
专题二 化学常用计量2.化学量之间换算时要注意的问题(1)“一个中心”:以物质的量为中心。(2)“两个前提”:在应用Vm=22.4 L/mol 时,一定要符合“标准状况”和“气态”这两个前提条件(混合气体也适用)。3)“三个关系”:①直接构成物质的粒子与间接构成物质的粒子(原子、电子等)数目间的关系(如CH4气体中的分子数与C 、H 原子数,质子、中子、电子数、共价键数等);②摩尔质量与相对分子质量间的关系(前者符号为M,单位是g/mol,后者符号为Mr,单位是1,二者在数值上相等);③强电解质、弱电解质、非电解质与溶质粒子(分子或离子)数之间的关系。(4)“四个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与溶液体积有关)。考点2 阿伏加德罗定律及推论1.阿伏加德罗定律及推论2.注意的问题考查阿伏加德罗定律时除从正面考查外,还常设置干扰选项,增加试题的难度,考查思维的严密性。解题时应注意以下三个方面的问题。(1)1 mol 任何粒子的数目为阿伏加德罗常数,其不因温度、压强等条件的改变而改变。(2)应用阿伏加德罗定律及其推论时,首先要判断物质在所给温度和压强下是否为气体,若物质为非气态则不能应用阿伏加德罗定律。(3)阿伏加德罗定律既适用于气体纯净物,也适用于混合气体。若为混合气体,则组成成分间不能发生反应,如2NO+O2=2NO2不适用;也不能存在化学平衡,如2NO2=N2O4不适用。 考点3 物质的量浓度的计算与换算()/()1000,10001/1000,100(100)1000100?1000.2.S B B n m M m aq w w c V V MV M c M w n S M S c S V M S cM S cMρρρρρ========++=-物质的量浓度与溶质质量分数之间的换算物质的量浓度与溶解度的换算5.稀释定律(1)如用V1、V2、c1、c2分别表示稀释前后溶液的体积和物质的量浓度,有:c1V1=c2V2。(2)如用m1、m2、w1、w2分别表示稀释前后溶液的质量和质量分数,有:m1w1=m2w2。 100/22.41000,13.:w 100%4.,,1 L V L,,:10001/22.4224001000()/22.4()10001/22.422400%100%10000S Sn V V c V M V MV m V M w m V M MV MVρρρ+===⨯+⨯+⨯=⨯+⨯=+=⨯⨯=⨯⨯质量分数与溶解度之间的换算饱和溶液中。气体溶质溶于水中制得溶液其物质的量浓度的计算在标准状况下水中溶解某气体所得溶液密度为则溶质溶液%。。

专题02 化学常用计量1.了解相对原子质量、相对分子质量的定义,并能进行有关计算。
2.理解物质的量的含义,并能用于进行简单的化学计算。
3.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积,物质的量浓度、阿伏加德罗常数的含义。
4.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
5.能运用化学方程式和离子方程式进行有关计算。
6.了解溶液的组成。
理解溶液中溶质的质量分数的概念,并能进行有关计算。
7.能根据要求配制一定溶质质量分数、物质的量浓度的溶液。
知识点一、阿伏加德罗常数的应用阿伏加德罗常数的常见考查内容和设错形式:对阿伏加德罗常数的考查往往以选择题的形式,渗透于高中各个知识点中进行考查,试题的知识覆盖面较大,但难度较小,该类试题的特点就是“容易忽视”,即容易落入命题者设置的“陷阱”中,因此明确命题者的考查方向和设错方式有利于我们快速、准确地作出选择。
同时要求同学们在解决该类试题时一定要细心、仔细。
1.考查气体体积与物质的量、微粒数目等关系时,故意忽略标准状况条件或给出常温常压条件。
2.物质状态问题。
考查气体摩尔体积时,常常用标准状况下非气态的物质来迷惑考生,如水、三氧化硫、己烷、三氯甲烷等。
3.结合氧化还原反应考查电子转移的数目问题,特别是歧化反应的电子转移数目,如过氧化钠与水反应、氯气与水的反应等。
4.结合物质结构的有关知识考查物质的微粒数目(如分子、原子、质子、中子、电子等)、化学键数目等。
此处常常涉及的物质有稀有气体(单原子分子)、Na2O2(阴阳离子个数比)、SiO2、Si、P4、CO2(化学键数目)、特殊物质的质量与微粒数间的关系,如D2O、18O2等。
5.考查溶液中离子数目时故意忽视盐类的水解,弱电解质的电离等。
6.结合化学平衡考查时,故意忽视可逆反应不能进行到底的特点。
【特别提醒】阿伏加德罗常数应用题常设的五大“陷阱”。
(1)“标准状况”“常温常压”等外界条件。

专题二化学中常用计量题组一、选择题1. [2023全国甲卷,6分]N A为阿伏加德罗常数的值。
下列叙述正确的是( A )A. 0.50mol异丁烷分子中共价键的数目为6.5N AB. 标准状况下,2.24LSO3中电子的数目为4.00N AC. 1.0LpH=2的H2SO4溶液中H+的数目为0.02N AD. 1.0L1.0mol⋅L−1的Na2CO3溶液中CO32−的数目为1.0N A[解析]异丁烷的结构简式是HC(CH3)3,含13个共价键,故0.50mol异丁烷分子中共价键的数目为13×0.5N A=6.5N A,A正确;标准状况下SO3为固体,不能用标准状况下的气体摩尔体积计算其物质的量,B错误;1.0LpH=2的H2SO4溶液中n(H+)=1.0L×10−2mol⋅L−1=0.01mol,H+的数目为0.01N A,C错误;Na2CO3溶液中CO32−部分水解,故1.0L1.0mol⋅L−1的Na2CO3溶液中CO32−的数目少于1.0N A,D错误。
2. [2023辽宁,3分]我国古代四大发明之一黑火药的爆炸反应为S+2KNO3+ 3C K2S+N2↑+3CO2↑。
设N A为阿伏加德罗常数的值,下列说法正确的是( C )A. 11.2LCO2含π键数目为N AB. 每生成2.8gN2转移电子数目为N AC. 0.1molKNO3晶体中含离子数目为0.2N AD. 1L0.1mol⋅L−1K2S溶液中含S2−数目为0.1N A[解析]CO2的结构式为O C O,1个CO2中含有2个π键,但没有指明CO2所处状况,其物质的量无法计算,所含π键数目也无法计算,A项错误;每生成1molN2转移电子数为12N A,则每生成2.8g(0.1mol)N2,转移电子数为1.2N A,B项错误;0.1molKNO3晶体中含有0.1molK+和0.1molNO3−,所含离子数目为0.2N A,C项正确;S2−会发生水解,故1L0.1mol⋅L−1K2S溶液中S2−数目小于0.1N A,D项错误。


专题整合(二) 化学常用计量[一题串知·迁移练][高考载体·2017天津高考T 9改编]用沉淀滴定法快速测定NaI 等碘化物溶液中c (I -),实验过程包括准备标准溶液和滴定待测溶液。
准备标准溶液a.准确称取AgNO 3基准物4.246 8 g (0.025 0 mol )后,配制成250 mL 标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L -1NH 4SCN 标准溶液,备用。
[串知设计](1)所标定的NH 4SCN 溶液中,含有NH +4的数目是 (用N A 表示,不考虑NH +4的水解)。
[考查有关N A 的相关计算](2)所配AgNO 3标准溶液的物质的量浓度是______。
[考查物质的量浓度的计算](3)将称得的AgNO 3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还需________________________________________________________________________;若在配制过程中,烧杯中的溶液有少量溅出,则所配制溶液的浓度将________。
[考查一定物质的量浓度溶液的配制](4)若NH 4SCN 溶液中的NH +4全部转化为NH 3,则在标准状况下,NH 3的体积是 ________L 。
[考查气体摩尔体积的计算][保分题目·综合练]1.标准状况下,5.6 L O 2中含有N 个氧原子,则阿伏加德罗常数的值为( ) A .4N B.N4C .2ND.N 22.下列溶液中,与100 mL 0.5 mol·L -1 NaCl 溶液中所含的Cl -物质的量浓度相同的是( )A .100 mL 0.5 mol·L -1MgCl 2溶液 B .200 mL 0.25 mol·L -1AlCl 3溶液 C .50 mL 1 mol·L -1NaCl 溶液 D .25 mL 0.5 mol·L -1HCl 溶液 3.下列有关操作或判断正确的是( )A .配制一定物质的量浓度的溶液,定容时仰视刻度线会导致所配溶液浓度偏高B .用托盘天平称取25.21 g NaClC .用100 mL 的量筒量取5.2 mL 的盐酸D .用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高4.N A 代表阿伏加德罗常数的值。
专题2 常用化学计量1、(2015·江苏省南京市、盐城市一模)设NA为阿伏加德罗常数的值。
下列说法正确的是A.标准状况下,22.4L己烷中含己烷分子数目为NAB.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NAC.71gNa2SO4固体中含钠离子数目为NAD.25g质量分数68%的H2O2水溶液中含氧原子数目为NA解析:己烷常温下是液体,不适合气体摩尔体积,A项错误;乙烯和丙烯混合气体的摩尔质量大于28g·mol-1,28g乙烯和丙烯的混合气体所含碳碳双键的物质的量小于1mol,B项错误;71gNa2SO4的物质的量为0.5mol,故含Na+的物质的量为1mol,C项正确;25g质量分数68%的H2O2物质的量为0.5mol,H2O2的所含的氧原子数目是NA,溶液中溶剂水也含有氧原子,D项错误。
答案:C2、(2015·广东省茂名市一模)设nA为阿伏加德罗常数的数值,下列说法正确的是A. 常温下,78g的苯含有3nA个C C双键B. 1L 0.1 mol·L-1的NH4Cl溶液中有0.1nA个NH4+C. 标准状况下,22.4 L SO2与CO2混合物含有2nA个O原子D. 常温下,5.6 g铁块投入足量浓硝酸中失去0.3nA个电子答案:C解析:苯分子中不存在碳碳双键,A项错误;1L 0.1 mol·L-1的NH4Cl溶液中NH4+水解,NH4+的个数小于nA,B项错误;标准状况下22.4LSO2和CO2的物质的量为1mol,SO2和CO2的均含有两个氧原子,C项正确;常温下硝酸会使铁钝化,阻止反应的进行,D 项错误。
3.(2015重庆市七校期末)设NA表示阿伏加德罗常数,下列说法正确的是A.标准状况下,22.4 L水所含电子数约为10 NAB.25℃时,pH=13的1 L Ca(OH)2溶液中含有OH-数目约为0.2 NAC.0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NAD.常温常压下,3.2 g O2和O3混合气体含有0.2 NA个氧原子【答案】D【解析】标况下,H2O 为液体,物质的量不为1mol,A错误;pH=13的1 L Ca(OH)2溶液中含有OH-数目约为0.1 NA,B错误;NH4HSO4晶体中无H+存在,C错误;3.2 g O2和O3混合气体含有氧原子为3.2g/16g·mol-1=0.2mol,含有0.2 NA个氧原子,D正确。
专题二化学常用计量考点一阿伏加德罗常数的应用练习1. 设N A为阿伏加德罗常数的值。
下列叙述正确的是( ) A.1 mol甲醇中含有C-H键的数目为4N AB.25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1N AC.标准状况下,2.24 L己烷含有分子的数目为0.1N AD.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4N A练习2. 设N A是阿伏加德罗常数的数值,下列说法正确的是( )A.1 mol Al3+离子含有的核外电子数为3N AB.1 mol Cl2与足量的铁反应,转移的电子数为3N A C.10 L pH=1的硫酸溶液中含有的H+离子数为2N AD.10 L pH=13的NaOH溶液中含有的OH-离子数为N A练习3. 用N A表示阿伏加德罗常数的值。
下列说法正确的是( )A.1.8 g重水(D2O)中含有的质子数为N AB.500 ℃、30 MPa下:N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1,将1.5N A个H2和过量N2在此条件下充分反应,放出热量为19.3 kJC.标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5N A D.0.1 mol·L-1氯化铝溶液中含有Al3+数为0.1N A练习4. 设N A为阿伏加德罗常数的值,下列叙述正确的是( )A. 18 g D2O所含的电子数为 10N AB. 1 L 1 mol/L饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶粒N A个C. 1 mol Na2O2固体中含离子总数为 4N AD. 常温常压下,3.2 g O3所含的原子数为 0.2N A练习5. 用N A表示阿伏加德罗常数的值。
下列说法正确的是( )A. 2.24 L CO2中含有的原子数为0.3N AB.46 g NO2和N2O4的混合物含有的原子数为3N AC. 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2N AD. 1.0 L 1.0 mol/L CH3COOH溶液中,CH3COOH分子数为N A小结:考点二以物质的量为核心的有关计算练习6.图2-1是某学校实验室从化学试剂商店买回来的硫酸试剂标签上的部分内容。
专题二常用化学计量专题二常用化学计量――物质的量[最新考纲]1.了解物质的量的单位――摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
2.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.了解溶液的含义,了解溶解度、饱和溶液的概念。
4.了解溶液的组成;理解溶液中溶质的质量分数的概念,并能进行有关计算。
5.了解配制一定溶质质量分数、物质的量浓度溶液的方法。
自查1.物质的量与摩尔、阿伏加德罗常数的关系物质的量表示含有一定数目微观粒子的集合体的物理量,用n表示,其单位是摩尔(符号为mol),每摩尔物质含有阿伏加德罗常数个微粒,国际规定,0.012 kg12C中所含有的碳原子数(即NA=6.02×1023mol1)称为阿伏加德罗常数。
-2.摩尔质量摩尔质量是指单位物质的量的物质所具有的质量,其单位是g・mol-1或kg・mol1。
摩尔质-量与所表示微粒的相对分子质量(或相对原子质量)之间的关系是数值相同单位不同。
3.气体摩尔体积气体摩尔体积指的是一定温度、压强下,单位物质的量的气体所占的体积,符号为Vm,其单位为L・mol1。
在标准状况下Vm=22.4_L・mol1。
--4.阿伏加德罗定律在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子数。
5.一定物质的量浓度溶液的配制(1)仪器:容量瓶(规格有50_mL、100_mL、250_mL、500_mL、1_000_mL)、托盘天平(或量筒)、烧杯、玻璃棒、胶头滴管、药匙等。
(2)步骤:计算→称量(或量取)→溶解→冷却→移液→洗涤→定容→摇匀。
自悟1.阿伏加德罗常数的研究对象是什么?它通过什么与宏观的量联系?提示阿伏加德罗常数的研究对象是微观粒子:分子、原子、离子、质子、中子、电子、共用电子对(共价键)等。
它们都要通过物质的量n与宏观量(质量、体积等)联系起来。
专题二化学常用计量
1.(2012·高考课标全国卷)用N A表示阿伏加德罗常数的值.下列叙述中不正确的是()
A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N A
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2N A
C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6N A
D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A
2.(2012·高考山东卷)下列与含氯化合物有关的说法正确的是()
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移N A个电子(N A表示阿伏加德罗常数)
3.(2012·高考广东卷)设n A为阿伏加德罗常数的数值,下列说法正确的是()
A.常温下,4 g CH4含有n A个C—H共价键
B.1 mol Fe与足量的稀HNO3反应,转移2n A个电子
C.1 L 0.1 mol·L-1NaHCO3溶液中含有0.1n A个HCO-3
D.常温常压下,22.4 L的NO2和CO2混合气体含有2n A个O原子
4.(2012·高考江苏卷)设N A表示阿伏加德罗常数的值.下列说法正确的是()
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1N A
B.常温常压下,18 g H2O中含有的原子总数为3N A
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5N A
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1N A
5.(2012·高考福建卷)下列说法正确的是()
A.0.5 mol O3与11.2 L O2所含的分子数一定相等
B.25 ℃与60 ℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等
D.2SO2(g)+O2(g)2SO3(g)和4SO2(g)+2O2(g)4SO3(g)的ΔH相等
6.(2012·高考四川卷)设N A为阿伏加德罗常数的值,下列叙述正确的是()
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5N A
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为N A
C.50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46N A
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6N A
专题二化学常用计量
1.【解析】选D.A项:NO2和CO2中都含相同数目的氧原子,故N A个NO2和CO2混合气体中含有的氧原子数为2N A.
B项:乙烯和环丁烷的最简式为CH2,所以28 g乙烯和环丁烷的混合气体中含有碳原子
的物质的量为28 g
14 g/mol
=2 mol,碳原子数目为2N A.
C项:等质量的NO2与N2O4所含原子数目相等,则92 g混合气体所含原子数目为:
92 g
×3=6 mol,数目为6N A.
46 g/mol
D项:当应用V m=22.4 L/mol时,应指明气体所在的状况为标准状况,而题目所给状况为常温常压,故不能应用V m=22.4 L/mol.
2.【解析】选B.NaClO属于盐为强电解质,A项错误;加热可促进Fe3+的水解,所以向沸水中滴入饱和氯化铁溶液可制得氢氧化铁胶体,B项正确;HCl属于共价化合物,C项错误;电解氯化钠溶液时,H+在阴极上的电极反应为2H++2e-====H2↑,生成1 mol氢气转移2N A个电子,D项错误.
3.【解析】选A.A项,1 mol CH4中含4 mol C—H键,4 g CH4的物质的量为0.25 mol,含C—H键的物质的量为0.25 mol×4=1 mol,共n A个,故A正确.B项,HNO3过量时,铁被氧化为+3价,1 mol Fe转移3n A个电子,B项错误;C项,HCO-3在水溶液中既发生电离又发生水解,以水解为主,故c(HCO-3)<0.1 mol/L,HCO-3的个数小于0.1n A,C项错误;D项,气体所处的状态不是标准状况,故D错误.
4.【解析】选B.A项,由于Cl2溶于水存在平衡体系Cl2+H2O HCl+HClO,0.1 mol Cl2不可能全部与H2O反应,因此转移的电子数目无法计算.B项,18 g水为1 mol,含有3N A 个原子,B项正确.C项,标准状况下CH3CH2OH为液态,D项气体不是在标准状况下,故
C、D两选项均错误.
5.【解析】选C.A项中没有标明标准状况,11.2 L O2不一定是0.5 mol O2,故错误;不同温度下,水的电离程度不同,水中c(H+)不同,pH不同,B项错;等体积等浓度的盐酸和醋酸所含溶质的物质的量相等,所消耗的n(NaOH)相等,C项正确;D项ΔH与化学计量数有关,D项错误.
6.【解析】选B.标准状况下HF为液态,33.6 L不是1.5 mol,故A项错误.乙烯、丙烯的混合物分子通式为(CH2)n,
7.0 g烯烃混合物中CH2原子团为0.5 mol,故氢原子数目为N A,B项正确.C项中只有浓H2SO4才与Cu加热反应,当反应一段时间浓H2SO4变稀后与Cu的反应停止,SO2的分子数目一定小于0.46N A,故C项错误.0.1 mol N2与0.3 mol H2在容器中存在化学平衡,故转移电子数目一定小于0.6N A,D项错误.。