专题一 第2讲 化学常用计量
- 格式:ppt
- 大小:3.73 MB
- 文档页数:49

第02讲1.能表示阿伏加德罗常数的数值的是A.1 mol金属钠含有的电子数B.标准状况下,22.4 L苯所含的分子数C.0.012 kg12C所含的原子数D.1 L 1 mol/L的硫酸溶液中所含的H+【解析】A中1mol金属钠含有11mol电子,B中标准状况下,苯为液态,22.4L苯的物质的量超过1mol,C中所述为阿伏加德罗常数的定义,D中1L1mol/L的硫酸溶液含2mol H+。
2.若N A表示阿伏加德罗常数,下列叙述不正确的A. 48 g O3气体含有N A个O3分子B. 常温常压下,4.6 g NO2气体含有0.1N A个原子C. 20 g D2O中含有的质子数目为10 N AD. 16 g CH4与18 g NH4+所含电子数相等【解析】A中48g O3气体其物质的量为1mol,B中4.6g NO2气体的物质的量为0.1mol,含原子数为0.3NA ,C中20g D2O的物质的量为1mol,每个D2O分子含有10个质子,所以20g D2O中含有的质子数目为10N A,D中16g CH4与18g NH4+都是1mol,且都是10电子微粒,故电子数相等。
3.下列说法不正确的是A.1 mol Cl 2作为氧化剂得到2×6.02×1023个电子B.4.5 g SiO 2晶体中含有的硅氧键数目为0.3×6.02×1023C.14 g 氮气中含有7×6.02×1023个电子D.5.6 g 铁粉与硝酸反应失去的电子数一定0.3×6.02×1023【解析】A 中Cl 2作为氧化剂,化合价降到−1,每个Cl 2分子得2个电子;B 中每个硅原子形成4个Si —O 键,4.5g SiO 2晶体中含有的硅氧键数目为×4×6.02×1023=0.3×6.2×1023;C 中每个N 2分子含有14个电子,14g 氮气的物质的量是0.5mol ;D 中铁粉与硝酸反应视硝酸的量的多少,可能生成+3价铁盐也可能生成+2价铁盐。



专题一基本概念第2讲化学常用计量1.设N A表示阿伏加德罗常数的数值,下列说法正确的是()(导学号58870008)A.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2N AB.50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3N AC.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2N AD.标准状况下,20 g D2O分子中所含中子数为10N A解析:A.在常温常压下气体摩尔体积大于22.4 L/mol,所以不能使用标准状况下的气体摩尔体积计算,错误;B.只有浓盐酸与MnO2混合加热发生反应产生Cl2,当反应进行到一定程度后,溶液变为稀盐酸,反应就不再发生,所以50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数小于0.3N A,错误;C.氢氧燃料电池正极是O2获得电子,若消耗标准状况22.4 L气体时,电路中通过的电子数目为4N A,错误;D.标准状况下,20 g D2O的物质的量是1 mol,由于一个分子中含有10个中子,则1 mol分子中所含中子数为10N A,正确。
答案:D2.(2015·课标全国Ⅰ卷)N A为阿伏加德罗常数的值。
下列说法正确的是( )(导学号 58870009)A .18 g D 2O 和18 g H 2O 中含有的质子数均为10N AB .2 L 0.5 mol/L 亚硫酸溶液中含有的H +数为2N AC .过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2N AD .密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A解析:A.D 和H 的质量数不同,则18 g D 2O 和18 g H 2O 的物质的量不同,所以含有的质子数不同,错误;B.亚硫酸为弱酸,水溶液中不完全电离,所以溶液中氢离子数目小于2N A ,错误;C.过氧化钠与水反应生成氧气,则氧气来源于-1价的O 元素,所以生成0.1 mol 氧气时转移电子0.2N A ,正确;D.NO 与氧气反应生成二氧化氮,但常温下,二氧化氮与四氧化二氮之间存在平衡,所以产物的分子数小于2N A ,错误,答案选C 。




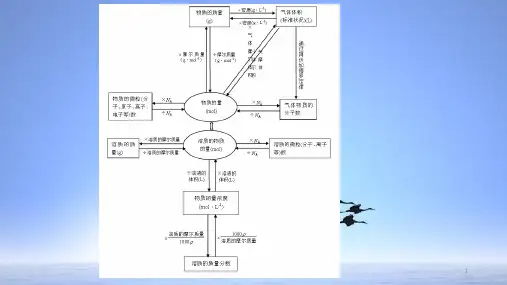

第2讲化学常用计量知考点明方向满怀信心正能量设问方式①有关阿伏加德罗常数的综合判断[例](2018·全国卷Ⅰ,10),(2018·全国卷Ⅱ,10),(2017·全国卷Ⅲ,10),(2017·海南卷,7)②以“物质的量”为核心的多角度计算[例](2018·全国卷Ⅲ,8)③一定物质的量浓度溶液的配制[例](2018·全国卷Ⅱ,11)知识点网络线引领复习曙光现释疑难研热点建模思维站高端考点一阿伏加德罗常数的应用▼ 命题规律:1.题型:正误判断型选择题2.考向:以选择题的形式考查一定量的物质所含粒子(分子、原子、离子、质子、中子等)数目、氧化还原转移电子的数目、一定量的物质所含某种化学键的数目等。
▼ 方法点拨:1.关于阿伏加德罗常数试题常设的“陷阱”(1)气体摩尔体积的运用条件陷阱:考查气体时经常给定非标准状况下(如25 ℃、1.01×105 Pa)气体体积,考生易用22.4 L·mol-1进行换算,误入陷阱。
(2)物质的聚集状态陷阱:22.4 L·mol-1适用对象是标准状况下的气体。
命题者常用在标准状况下非气态的物质来迷惑考生,如H 2O 、CCl 4、辛烷、汽油、SO 3、C 6H 6等。
(3)单质的组成陷阱:气体单质的组成除常见的双原子分子外,还有单原子分子(如He 、Ne 等)、三原子分子(如O 3)等。
(4)某些氧化还原反应中电子转移的数目陷阱:命题者常用一些反应中转移电子的数目来迷惑考生,如Na 2O 2与H 2O 反应、Cl 2与NaOH 溶液反应、Fe 与HCl 反应、HNO 3与过量Fe 反应、电解CuSO 4溶液等。
(5)物质的组成、结构陷阱:如Na 2O 2是由Na +和O 2-2构成,而不是Na +和O 2-;NaCl 为离子化合物,只有离子没有分子;苯中不含碳碳单键和碳碳双键。
(6)电离、水解对溶液中离子数目的影响陷阱:考查电解质溶液中离子数目或浓度时常设置弱电解质的电离、盐类水解方面的陷阱。