肝门部胆管癌诊断治疗指南-2013.08.19-55
- 格式:doc
- 大小:125.00 KB
- 文档页数:13

肝门胆管癌概述:肝门部胆管癌(hilarcholangiocarcinoma,HCCA)也称Klatskin瘤,是胆道系统常见的恶性肿瘤,由于肝门部特殊的解剖结构和肿瘤早期侵犯周围血管、神经、淋巴组织及邻近肝组织的特点,获得早期诊断少,手术切除率低,预后差。
肝门部胆管癌,是指原发于胆囊管开口以上肝总管与左、右二级肝管起始部之间,主要侵犯肝总管、肝总管分叉部和左、右肝管的胆管癌。
占胆管癌的58%-75%,是各类胆管癌中最常见、处理最困难和预后最差的肿瘤。
HCCA男女比例为1.5-3.0:1,好发于50-60岁以上的中老年,具有一定的地理和种族分布差异,美国1.0/10万,以色列7.3/l0万,美洲印第安人6.5/l0万,日本为5.5/10万,亚洲发病率较局。
HCCA引起的阻塞性黄疽是肝外恶性阻塞性黄疽中最多见的一种,其肿瘤一般较小,常呈硬性肿物或弥漫浸润,多发生于左、右肝管或其汇合部,原发于一侧肝管者可随着肿瘤进展,而向对侧肝管或汇合处浸润生长,因胆道内腔狭小,肿瘤很小即可引起胆道梗阻,而且该部位结构复杂,位置深在,起病隐匿,手术困难,预后差。
当患者以进行性、无痛性黄疽就诊时,往往病情已经到晚期,失去外科手术根治切除的机会;多数进行姑息性的胆肠吻合手术,而况置肿瘤,难以得到病理诊断;或影像学检查发现了胆管梗阻,但难以明确病因;尽管介入放射学的胆道疏通、胆道扩张、胆道内支架或/和胆道引流术使肝门部胆管癌的治疗取得很大进展,但治疗的规范性和疗效的极大差别不容忽视,有必要对肝门部胆管癌的临床早期诊断、简单合理的介入治疗方法和理想的疗效进行研究,以期早期发现和确诊肿瘤,恰当治疗并取得最佳疗效。
病因:有关HCCA的发病原因或危险因素尚不清楚,可能与胆道慢性炎症有关,如原发性硬化性胆管炎、胆总管囊肿、胆管结石、胆道良胜肿瘤、胆道寄生虫病、丙型肝炎、胰胆管合流异常、先天性胆管囊性扩张症、慢性溃疡性结肠炎等均可增加发生胆道癌肿的危险。



肝门部胆管癌是指原发于胆囊管开口以上肝总管与左右二级肝管起始部之间主要侵犯肝总管肝总管分叉部和左右肝管的胆管癌发病原因:有关HCCA的发病原因或危险因素尚不清楚可能与胆道慢性炎症有关如原发性硬化性胆管炎胆总管囊肿胆管结石胆道良胜肿瘤胆道寄生虫病丙型肝炎胰胆管合流异常先天性胆管囊性扩张症慢性溃疡性结肠炎等均可增加发生胆道癌肿的危险生理病理:胆管癌分期按照国际抗癌协会(UICC)提出TNM分期标准可把胆管癌分为~Ⅳ期:期原位癌无淋巴结或远处转移Ⅰ期肿瘤侵及粘膜或肌层无淋巴结或远处转移Ⅱ期肿瘤侵及肌层周围结缔组织无淋巴结或远处转移Ⅲ期在上述情况下伴有淋巴结转移Ⅳa期肿瘤侵犯邻近组织如肝胰十二指肠胆囊胃结肠有或无淋巴结转移无远处转移Ⅳb期无论肿瘤大小有无淋巴结转移有远处转移Bismuth分型:年法国的Bismuth-Corette对肝门部胆管癌进行的分型现已被广泛使用Ⅰ型肿瘤位于肝总管未侵犯汇合部Ⅱ型肿瘤侵犯肝总管及左右肝管汇合部Ⅲ型肿瘤侵犯肝总管左右肝管汇合部并已侵犯右肝管(Ⅲa)或左肝管(Ⅲb)Ⅳ型肿瘤侵犯肝总管左右肝管汇合部并同时侵犯左右肝管病理组织学分型:大体上分为型()乳头型:表现为管内多发病灶向表面生长形成大小不等的乳头状结构排列整齐癌细胞间可有正常组织()硬化型:质硬的灰白色环状增厚并引起大量纤维组织增生向外周浸润累及肝门血管或方叶()结节型:管腔内结节状肿瘤质地韧常位于胆管一侧()浸润型:沿胆管壁广泛浸润管壁增厚管腔狭窄管周结缔组织明显炎症反应与硬化性胆管炎不易区别在组织学上又分为六型:()乳头状腺癌;()高分化腺癌;()低分化腺癌;()未分化癌;()印戒细胞癌;()鳞状细胞癌传统的临床病理学描述将其定义为:肝管分叉处体积小高分化生长缓慢的肿瘤但近年来研究的观点认为并非如此低中分化腺癌可占一半左右其原因可能是早期肝门部胆管癌手术切除率较低而能行切除者均为分化程度较高的病人因为肿瘤组织分化程度与其周围浸润程度和转移率呈反比因此低分化者由于未能切除而被忽略了病理生理:胆管梗阻后由于胆汁及其诸多成分不能流入肠道内(尤其是完全性梗阻者)将导致胆管内压升高肝血流改变以及一系列包括体内生物化学免疫功能肝肾功能及代谢等的变化其特点与程度主要取决于胆管梗阻的部位完全性期限以及是否合并感染肝细胞凋亡随胆道梗阻时间延长而增加而肝脏损害及肝功能受损亦随梗阻时间延长而加重细胞凋亡与其正相关梗阻性黄疽由胆汁流出受阻引起是肝细胞受损的主要原因最终常导致肝硬化肝功能衰竭和死亡胆汁酸盐在肝内蓄积诱发肝细胞和胆管细胞凋亡过多的细胞凋亡又造成抗凋亡异常从而造成肝纤维化的异常增生这是构成肝损害的另一个主要原因随着胆道梗阻时胆道内压力增加出现胆汁逆流使肝血窦压力明显增高并导致门静脉压力的增高和肝动脉阻力的增高使入肝血流量减少致肝细胞相对性缺血缺氧肝脏病理改变加重同时因胆汁酸盐不能经胆道排入肠道不能发挥胆盐对肠道细菌的抑菌作用致肠道内毒素繁殖加速菌群失调Gˉ细菌明显增多内毒素产生增加;此时肠粘膜屏障受损内毒素和细菌经门静脉移位入肝肝内Kupffer细胞功能受损对内毒素的清除能力下降上述原因共同作用导致肝细胞超微结构发生改变核形态异常固缩线粒体肿胀晴消失断裂胆小管内有均质物质贮脂细胞内质网减少和Kupffer细胞增多肿胀另外梗阻性黄疽时存在着全身免疫功能下降尤以细胞免疫功能降低显著肿瘤引起的胆道狭窄和梗阻致使胆红素和胆汁酸等返流入血产生高胆红素血症和胆汁酸血症研究表明胆管梗阻周内毒素血症尚不明显时心肌肝脏和肾脏细胞均有线粒体肿胀变形靖消失等梗阻周时尚有肌丝紊乱此时血胆汁酸浓度明显升高管饲胆酸钠使胆汁酸浓度达到胆道梗阻周的平均浓度心肌有类似的超微结构改变这提示梗阻性黄疽时胆汁酸淤积会损害心肌等脏器或组织超微结构临床分型:高位胆管癌临床分型目前广为引用的是法国Bismuth-Corlett分型方法:Ⅰ型肿瘤位于肝总管分叉处左右肝管之间相通;Ⅱ型肿瘤占据左右肝管汇合部两者之间无通道;Ⅲ型肿瘤侵犯一侧肝管累及右肝管者为Ⅲa型累及左肝管者为Ⅲb型;Ⅳ型肿瘤双侧肝管均受累临床上根据癌肿对肝动脉和门静脉的侵犯可将胆管癌的病程分为期Ⅰ期:肿瘤限于胆管无门静脉及肝动脉侵犯;Ⅱ期:肿瘤累及单侧的门静脉及肝动脉;Ⅲa期:肿瘤累及一侧肝动脉及门静脉的分叉部;Ⅲb期:肿瘤累及一侧门静脉及肝固有动脉;Ⅳ期:肿瘤累及肝固有动脉及门静脉的分叉部临床表现:肝门胆管癌好发于~岁的中老年人岁左右最多为老年性疾病肝门胆管癌由于位置特殊在胆管未被肿瘤完全阻塞前常无特异临床表现不易引起病人及外科医生的重视HCCA早期临床症状多为纳差食欲下降厌油腻消化不良以及上腹胀闷不适等非特异症状部分病人可反复出现胆管感染随着病变的进展可出现阻塞性黄疽的症状和体征但最使病人注意的是进行性黄疽皮肤搔痒症和体重下降这也是HCCA特征性的临床征象.黄疸胆管癌患者早期缺乏典型症状大部分病人多因黄疸而就诊黄疸是胆管癌最早也是最重要的症状约有%~%的胆管癌病人都有不同程度的皮肤巩膜黄染黄疸的特点是进行性加重且多属无痛性少数病人黄疸呈波动性上段胆管癌黄疸出现较早中下段胆管癌因有胆囊的缓冲黄疸可较晚出现但实际上在黄疽出现之前患者常有一段时间的上腹部饱胀不适厌油腻食欲减退体重下降等非特异性的“胃病”症状常因症状不典型而被误诊为“慢性胃炎”“慢性胆囊炎”等有的患者即使出现了黄疽症状仍易于被误诊为“黄疽型肝炎”.腹痛半数左右的患者有右上腹痛胀痛或不适体重减轻食欲不振等症状这些症状常被视为胆管癌早期预警症状腹痛一开始有类似胆石症胆囊炎的疼痛据临床观察胆管癌发病仅个月便可出现腹痛和黄疸.皮肤瘙痒可出现在黄疸出现的前或后也可伴随有其他症状如心动过速出血倾向精神萎顿乏力和脂肪泻腹胀等皮肤瘙痒是因血液中胆红素含量增高刺激皮肤末稍神经而致.其他伴随着黄疸腹痛等症状还会有恶心呕吐消瘦尿色深黄如酱油或浓茶样大便色浅黄甚至陶土色等晚期肿瘤溃破时出现胆道出血时可有黑便大便隐血试验阳性甚者可出现贫血;若有肝转移时可出现肝脏肿大肝硬化等症象临床症状与临床分型的关系:研究HCCA的临床症状与临床分型的关系对该病的早期诊断具有重要意义从肝门部胆管系统的解剖而言右肝管较短几乎接近垂直位;左肝管细长几近于横位成人右肝管平均长mm管径mm;左肝管平均长mm管径mm由于右肝管短粗且与肝总管约成°角故胆汁引流比较通畅;而左侧肝管与肝总管约成°角故胆汁引流可能比较缓慢出现肝管狭窄更易于出现引流不畅引起的胆管扩张表现黄疽之前的上腹部非特异性症状持续时间长短则视胆管癌距离胆管分叉部远近而异来源于肝门处左侧肝管的癌开始时距离肝管分叉尚有一段距离故黄疽前症状持续时间较长临床上不少患者黄疽持续的时间可能甚短但经影像学检查或手术探查时却发现肿瘤已向肝门部转移并侵犯主要血管这种情况多见于Ⅲ型和Ⅳ型的病变因肿瘤开始时发生在左侧或右侧的肝管内健侧充分代偿分泌胆汁的能力故临床上并不出现黄疽随着时间的推移黄疽的出现可能由于癌组织沿胆管扩展侵犯对侧肝管或阻塞肝总管亦可能由于癌细胞转移至肝十二指肠韧带压迫肝外胆管或肝门部的转移侵犯肝总管而致黄疽IⅡ型肝门部胆管癌的早期临床症状即早期出现梗阻性黄疽;ⅢIV V型者则有不同的临床表现特别值得注意的是起始于一侧肝管的癌早期并无黄疽待黄疽出现时已经向胆管外侵犯和转移病变以达晚期另外HCCA中%-%为硬化型其生物学特征为早期沿胆管壁向周围组织浸润对于IⅡ型肝门部胆管癌其梗阻性黄疽也并不一定是HCCA的早期症状诊断:肝门部胆管癌的经典诊断模式为:黄疸+肝内胆管扩张+肝外胆管口径正常+胆囊空虚+肝门部占位病变诊断并不困难但多已属中晚期若能在黄疸出现之前得以确诊对提高切除治愈率具有积极意义一影像学检查:B型超声扫描以无创伤可重复简单经济而成为梗阻性黄疸的首选检查方法其优点是:①可显示肝内胆管扩张肝外胆管和胆囊空虚;②扩张胆管远侧的管腔突然截断闭塞并可发现中等或低回声的团块影;③可以明确肿瘤的部位及浸润范围;肿瘤与肝动脉和门静脉的关系以及门静脉有无癌栓;④同时还可了解肝内有无转移及肝外淋巴结的转移情况B超的不足之处是可受肥胖肋弓遮盖肠道气体以及操作者本身等因素影响CT扫描的图像比较清晰不受肥胖肠道气体和操作者的主观因素影响CT能客观地显示肿瘤的部位和大小肿瘤与周围组织的关系;显示肝叶的形态改变(肥大或萎缩)肿瘤与尾叶的关系;扩张的左右肝管间连续性中断能提供准确的梗阻水平及肝内胆管扩张征象增强扫描可使组织结构为清晰螺旋CT可以获得人体解剖结构无间断的图像信息将这种特殊的图像采集方法和静脉注射造影剂相结合用种图像处理方法显示血管影像因此螺旋CT可以代替血管造影显示门静脉系统结构了解门静脉系统的受累情况磁共振胆管成像(MRCP)与超声及CT比较有明显的优势①具有非侵入性无创性无放射性无需对比病人易接受;②可以清楚的显示整胆管的情况对临床分期和术前评估更准确;③安全无并发症;④不能行经内镜逆行胰胆管造影(ERCP)检查或ERCP检查失败者可行MRCP 检查;⑤可以指导经皮经肝穿刺胆道引流(PTCD)和胆管内支架放置的位置肝门部胆管癌MRCP主要表现为肝总管左右肝管起始部胆管壁不规则增厚狭窄中断或腔内充盈缺损;肝门软组织肿块向腔内或腔外生长边界欠清晰T加权呈相对低信号T加权呈相对高信号;肿瘤上方肝管呈软藤状扩张肿瘤下方胆总管正常并可显示胆囊管和胰管情况如有肝门部淋巴结转移CT和MRI表现为肝门部肿块而MRCP表现为左右肝管受压变窄或被破坏如有肝内转移可见散在低信号影经皮经肝穿刺胆道造影(PTC)能详尽显示肝内胆管形态直接显示并明确肿瘤的部位肿瘤累及肝管的范围肿瘤与肝管汇合部的关系但它是一种侵袭性检查有引起出血胆漏胆道感染和气胸的可能其并发症发生率为%~%同时PTC只能显示梗阻上方扩张的胆道对Ⅳ型肝门部胆管癌必须分别行左右叶穿刺造影方能全面显示扩张的胆管及梗阻部位而且这更加大了并发症的风险并且放置PTCD减少黄疸也是有争议的措施还有经此管引起癌转移的风险经内镜逆行胰胆管造影(ERCP)能显示肿瘤的下界及梗阻以下的胆道情况如同时行PTC和ERCP则可以相互补充完整地显示肿瘤上下缘对判断肿瘤大小范围和决定手术方案具有重要意义有B超CT MRI和MRCP都不能比拟的准确和清晰显像是可靠实用的检查方法ERCP最致命的并发症是造影可引起上行性感染诱发急性胆管炎感染中毒性休克或多发性肝脓肿给治疗带来困难甚至失去手术的时机随着CT MRI MRCP和超声技术的发展及普及现在已基本不用PTC或PTCD ERCP也因其致命的并发症很少被使用.数字减影血管造影(DSA)显示肝门部入肝血管与肿瘤的关系及受肿瘤侵犯的情况DSA诊断胆管癌动脉相主要表现为周围动脉受侵犯一般为肝左右动脉或肝固有动脉管壁不规则狭窄或梗阻部分病例可见微细肿瘤血管出现在受侵犯动脉周围;在毛细血管相可出现肿瘤染色门静脉及其分支受侵时静脉相显影不良二肿瘤标志物:.CA-在无胆管炎的情况下肝门部胆管癌患者血清CA-值> kU/L者达%(/)> kU/L(正常值的倍)者亦达%(/)CA-值的显著增高有助于肝门部胆管癌的诊断.胆管癌相关抗原检测胆管癌相关抗原(Cholangiocarcinoma-related antigen CCRA)是近年来从人胆管癌组织中发现的一种新的抗原物质正常人血清中CCRA<g/L胆管癌时血清CCRA浓度明显升高CCRA与碳水化合物抗原(尤其CA-)在胆管癌中阳性率相似但CCRA在其他消化道肿瘤中阳性率却很低这点对于胆管癌的诊断和鉴别诊断具有很重要的价值三细胞学检查:通过PTC或ERCP技术获取胆汁行脱落细胞检查诊断的特异性高但敏感性低原因可能是细胞在胆汁中变性溶解或肿瘤被增生的结缔组织包埋为提高诊断敏感性Mo-handas()等使用扩张器扩张胆管狭窄处后再取胆汁结果阳性率从%提高到%可能是狭窄段胆管扩张后脱落游离的癌细胞更易进入胆汁行PTC或ERCP检查发现胆管狭窄怀疑有癌变时可置入细胞刷反复刷取胆管狭窄处获取标本后行细胞学检查或通过胰十二指肠镜钳取病变组织活检这两种方法诊断特异性高几乎可达%治疗:目前治疗肝门部胆管癌的方法繁多有手术切除化疗放疗免疫治疗生物治疗中草药治疗和介入治疗但最有效的方法仍为手术切除根治性切除术随着影像学诊断技术的发展和手术技术的进步及治疗态度的转变该病的手术切除率有明显的提高年以前该病的手术切除率仅占%而目前手术切除率可达.%肝门部胆管癌只有彻底手术切除才能给患者提供唯一可能治愈的机会且其改善患者生活质量的作用远优于各种引流术因此对于肝门部胆管癌的治疗应采取积极的手术态度力争切除肿瘤根治性切除手术包括肝外胆道切除肝十二指肠韧带上血管“骨骼化”广泛切除十二指肠韧带上的纤维脂肪组织神经淋巴必要时切除一侧肝叶重建肝管空肠吻合肝门部胆管癌多有尾状叶浸润侵犯汇合部或左右肝管者均须切除尾状叶并被认为是否合并尾状叶切除是影响肝门部胆管癌患者长期生存的主要相关因素之一Nagino等主张肝段切除+尾叶切除进行治疗报道例其行肿瘤切除例其中例合并肝段及尾叶切除合并门静脉切除例并肝胰十二指肠切除例;其住院病死率为%(例)治愈切除例年存活率为%;年存活率为%认为在正确估计侵犯程度的基础上积极行肝切除可改善预后.姑息性手术.左侧肝内胆管空肠吻合术一般在镰状韧带左侧找到扩张的左外叶胆管与空肠吻合该方法手术相对简单但一般只能引流左半肝我院大部分不能手术切除的肝门部胆管癌用该方法或同时加用U型管引流通过U管侧孔内引流使全肝胆道起到引流减黄的作用.右侧肝内胆管空肠吻合术近年不少学者采用右肝管-胆囊-空肠吻合术这种内引流术不需分离胆囊创伤小手术也较简单.置管引流术胆道内支架直接支撑肿瘤段狭窄胆管将梗阻近段胆汁通过患者自身胆管达到内引流目的放置胆道内支架管的方法有:经皮肝穿刺胆道(PTD)放置内支架经十二指肠镜(ERCP)放置内支架经剖腹探查术中放置内支架经外引流管运用介入方法放置内支架近年来随着介入治疗技术的发展经肝穿刺胆管内置放记忆合金支架引流或剖腹经胆总管向肝内胆管置放记忆合金支架引流取得了良好的疗效合金支架经胆管穿过肿瘤上下端使梗阻的胆汁经支架流入肝管下段而进入十二指肠但记忆合金支架价格昂贵而且一般基层医院难以开展.原位肝移植术(OLT)肝门部胆管癌具有肝内转移生长缓慢肝外转移较晚的特点故有学者提出其可作为肝移植的一个良好的适应证具体做法是选用原位肝移植胆管重建并行胆总管与受体空肠Roux-Y吻合最大限度的切除患者的近端胆管防止复发肝门部胆管癌肝移植术的适应证为:①已确诊为国际抗癌协会分期(UICC)Ⅱ期患者剖腹探查无法切除者;②拟行R切除但因肿瘤中心型浸润只能做到R或R切除者(R切除:切缘无癌细胞;R切除:切缘镜下可见癌细胞;R切除:切缘肉眼可见癌细胞);③手术后肝内局部复发者国外报道行全肝切除加原位肝移植术术后生存率与根治性切除组无明显差异甚至优于根治性切除组术后常见并发症:HCCA患者除有高胆红素血症外常合并内毒素血症营养不良贫血低蛋白血症凝血机制障碍电解质紊乱免疫功能低下感染及肝肾心血管等重要脏器损害加上手术创伤大术后并发症多严重时直接导致死亡.腹腔大出血多发生于合并肝叶切除及术中门静脉损伤者亦见于胆肠吻合口出血腹腔引流鲜血>ml/h提示腹腔内有活动性出血急诊手术止血预防以术中确切缝合止血为主.胆瘘最常见并发症多发生肝叶切除肝创面胆管处理不当或肝内胆管分别与空肠吻合因肝内胆管开口众多有时难以处理妥善改用胆管成型后与空肠吻合胆汁瘘发生减少;亦可发生于经肝引流管穿出肝表面处近来研究发现胆管血供不良是胆瘘发生的重要因素高位胆管血供主要来自胆囊动脉或肝固有动脉分支有时也由肝右动脉分支供应并且沿胆道呈轴向性走行约%血流自下向上约%血流来自上方当肿物及肝外胆管切除术后尤其肝右动脉结扎切除后胆道吻合端血循环将受到影响造成吻合口愈合不良形成胆瘘胆管血循环研究将成为肝胆外科的焦点问题术中游离胆管时注意保存胆管两侧和后方的血供胆管上端断端吻合前应有活跃的动脉性出血.肝功能衰竭围手术期死亡常见原因多见于肝脏储备功能差的患者预防包括结合术前肝功能评测正确判定手术切除范围积极进行围手术期保肝治疗尽可能避免使用对肝肾功能损害大的药物日本学者提出术前行PTCD降低血清胆红素利于肝功能恢复但多数学者仍对其增加感染并发症延长治疗时间导致并发症发生率高等存在顾虑主张血清总胆红素高于μmol/L以上时行PTCD通过~周减黄后再行手术治疗Makuuchi提出手术前病例施行经皮拟切除侧门静脉栓塞术待~周后对侧肝脏体积增大后才施行手术可以增加半肝或三叶切除术的安全性定期复查肝功观察患者有无黄疸加重烦躁不安嗜睡等肝功能衰竭表现.急性肾功能衰竭多继发于重度黄疸常因有效循环血容量不足交感神经兴奋肾素血管紧张素系统活动增强肾前列腺素减少血栓素A增加及内毒素血症所致特征为自发性少尿或无尿氮质血症稀释性低钠血症和低尿钠预防:术中输%甘露醇溶液-ml以维持利尿状态;术后小时尿量少于ml且血压正常时可用速尿mg静推.应激性溃疡出血重症梗阻性黄疸病人术后严重并发症其发病机制尚未完全明了一般认为高胆红素血症高胆盐血症破坏胃粘膜屏障减少胃粘膜血流有关同时患者常合并感染败血症营养不良等手术创伤大均可导致胃粘膜低灌注形成粘膜溃疡出血严重者可出现穿孔精品文档预防:术前纠正贫血补充血容量抗感染治疗术后常规应用H受体拮抗剂有消化道出血时急检纤维胃镜确诊同时局部止血同时改用质子泵抑制剂一般保守治疗多能治愈如出血量大需行手术治疗总之加强围手术期的器官功能的支持预防和治疗感染应是降低围手术期并发症的主要措施可减少并发症和死亡率预后:文献报道肝门部胆管癌根治性切除疗效明显优于姑息性切除姑息性切除疗效优于单纯引流因此疑似或确诊病例除有明确手术禁忌症外应积极行手术探查争取行根治性切除对无法手术者积极行PTCD ENBD引流或采取介入方法经PTCD ERCP放置支架以期延长生命提高生存质量随着扩大根治术临床推广切除范围大手术风险大术后并发症增多死亡率高精品文档。


3讨论3.1诊断目前公认肝门部胆管癌的首选治疗仍然是手术,但要提高手术切除率,关键是早期明确诊断,其方法我们体会有以下几种:3.1.1重视临床表现90%-98%病人出现黄疸,伴有皮肤瘙痒和陶土样大便,提示胆道梗阻。
同时多表现为上腹隐痛、恶心、厌油、食欲欠佳、腹胀等非特异性表现,本组黄疸病例为96.67%,与上述文献报道发生率相似。
肝细胞性黄疸与药物性黄疸不伴有皮肤瘙痒和陶土样大便,因此可把它视为梗阻性黄疸的特征,以利于进一步寻找梗阻部位和病因。
3.1.2实验室检查由于胆道梗阻,胆管压力升高,造成肝脏损害。
肝功能检查常显示血清总胆红素、转氨酶、碱性磷酸酶及γ-谷氨酸转肽酶均明显升高,其中直接胆红素占总胆红素50%以上,本组为约占总胆红素77.67%。
在本组5项(CEA、CA19-9、CA125、CA242、AFP)肿瘤标记物检测中,以CA19-9意义较大,85%病例升高。
CA199是一种分子量约为100万U的粘蛋白。
正常人血清含量甚微,其正常值<30×103U/L(>95%)[6-7],在胰腺癌、肝癌、胃癌、胆囊癌、肺癌等多种肿瘤中有不同程度异常升高,在胆管癌中也呈高表达。
胆管癌常常与硬化性胆管炎有关,Patel等[8]认为当有原发性硬化性胆管炎病史的病人CA19-9>100kU/L时,诊断胆管癌的敏感度及特异度可达到90%、80%;无原发性硬化性胆管炎的病人其敏感度为50%。
Levy等[9]报道血清CA19-9>129U/ml时,对胆管癌诊断敏感度为78.16%,特异度为98.15%。
目前国内制备的兔抗CCRA2lgG,在诊断胆管癌中阳性率为77.8%,特异性为95%~100%,明显优于上述的肿瘤相关抗原,为今后肝门部胆管癌的早期诊断提供了有意义的依据[10]。
细胞及分子生物学检查组织样本和胆汁内端粒末端转移酶对诊断胆管癌的敏感性几乎达100%。
影响肿瘤细胞生长的环氧合酶-2高表达,很多生长调节分子如受体酪氨酸激酶、c-erB-2和c-met都有高表达的特异性。


胆管癌(cholangiocarcinoma ,CCA )是来源于胆管上皮细胞的恶性肿瘤,依据肿瘤组织沿胆道树生长位置的不同可分为肝内胆管癌、肝门部胆管癌(hilar cholangiocarcinoma ,HCCA )和胆总管中下段癌[1]。
HCCA 是指累及胆囊管开口处以上肝总管及左、右肝内胆管汇合处或肝内胆管的恶性肿瘤,占CCA 全部类型的50%~70%,又称为Klatskin 肿瘤[2]。
HCCA 中约90%的病理类型为腺癌[3],侵袭能力强,恶性程度高,早期症状隐匿。
随着影像学及内镜技术的不断发展,HCCA 的检出率有一定提高,但仍不令人满意,多数患者就诊时已为晚期,失去手术切除的机会。
对于不可切除的HCCA ,不同的治疗手段所获得的疗效也不尽相同,常规的化学药物治疗疗效欠佳。
基于肝门部胆管的解剖特征,肝动脉灌注化疗(hepatic artery infusionchemotherapy ,HAIC )可能是一种更有效的给药方法;随着现代医学的发展,立体定向放射治疗(stereotactic radiotherapy ,SRT )、光动力疗法(photodynamic therapy ,PDT )及射频消融术(radiofrequency ablation ,RFA )等新型治疗方式的出现,使得HCCA 的治疗更加精准。
近年来,随着高通量测序技术的发展及对肿瘤免疫环境研究的不断深入,HCCA 也迎来了分子治疗时代,现有的一些临床试验已经证实免疫治疗及靶向治疗应用于肝内胆管癌治疗的价值,但在HCCA 中的表现却差强人意。
本文对HCCA 的诊断及不可切除HCCA 的治疗研究进展进行综述,为HACC 的临床诊断及治疗提供参考。
1 肝门部胆管癌的诊断1.1 临床表现 HCCA 早期无特异性临床表现,最常见的症状有腹痛或不适、食欲缺乏、体重减轻和皮肤瘙痒等,部分患者也可出现右上腹包块。
HCCA 晚期常合并肝门部胆管癌的诊断及不可切除肝门部胆管癌的治疗研究进展岳子鹏1,石宝琪2*(1.内蒙古医科大学/内蒙古临床医学院,内蒙古呼和浩特 010000;2.内蒙古自治区人民医院介入诊疗科,内蒙古呼和浩特 010020)摘要肝门部胆管癌(hilar cholangiocarcinoma,HCCA)在亚洲的发病率较高,我国是发病率及死亡率最高的国家之一。


肝门部胆管癌现代治疗林锐;刘中砚;陈泉宁;施宝民【期刊名称】《外科研究与新技术》【年(卷),期】2012(001)002【摘要】背景肝门区胆管癌(Hilar cholangiocarcinoma,HC)是源于肝外左右肝管或左右肝管汇合处的胆道腺癌,迄今对其治果不佳.本文通过相关文献回顾,综述肝门胆管癌的治疗方法、治疗时机选择和术前检查评估.其中,治愈性治疗包括局部切除、部分肝切除、联合尾状叶切除及肝门区淋巴结清扫、原位肝移植.局部切除仅适于局限于胆管壁及Bismuth Ⅰ级乳头状癌;对HC大部分选择部分肝切除联合尾状叶切除及肝门区淋巴结清扫.这些术式可根据门静脉栓塞,腹腔镜分期以及腹腔镜下超声等进行选择.但术前胆道引流存在争议;尽管Mayo指南中对无法切除的肝门胆管癌行原位肝移植的建议已被广泛接受,但肝门胆管癌自体移植结果令人失望.缓解治疗方案包括分流手术,内镜或经皮支架置入术,光动力学治疗,腔内短距离放射治疗,外照射治疗以及系统性化疗.结论恰当的R0切除是治疗的主要目标和选择,对无法切除的肝门胆管癌病人,治疗目标为改善生存质量.【总页数】4页(P165-168)【作者】林锐;刘中砚;陈泉宁;施宝民【作者单位】同济大学附属同济医院普外科肝胆外科组,上海 200065;同济大学附属同济医院普外科肝胆外科组,上海 200065;同济大学附属同济医院普外科肝胆外科组,上海 200065;同济大学附属同济医院普外科肝胆外科组,上海 200065【正文语种】中文【中图分类】R-1【相关文献】1.肝细胞癌合并胆管癌栓与肝门部胆管癌临床特点比较 [J], 曾玉萍;梁治平;曾旭文;刘庆余2.肝门部胆管癌中 CD133的表达及 RNA 干扰抑制对胆管癌细胞增殖的影响 [J], 张升涛;刘斌;常琦;姬乐;王加中3.肝细胞癌合并胆管癌栓与肝门部胆管癌的MRI鉴别诊断 [J], 曾玉萍;刘庆余;梁治平;曾旭文;曾玉蓉4.PTCD联合肝门部胆管癌根治术治疗肝门部胆管癌的效果评价 [J], 崔翔; 林磊; 王东平5.肝细胞癌合并肝门部胆管癌栓与肝门部胆管癌的CT鉴别诊断 [J], 梁伟强;王猛;冯艳青;彭振鹏因版权原因,仅展示原文概要,查看原文内容请购买。
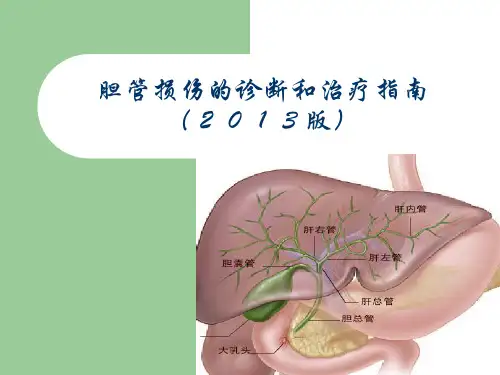
肝门部胆管癌诊断治疗指南(2013版)-08-19肝门部胆管癌(Hilar Cholangiocarcinoma,HC)是指累及肝总管、左右肝管及其汇合部的胆管粘膜上皮癌,亦称高位胆管癌、近端胆管癌或Klatskin肿瘤,HC的发病例称逐渐增高的趋势,尸检资料显示胆管癌的发病率约为0.01%~0.2%,HC占其中的40%~60%(Abdel WM,2007)。
HC被认为是肝胆外科领域最具挑战性的难题之一,由于缺乏符合国情的临床实践指南,在HC病情评估、治疗决策、手术方式及非手术治疗等方面普遍存在不规范问题,这一复杂难治疾病的总体治疗效果很不满意(黄志强,2007)。
为此,中华外科学分会胆道外科学组、肝脏外科学组和全军肝胆外科专业委员会联合组织了国内相关领域的专家,基于循证医学的原则,通过深入学术研讨和论证制定了本指南,旨在为HC的规范化治疗提供指导意见。
在本指南中,证据的质量等级由高到低分为I 到VI级6个层次,诊断和治疗建议的推荐等级也相应分为A、B、C1、C2和D级等5级(Takada TM , 2008)。
1 HC的临床分型和分期目前HC常用的分型和分期系统主要有以下四类:①Bismuth-Corlette分型;②MSKCC T分期系统;③AJCC分期系统;④国际胆管癌协会分期系统。
Bismuth-Corlette分型是经典的临床分型方法(Bismuth H , 1992)。
该分型是以肿瘤累及胆管的解剖部位及范围为依据,对于手术方式的选择具有重要价值,但该分型没有表述对胆管癌切除和预后有影响的血管浸润、淋巴结转移和肝脏萎缩等因素。
MSKCC T分期系统(Memorial Sloan Kettering Cancer Center T分期系统)是根据肿瘤累及胆管范围、门静脉侵犯和合并肝叶萎缩三个因素将HC进行分期(Jarnagin WR 2001)。
该分期系统在判断可切除性或是预后判断方面均优于Bismuth-Corlette分型,但未体现肝动脉侵犯、淋巴结转移和远处转移等病理要素。
美国抗癌协会AJCC的TNM 分期是基于病理指标的一种分期系统(Nishio H,2005),有助于患者预后的判断,但术前几乎得不到TNM分期所需的相关资料,因而其临床实用价值有限。
国际胆管癌协会(the International Cholangiocarcinoma Group)于2011年提出了一种新的HC分期系统(Deoliveira ML , 2011),对胆管癌肿部位和形态,门静脉、肝动脉受累状况,预留肝脏体积、并存肝实质病变,淋巴结及远处转移等病理要素给予全面评估和表述,借助这一分期系统,可对HC的可切除性、术式选择及患者预后做出更准确的判断。
推荐1:采用Bismuth-Corlette分型可对癌肿累及胆管树的部位、范围及可切除性进行初步评估;采用国际胆管癌协会分期系统可对癌肿累及胆管树及临近组织结构的状况、病情严重程度、可切除性、术式选择及患者预后进行较为全面的判断。
(C1)2 HC的病理类型与生物学特性HC的组织病理类型以腺癌为多,占90%以上,少见类型尚有透明细胞癌、印戒细胞癌、鳞癌、腺鳞癌和未分化癌等。
按大体形态可分为硬化型、结节型和乳头型三种。
硬化型约占70%,多见于低-中分化腺癌。
结节型约占20%。
乳头型约占10%,多为高分化腺癌,其切除率高,预后好。
目前认为,HC具有多极化浸润转移的生物学特性,癌肿沿胆管树轴向近端和远端胆管浸润,同时可突破胆管树向侧方侵犯临近的门静脉、肝动脉和肝脏实质,且常发生区域性淋巴结和神经丛转移。
位于肝门区的尾状叶容易受到肿瘤侵犯。
推荐2:癌肿组织病理类型、分化程度、区域淋巴结和神经丛转移是影响预后的重要因素。
基于HC具有多极化浸润转移的生物学特性,应将切除受累肝实质、尾状叶以及廓清区域淋巴结和神经丛作为HC治愈性手术的基本内容(C1)。
3. 影像诊断HC的诊断主要依靠临床表现和影像学检查。
影像学诊断的两个基本依据是胆管梗阻和肿瘤占位。
临床上常用的影像学诊断方法为:B超、MDCT、MRI(MPCP)、PTC、ERCP和PET-CT。
3.1 超声检查超声检查显示肝内胆管扩张,且在肝门附近截断,扩张的胆管内可见肿瘤回声,与正常肝脏组织和胆管分界不清。
多普勒超声能有效检出肝动脉、门静脉受累状况。
作为一种简便易行的无创性检查方法,超声检查主要用于HC的临床筛查以及引导PTBD和PVE等。
3.2 多排CT(MDCT)MDCT图像空间分辨率高,利用增强MDCT图像进行冠状面或多平面重建后,能清晰地显示肿瘤病灶及相邻脉管结构间的关系,并据以测算肝内各区段的体积。
CT造影可以取代有创血管造影显示门静脉和肝动脉系统的解剖变异和受累状况。
MDCT可作为肿瘤定性、定位与分期评估、肝门区脉管解剖和肝实质病变评估、肿瘤可切除性判断和手术规划的主要依据。
3.3 MRI (MPCP)MRI可以对肿瘤及邻近结构进行多参数、多平面、多角度的扫描,对软组织的分辨率高。
增强MRI可以像增强CT一样有效评估胆管肿瘤部位和范围、肝门区血管受累以及肝实质病变状况。
MRCP能无创显示肝内胆管树的全貌,肿瘤阻塞部位和范围,但其清晰度通常不如直接胆道造影。
MRI(MRCP)也可作为HC分型和分期评估及可切除性判断的主要依据。
3.4 直接胆道造影PTC能清晰显示梗阻部位、胆管受累范围以及梗阻部位上游胆管的形态。
对于高位胆管梗阻所导致的肝内胆管相互隔离,常需要通过多支胆管PTC才能对癌肿在胆管树的浸润范围作出全面的评估。
ERC对于HC造成不全性胆管阻塞者可以显示出整个胆道受累状况,若为胆管完全阻塞则仅能显示梗阻部位以下胆管的状况,故对HC的诊断及可切除性判断价值有限。
由于PTC和ERC均系有创性检查,有导致出血和/或诱发胆道感染的风险,不推荐作为常规检查手段,而对MRC显示不清、不宜行MRC检查者,或拟行术前胆道引流(PTBD、ENBD)的HC病例可实施同步胆道造影或二期经引流管胆道造影。
3.5 PET-CT既可由PET功能显像反应肝门区占位的生化代谢信息,又可通过CT形态显像进行病灶及侵袭范围的精确定位,但其对HC局部病变的评估和可切除性判断的价值并不高于其他影像学检查。
全身扫描可发现肿瘤的淋巴结转移、腹腔种植转移及远处转移。
推荐3:HC的复杂病情常需要个体化选择应用多种影像学方法作出综合分析评估。
超声检查常作为筛查的手段,MDCT和(或)MRI(MRCP)是对HC作出定性定位诊断、肿瘤分型和分期、评估可切除性判断和手术规划的主要手段和依据。
对于有选择的病例,MDCT与MRI联合应用以及将MDCT或MRI合成为三维图像,有助于更全面准确的病情评估。
PTC、ERC和PET-CT不推荐作为HC的常规检查方法,可作为其他影像手段的补充(C1),PTC和ERC可替代MRCP显示癌肿在胆管树的浸润范围,PET-CT则用于判断区域淋巴结和神经丛转移、腹腔种植转移以及远处转移(C1)。
4 侵袭范围的评估HC侵袭范围的评估应涵盖以下4个维度:①肿瘤沿胆管树轴向扩展范围;②肿瘤突破胆管壁向侧方扩展累及临近肝实质以及肝动脉、门静脉范围;③区域性淋巴转移和神经丛浸润;④腹腔种植和远处转移。
4.1 肿瘤沿胆管树轴向扩展范围的判断肿瘤沿胆管树轴向扩展范围的评估主要依据胆管狭窄的范围来判断并确定相应的Bismuth分型。
一般先参照MRCP或直接胆道造影显示的胆管树形态进行大体判断,进一步根据MDCT和(或)MRI断层图像显示的胆管壁增厚和强化征象精确分析判断肿瘤与正常胆管组织的边界。
由于HC存在粘膜下浸润及粘膜层扩展,故依据影像学检查精确判断胆管轴向扩展范围常存在一定的困难。
内镜下胆管上皮多点采样活检有助于提高对癌肿轴向扩展程度判断的准确性,但系侵袭性检查且肿瘤在上皮内扩展所导致的切缘阳性的临床价值尚未确立,可选择性使用(Nimura Y, 1993) ( level IV)。
4.2肿瘤侧方扩展范围的判断对肿瘤侧方扩展范围进行评估的重点是门静脉、肝动脉和肝实质等受累状况,主要依据MDCT和MRI断层图像及由此合成的血管成像。
门静脉受累表现为软组织包绕、变形、管腔狭窄、肝脏动脉期灌注异常、超声检查显示门静脉湍流形成等。
肝动脉受累征象有管腔狭窄、走行不规则和肝脏动脉期灌注不良(Watadani T, 2008) ( level IV)。
根据多期影像中肝实质的密度和信号的异常容易判断肿瘤对肝实质的浸润范围。
4.3肿瘤转移的评估依据MDCT 或MRI影像显示出明显的肝内转移灶及肿大淋巴结则易于作出判断,但对腹腔种植、神经丛受累或淋巴结肿大不明显时则较难诊断,部分病例需依赖腹腔镜或开腹手术探查与活检(Masselli G 2008) ( level IV)。
PET-CT 检查对腹腔淋巴结转移、腹膜种植或远处转移有诊断价值(Li J ,2008) ( level IV)。
4.4 肝脏3D评估外科医生在术前必需将各种肝胆影像信息与自己的知识和经验融合后,在脑海中合成为肝胆系统的三维立体构象,据此进行手术相关因素的分析、可切除性判断和手术方案设计,对于HC这一涉及围肝门区众多脉管的复杂病变的大脑3D印象,常因不同医生的经验和知识的差异而产生不同程度的偏差。
在术前采用计算机辅助手术规划系统,基于MDCT或MRI 影像数据,对肝脏、肝内脉管结构、病灶进行三维重建,可客观、全面、立体地再现肝脏脉管解剖结构、癌肿浸润范围、癌肿与重要脉管结构几何关系,可避免医生仅凭2D图像在脑海中3D构建和评估的不确定性和误差,其在HC评估中的应用价值主要有两个方面:1.个体化评估围肝门区脉管的立体解剖构筑及其变异特征。
2.系统化评估癌灶浸润范围及其与围肝门区脉管结构的立体几何关系。
将癌灶浸润范围精确标定在真实再现的个体化肝脏3D构象中,对于准确判断肿瘤可切除性和精密手术规划具有重要价值。
推荐4:HC侵袭范围的术前评估需综合应用现有高精度影像检查方法准确判断癌肿在各个维度上的扩展状况,并进而在肝脏三维构象中把握肿瘤浸润范围的全面分布,及其与围肝门区脉管结构的立体几何关系(C1)。
5 HC可切除性判定癌肿累及胆管树的部位和范围、门静脉和肝动脉受累状况、肝实质损害严重程度、预留肝脏功能性体积、局部淋巴结和神经转移以及远处转移等因素均能影响HC的可切除性及手术方式的选择。
可切除的HC需满足三个要素:1.累及胆管树及邻近区域组织内的癌肿可获得完整切除和全维度R0切缘;2.预留肝脏的功能性体积不小于患者必需功能性肝体积(董家鸿,2012)( level IV),且其胆管和血管结构完整性可保存或重建;3.手术创伤侵袭可控制在患者能耐受的范围内。