临床试验立项审查表(药物)
- 格式:doc
- 大小:112.00 KB
- 文档页数:4
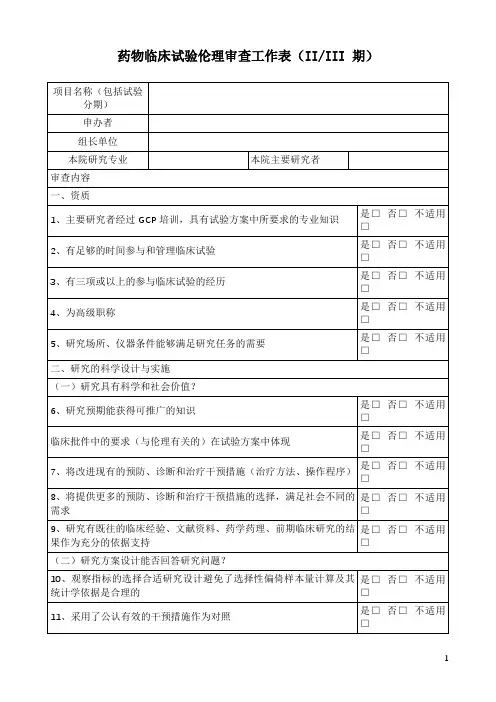

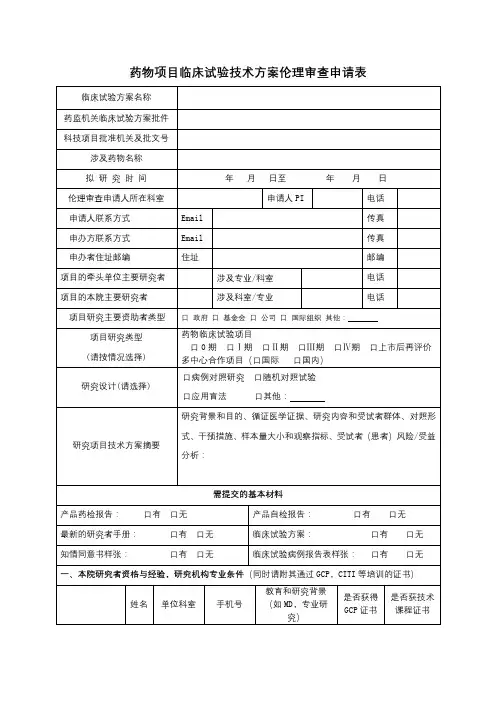
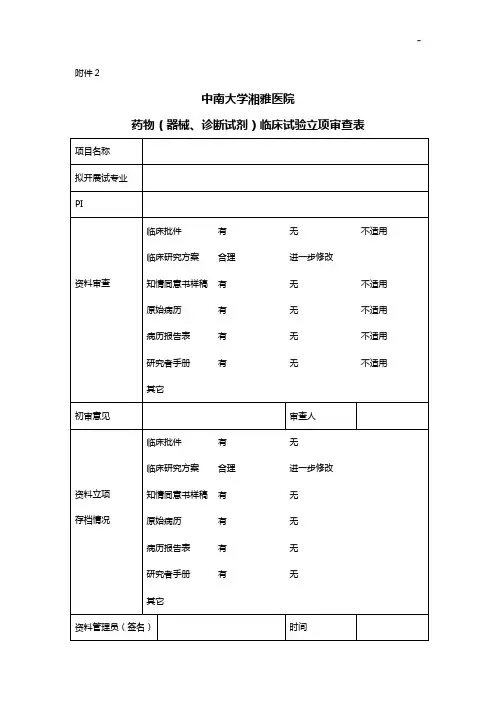

药物临床试验运行管理制度与工作流程Ⅰ。
概念:药物临床试验是指任何在人体(病人或健康受试者)进行的药物的系统性研究,以证实或发现试验药物的临床、药理和/或其他药效学方面的作用、不良反应和/或吸收、分布、代谢及排泄,目的是确定试验药物的安全性和有效性。
Ⅱ.管理部门:药物临床试验机构(以下简称“机构")对我院药物临床试验实行管理。
Ⅲ。
工作程序:1.立项准备1.1.申办者/CRO(合同研究者组织)联系机构办、意向科室共同确定主要研究者。
CRA提交“药物临床试验立项申请表”(附件1),并按照“药物临床试验报送资料目录”(附件2)准备临床试验相关完整材料一份,交机构办公室。
1.2.PI提出研究小组成员,填写“主要研究者履历”(附件3)“项目研究团队成员表”(附件4),由CRA连同试验资料一起递交机构办公室.研究小组人员的资质必须符合以下要求:➢研究团队成员必须经GCP培训并获取证书;➢主要研究者组建研究团队,包括:①临床医师;②病区护士;③研究护士;④药物管理人员;⑤药物代谢研究人员(如需要);⑥其他相关科室人员(如需要)1.3.一页均为文件目录,每项文件中间用带数字标识的隔页纸分隔。
请按文件目录所列文件顺序排列各项文件,文件夹中不包括的文件无需列入目录。
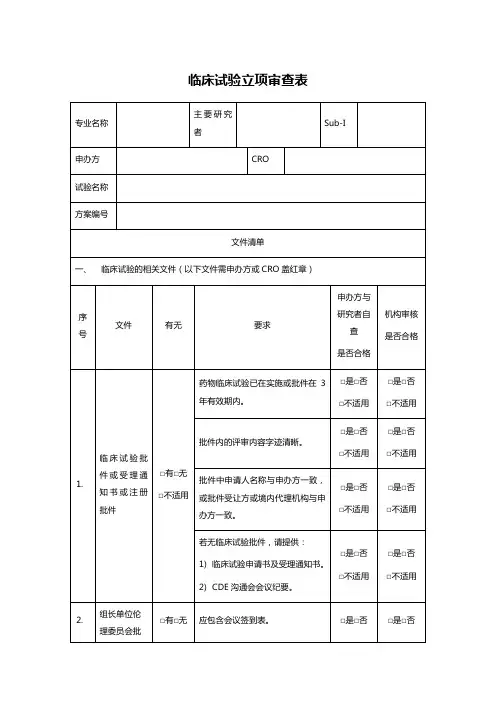
文件多的项目请准备多个“机构文件夹”,编号“①,②,③……”.2.受理立项机构对送审材料及研究小组成员资质进行审核,决定是否同意立项。
若同意,则向伦理委员会发出“临床试验审批受理通知”(附件5)。
3.伦理审核3.1.申请者持“临床试验审批受理通知"(附件5)按照伦理委员会要求准备材料,将申报材料交伦理委员会进行伦理评审。
3.2.评审结束后,将“伦理委员会接受临床试验回执”(附件5)和“伦理委员会审批件"原件交回机构办公室。
若按伦理委员会要求所提交项目资料有所修订,要将已修订的项目资料补交到机构办公室备案。
4.签订协议4.1.临床试验协议样本先由研究团队审核确认后再交机构办公室复审,协议终版以主要研究者、机构办公室及申办者三方达成一致为准.经申办者签字盖章的临床试验协议终版一式两份(或两份以上),先由主要研究者签字后交机构办公室加盖机构公章。

临床试验项目免知情同意伦理审查申请表药物(器械)临床试验项目修正案伦理审查申请表研究进展报告带格式的:字体:TiaesNewRoman研究方案名称/编号/版本号:一,伦理受理编号: 伦理批件号: 伦理批件日期:」 座踪审查频率「带格式的:字体:TiteSNeIrRoman带格式的:字体:TieeSNewRoman 「、受武者信息发试者入 H 划入组(例):入组(例): 第I 例入组时间:组信息脱落(例):剔除(例):▲严重不良 严重不良事件(例):巳报告的严重不良事件(例):其中,非预期严重不良事件(例):事件信息其中,与试验药物肯定有关或可能有关(例):其中,可能无关或肯定无关(例); 其中,无法判定(例):一二4研究进展情况研究阶段: P 研究尚未启动 □正在招募受试者(尚未入组) 口正在实施研究□受试者的试验干预已经完成□后期数据处理阶段带格式的:字体:TimeS∖ewROman 带格式的:字体:Ti 三esNewRoman 错格式的:字体:TilaeSMWRomiIn 带格式的:字体:TiI«esNewRoman 带格式的带格式的:7体:TimesXewRoman 带格式的:字体:TinesNewRoman 带格式的:字体:TiaesNewRoman 带格式的:字体:TimfS Ww RomHn“∕×(¼格式的:?体:TilneS Roman带格式的:字体:TiagsXeIrRCTnanJ 带格式式带格式的:7体:TimCS∖cwROman龙否存在影响研究进行的情况:P 否口是如果“是”请说明:.……是否存在与试胺干预相关的、非预期的严重不良事件:口是口否研究风险是否超过预期:口是口否是否存在影响研究风险与受益的任何新信息、新进展:口否口是如果"是''请说明: ....... 例究中是否存在影响受试者权益的问题:P 否□是I!带格式的 -―=格式的:^如果“是”请说明: .........严重不良事件或方案规定必须报告的重要医学事件已经及时报告:□是□否口不适用耕究执行的方案与知情同意书是否经过伦理委员会批准:P 是口否,三、其他一带格式的"--{带格式的:字体:TiBesNelrRolnan是否申请延长伦理审查批件的有效期:口是 □否冏、篓名申请人签名: 日期:带格式的带格式的 带格式的带格式的带格式的:字体:TimesXewRoman 带格式的 在:请将选择项标注为用J带格式的:字体:Ti 三esNowRoman蒂格式的:;体:TieesNowRoman■日期:五、题书组建议审查方式□全体会议审查,匚委员快速审查伦理办公室秘书签名:严重不良事件(SAE)报告暂停/终止研究报告结题报告临床试验项目修改后同意伦理审查申请表。
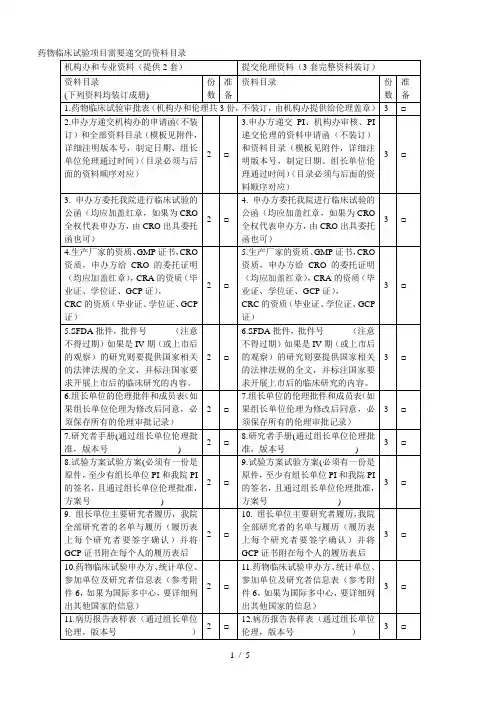
药物临床试验项目需要递交的资料目录附件2:药物临床试验申办方、统计单位、参加单位以及研究者信息表(国内项目国际多中心项目)(注:若为国际多中心项目,请先填写国际多中心的内容,国内项目可以不填)附件3:申办方前期提交机构办的备案资料封面模板试验药物名称:______________________________________药物临床试验批件号:________________________________药物临床试验方案号:________________________________我机构专业的中心号:________________________________(除项目名称用三号字居中之外,其余内容均用小四号字,1.5倍行距)项目名称(三号字,居中)青岛大学附属医院机构办备案资料手机号码:_______________________________电子邮箱:_______________________________传真;___________________________________所属部门和职务:_________________________详细通讯地址:___________________________邮政编码:_______________________________备案单位:_______________________________(加盖公章)备案单位性质:□申办方□CRO □其他________________备案时间:年月日项目名称xxxx药物临床试验资料目录资料目录请按照附件1中的目录排列,有版本号的必须注明版本号,制定日期,中心伦理通过时间.(该目录最终版本必须与相关资料顺序对起来)机构备案资料递交申请函青岛大学附属医院国家药物临床试验机构管理办公室:兹有青岛大学附属医院国家药物临床试验机构________专业申请参加一项____________________________________________________公司的多中心II期临床试验:_______________________________________________________我院为□组长单位(□参加单位),主要研究者为:__________。
附件1
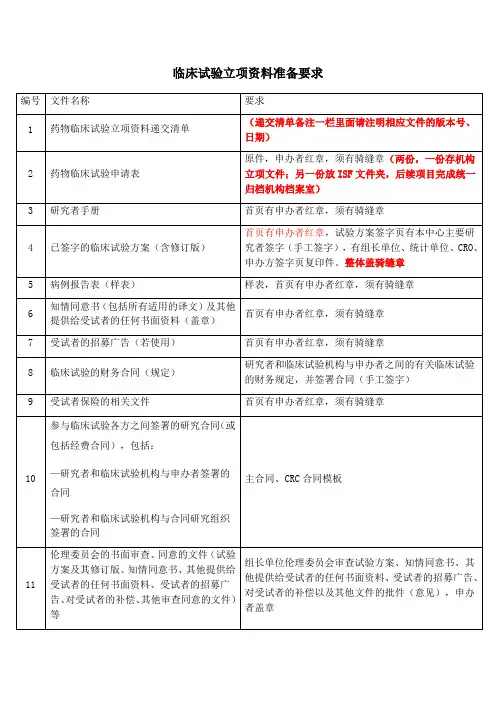
药物临床试验立项资料目录
备注:以上资料提供纸质版(A4)完整二套,立项备案用(如为新启动项目请至少提供
1~5项(方案未确定请提供方案初稿/摘要) 进行预审)。
附件2
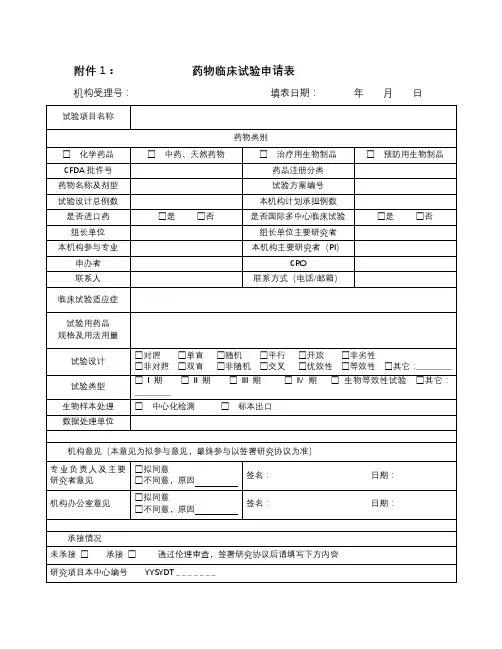
药物临床试验立项申请表立项编号:日期:
附件3
研究者履历
附件4
专业组项目研究团队分工表
附件5:
药物临床试验伦理审查送审资料目录
备注:以上资料提供纸质版(A4)二套,伦理备案用。
第4~7项提供电子版的资料,发送至伦理委员会秘书邮箱,形式审查用。
第3~9项提供纸质版(A4)十套,伦理审查上会时用。
附件6:
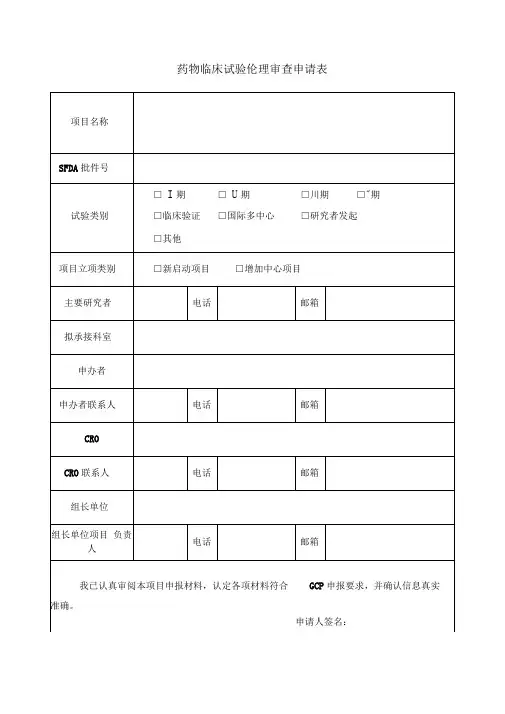
临床试验伦理审查申请表
项目受理号:申请日期:
附件7
医疗器械临床试验伦理审查送审资料目录
备注:以上资料提供纸质版(A4)二套,伦理备案用。
第4~7项提供电子版的资料,发送至伦理委员会秘书邮箱,形式审查用。
第3~9项提供纸质版(A4)十套,伦理审查上会时用。
附件8
医疗器械临床试验伦理审查申请表。