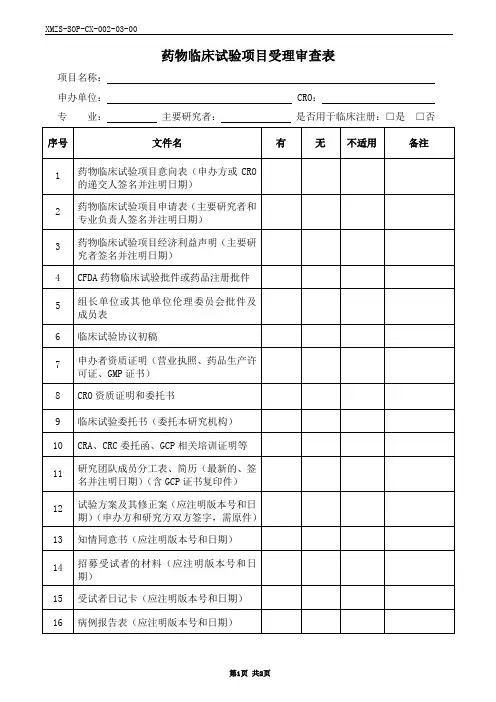
临床试验审批表(药物类)
- 格式:doc
- 大小:25.50 KB
- 文档页数:3

临床试验审批表(药物类)
临床试验审批表(药物类)
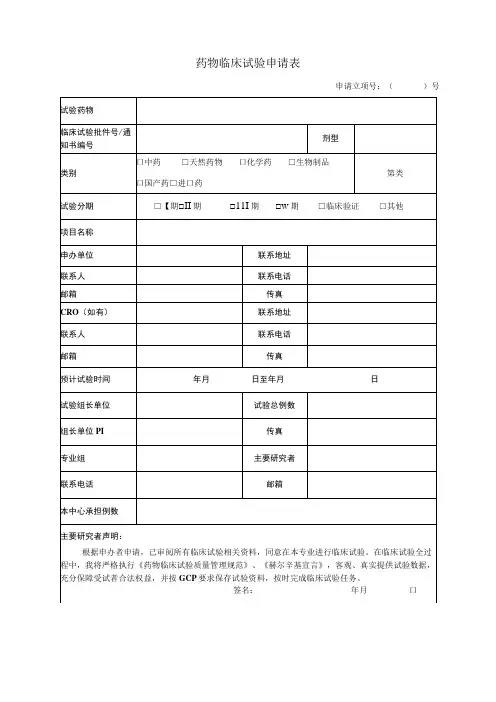
项目名称:
申请科室:
试验范围:国内多中心□国际多中心□亚洲多中心□
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
试验药物类别:新药类期或其他
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、该药物的临床试验批准机关:
批准文件号:
二、试验目的:
三、组长单位:负责人
四、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
五、试验样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、试验药剂量用法疗程
剂量用法疗程
六、对照样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、对照组剂量用法疗程
七、适应症:
八、禁忌症(注意事项):
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。


滨州医学院附属医院国家药物临床试验机构文件编码:JG-SOP-005-3.0
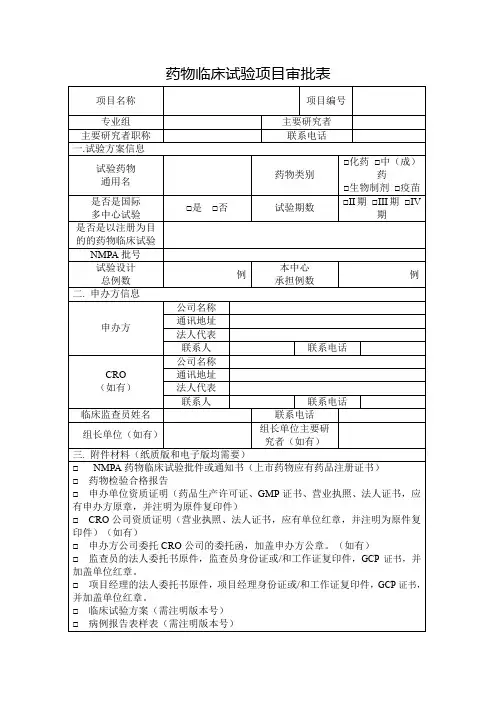
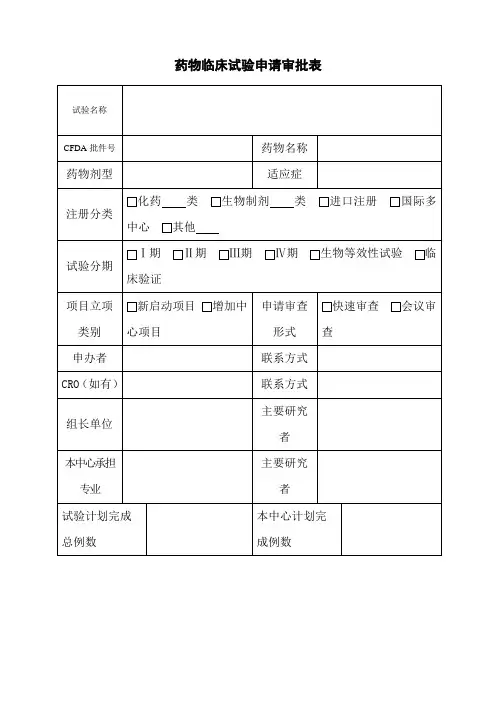
药物临床试验审批表
项目名称
申办者CRO
药物名称剂型规格
研究分期注册分类
专业科室主要研究者
形式审查资料目录:
□临床试验申请表□SFDA批件、组长单位批件
□委托公函□申办者及CRO资质
□研究者手册□药检报告
□临床试验方案□研究者简历
□知情同意书□病例报告表
□研究病历□药品说明书
□受试者日记卡□招募广告
□监查员名片、GCP培训证书、身份证及学位证复印件
□如果样本在外地检测的要提供检测实验室的名称和资质证明;
□其它
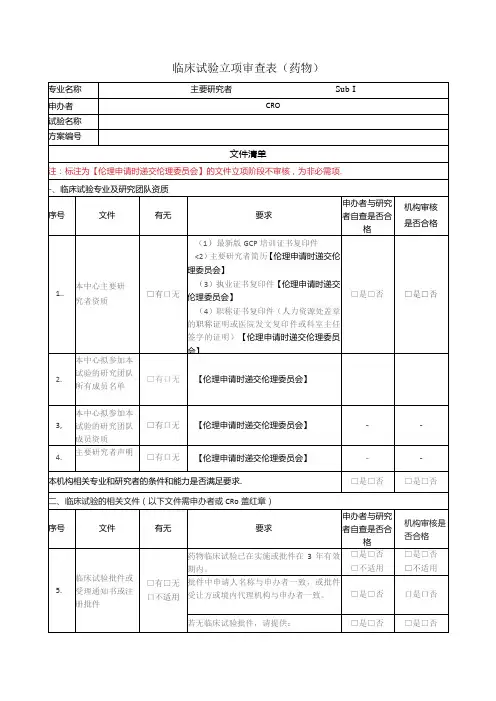
机构办公室秘书形式审查意见:
签字:日期:年月日机构办公室主任对立项审核要点:
1.本项目主要研究者是否已对项目充分了解,提交了申请并做出试验相关保证?□是□否
2.本专业组在研项目数量是否符合要求?□是□否
3.本项目监查员是否被机构认可?□是□否
4.本项目是否在机构进行过充分讨论?□是□否
5.关于项目费用分配问题,机构是否已了解并初步同意?□是□否
6.提交的备案资料是否还存在不全或者不符合要求等问题?□是□否
7.本项目是否存在需要说明或者有争议的问题?□是□否如存在,请简单说明:。
机构办公室主任意见:
□同意□不同意□补充完善资料后同意□修改部分内容后同意
□其他:
签字:日期:年月日机构主任意见:
□同意□不同意□其他:
签字:日期:年月日。
药物临床实验审批表
项目名称
申办者
药物名称剂型规格
研究分期注册分类
专业科室主要研究者
形式审查资料目录:
□临床实验申请表□批件、组长单位批件
□委托公函□申办者及资质
□研究者手册□药检报告
□临床实验方案□研究者简历
□知情同意书□病例报告表
□研究病历□药品说明书
□受试者日记卡□招募广告
□监查员名片、培训证书、身份证及学位证复印件
□如果样本在外地检测的要提供检测实验室的名称和资质证明;
□其它
机构办公室秘书形式审查意见:
签字:日期:年月日
机构办公室主任对立项审核要点:
.本项目主要研究者是否已对项目充分了解,提交了申请并做出实验相关保证?□是□否
.本专业组在研项目数量是否符合要求?□是□否
.本项目监查员是否被机构认可?□是□否
.本项目是否在机构进行过充分讨论?□是□否
.关于项目费用分配问题,机构是否已了解并初步同意?□是□否
.提交的备案资料是否还存在不全或者不符合要求等问题?□是□否
.本项目是否存在需要说明或者有争议的问题?□是□否
如存在,请简单说明:。
机构办公室主任意见:
□同意□不同意□补充完善资料后同意□修改部分内容后同意
□其他:
签字:日期:年月日机构主任意见:
□同意□不同意□其他:
签字:日期:年月日。
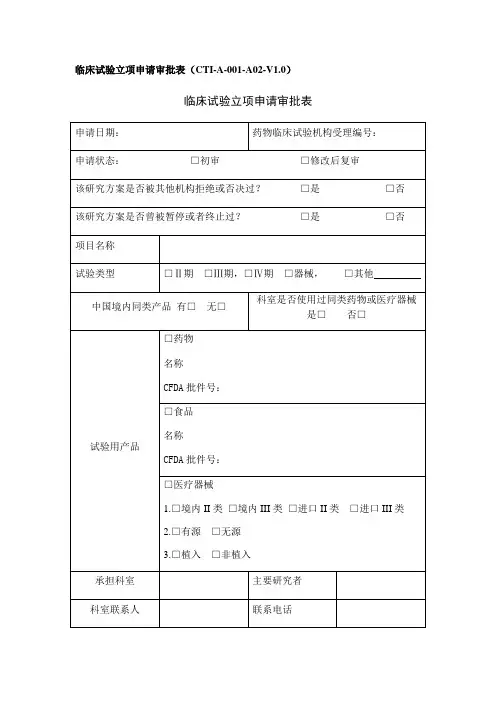
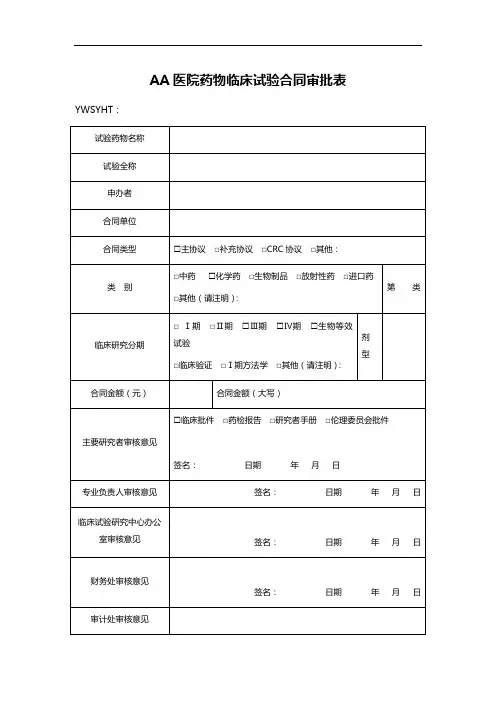
药物临床试验项目承接审查表项目名称
药物名称/剂型□化学药□进口药□中药
□新生物制品□放射性药□其它
第三
类
临床分期□Ⅱ期□Ⅲ期□Ⅳ期□临床验证□国际多中心临床试验项目类别□牵头□参加CFDA批件号
申办者
联系人姓名联系电话
申办者提交资料(按实际提交的资料在相应方框中打√)□CFDA批件□研究者手册□试验方案□研究病历/门诊病历□CRF □知情同意书□药检报告□申办者资质证明
□合同/协议(草稿)□其他
拟承接专业/科室承担病例观察数每例研究费项目总研究费
专业/项目负责人意见本专业药物临床试验情况
1)已承接未启动()项,在研()项
2)是否有相同品种的药物临床研究:□是□否
3)在研相似品种是否影响该项目的实施:□是□否
4)是否再有资源来保证该项目的实施:□是□否
负责人意见
年月日
机构意见
年月日备注。
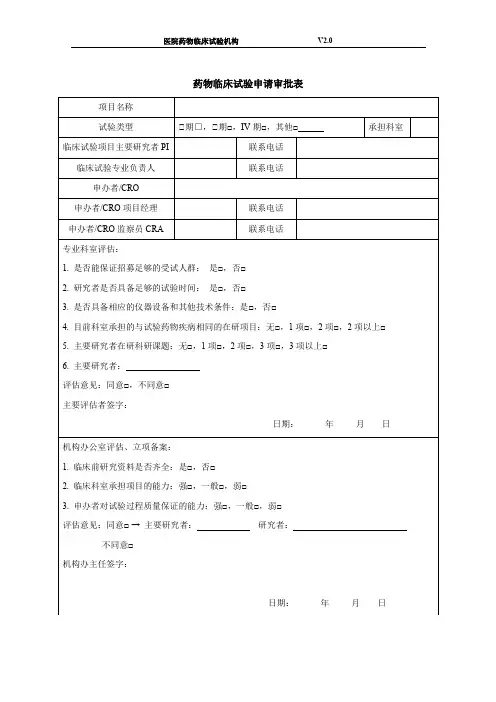
临床试验审批表(药物类)
项目名称:
申请科室:
试验范围:国内多中心□国际多中心□亚洲多中心□
项目负责人(签名):职称:手机号:
该负责人目前在研项目:项;与该方案有竞争项目项质控员(签名):职称:手机号:
试验药物类别:新药类期或其他
申办单位:联系人及电话:
CRO: 联系人及电话:
SMO:联系人及电话:
一、该药物的临床试验批准机关:
批准文件号:
二、试验目的:
三、组长单位:负责人
四、受试者是否需要签署知情同意:是□否□
您认为知情同意书内容是否完整:是□否□
五、试验样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、试验药剂量用法疗程
剂量用法疗程
六、对照样品
1、名称剂型及规格批号
有效期
2、提供单位:
3、对照组剂量用法疗程
七、适应症:
八、禁忌症(注意事项):
九、可能出现的不良反应:
1、4、
2、5、
3、6、
十、对不良反应是否有相应的防治措施
1、有□无□未考虑□
2、有□无□未考虑□
3、有□无□未考虑□
4、有□无□未考虑□
5、有□无□未考虑□
6、有□无□未考虑□
填表时间:年月日
药物临床试验机构审批意见:
□同意立项
□补充完善资料后同意
□不同意原因:
□其他:
机构主任签字:日期:年月日。