药物临床试验立项申请表
- 格式:doc
- 大小:44.00 KB
- 文档页数:2

医院临床科室新药申请
廉洁承诺书
为了严把新药准入关,坚决抵制医药购销中的不正之风,医院药
事管理委员会和临床科室工作人员将严格遵守廉洁自律承诺,承诺内容如下:
1、加强廉政建设,增强自身的法制观念和反腐能力,廉洁行医。
2、坚持原则,秉公办事,自觉抵制医药购销中的不正之风,做到:
不接受药品经销商送的礼金礼品、有价证券、购物券、回扣、佣金;
不私下接触、参与宴请和娱乐活动;不索要好处费、赞助费和宣传费:不代支付旅游费用、报销各种消费凭证。
3、拒绝药品经销商给予的礼金、有价证券等。
4、作为新药引进的申请人,我保证所申请的新药____ ___ 等个品种(见申请表)是我科室专业治疗必须的,并对所在科室所申请新药的合理使用进行监督管理,若发生所申请新药临床不合理
应用及其它违规、违纪行为,本人愿承担监督管理等相关责任。
5、本承诺书一式二份,将留存医院存档。
承诺人:
年月日
医院新药引进申请表
药事管理委员会意见:
参会委员:共()名
评审结果:共收回选票()份,通过()票,不通过()票。
评审决议:□通过□不通过
签名:
年月日主管院长意见:
签名:
年月日院长意见:
签名:
年月日。

药物临床试验申请报告
药物临床试验机构:
专业申请参加:
本专业确定作为该试验项目的负责人,作为
该试验项目的质控员,为该试验项目的药品专管员。
本项目的负责人及质控员已阅读并熟悉该项目的相关资料,同意执行试验方案中所有细节,确保参加项目的其他研究人员在试验过程遵守临床试验方案。
本专业具备完成该临床试验的医疗条件,有足够的病例资源,可以在规定的时间内、在符合GCP等法律法规的前提下按临床试验方案要求完成该项工作。
专业负责人签字:
日期:。
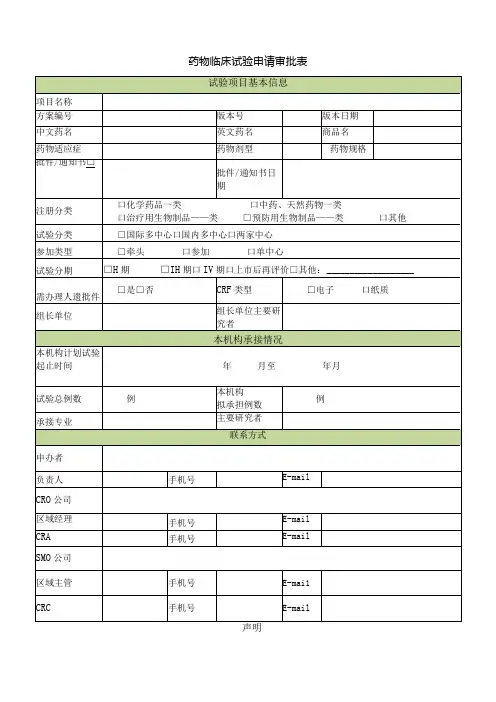
药物临床试验申请审批表申办者声明我保证以上信息真实准确,并负责该临床试验全过程的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
如有失实,愿意承担相关责任。
申办者代表签名(盖章):年月日CRO 公司声明我保证以上信息真实准确,并负责该临床试验全过程的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
如有失实,愿意承担相关责任。
CRo 代表签名(盖章):年月日主要研究者声明我保证以上信息真实准确,并负责该临床试验全过程中的质量保证,承诺该临床试验数据真实可靠,操作规范,符合NMPA 《药物临床试验质量管理规范》(GCP )要求。
本人承诺本研究团队人员与该项目无利益冲突。
如有失实,愿意承担相关责任。
主要研究者签字:_________________________________ 年月日审批意见(手签)主要研究者对本试验的评估及意见:L 试验的入排标准是否合理:2 .病源病种是否能够满足方案要求:3 .研究人员是否有足够的试验时间:4 .科室的场地和设施是否能保障:5 .是否能对试验质量进行保证:6 .是否保证能在约定时间内完成试验:7 .科室在研项目情况:是否有竞争入组临床试验在研:在研药物临床试验数量:项,其中处于筛选期和治疗期的项 8 .主要研究者决定:同意承接口主要研究者(签字):年月日科室意见:同意承接口不同意承接口专业负责人(签字):机构办公室意见:同意承接口项目编号: 不同意承接口机构办主任(签字):机构意见]同意承接口不同意承接口机构主任(签字):注:(1)表格内的选择框内勾选均采用“国)”:(2)请使用A4纸双面打印。
□ □□□□□ □ 否否否否否否 否 □□□□□□ □ 是是是是是是 是。
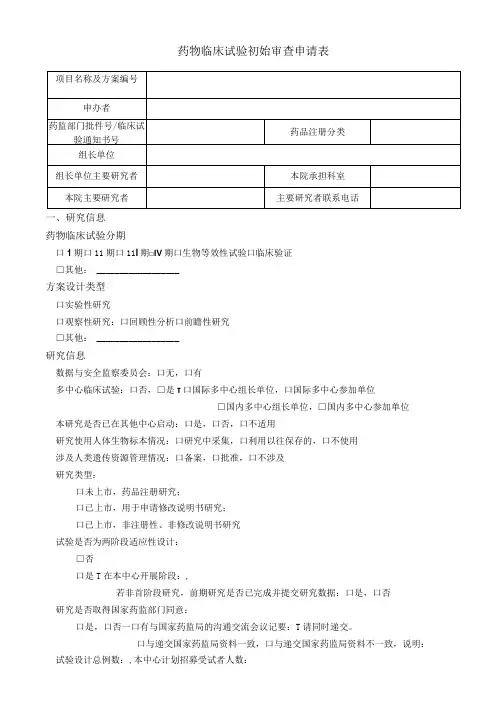
药物临床试验初始审查申请表一、研究信息药物临床试验分期口1期口11期口11I期□IV期口生物等效性试验口临床验证□其他: __________________方案设计类型口实验性研究口观察性研究:口回顾性分析口前瞻性研究□其他: __________________研究信息数据与安全监察委员会:口无,口有多中心临床试验:口否,□是τ口国际多中心组长单位,口国际多中心参加单位□国内多中心组长单位,□国内多中心参加单位本研究是否已在其他中心启动:口是,口否,口不适用研究使用人体生物标本情况:口研究中采集,口利用以往保存的,口不使用涉及人类遗传资源管理情况:口备案,口批准,口不涉及研究类型:口未上市,药品注册研究;口已上市,用于申请修改说明书研究;口已上市,非注册性、非修改说明书研究试验是否为两阶段适应性设计:□否口是T在本中心开展阶段:,若非首阶段研究,前期研究是否已完成并提交研究数据:口是,口否研究是否取得国家药监部门同意:口是,口否一口有与国家药监局的沟通交流会议记要:T请同时递交。
口与递交国家药监局资料一致,口与递交国家药监局资料不一致,说明:试验设计总例数:,本中心计划招募受试者人数:预期研究时间:年月至年月(伦理收费及批准研究时间以此为准)招募方式及人群招募者:口医生,口研究人员,口中介公司,口其他:招募方式:口发布招募广告,口临床诊疗过程,口数据库,□其他:研究是否涉及弱势人群或个体:□否口是T弱势的具体特征:________________________________________________________ 针对性的附加保护措施:__________________________________________________ 受试者补偿和支付计划口无补偿口有补偿:口货币补偿,补偿理由及数额:_____________________________________________ 口非货币补偿,说明:____________________________________________________ 支付计划(请详细描述发放周期及流程):受试者参与研究的费用谁支付研究干预和研究程序的费用:研究药物费用支付者:□申办者,口受试者,口其他:研究理化检查费用支付者:□申办者,口受试者,口其他:其他,说明:____________________________________________________________知情同意谁获取知情同意:口主要研究者,口研究者,口其他:获取知情同意地点:口私密房间/受试者接待室,口诊室,口病房,口其他:知情同意签字:口受试者签字,口监护人签字知情同意的例外口否,口是τ口申请变更知情同意,口申请豁免知情同意理由: _______________________________________________________________ 研究者其他研究工作本人在研的研究项目数:—项,其中与本项目目标疾病相同的项目数:一项。

浙江省药学会
医院药学科研专项
申请表
申请编号:
项目名称:
科研专项名称:
申请单位:
(盖章)申请日期:
浙江省药学会
二O二三年制
填表说明
一、《申请书》各项内容,应实事求是地逐项认真填写。
表达要明确、严
谨,字迹要清晰。
外来语要同时用原文和中文表达。
第一次出现的缩写词须注出全称。
如无该项内容请填“无”,各栏空格不够,均可加页。
二、汉字请用国家公布的标准简化汉字,数字请用阿拉伯数字。
研究经费以万元为单位,用阿拉伯数字表示,注意小数点。
三、《申请书》一份,请采用A4规格打印及装订。
、项目情况
二、承担单位
三、项目负责人及项目组成员
四、主要研究内容和要达到的主要指标(限800字)
六、承诺书
本单位(或个人)承诺:
本申请书中所填写的内容和资料真实、有效,如存在弄虚作假和与事实相违背的内容,由本单位(个人)承担全部责任。
申报单位(盖章)
项目负责人签字:
年月日
七、单位意见
八、合作单位意见。

尊敬的评审委员会:您好!我谨代表我们的团队向贵委员会提交本次复方制剂立项申请。
我们希望通过本次项目的研究,为我国医药事业做出贡献。
以下是我们的立项申请报告:一、项目背景与意义1. 背景随着医学科技的不断发展,药物治疗在疾病预防和治疗方面发挥着越来越重要的作用。
复方制剂作为一种新型的药物形式,将多种有效成分合理组合,以达到治疗疾病的目的。
在我国,复方制剂的研究和应用逐渐广泛,但在某些领域仍存在很大的发展空间。
2. 意义(1)提高药物治疗效果:复方制剂可以通过多种药物成分的相互作用,提高治疗效果,降低副作用。
(2)简化治疗方案:复方制剂将多种药物组合在一起,可以减少患者用药次数,提高治疗依从性。
(3)降低医疗成本:复方制剂的生产成本相对较低,可以减轻患者经济负担,提高药物可及性。
二、项目目标与研究内容1. 项目目标本次项目旨在研究一种新型复方制剂,用于治疗XX疾病,提高治疗效果,降低副作用,为患者提供更优质的药物治疗方案。
2. 研究内容(1)药物成分筛选:根据药物作用机制和临床需求,筛选出适用于复方制剂的药物成分。
(2)药物配比优化:通过实验研究,确定药物成分之间的最佳配比,以提高治疗效果和降低副作用。
(3)制剂工艺研究:探讨适用于该复方制剂的生产工艺,确保药物成分的稳定性和有效性。
(4)临床研究:进行临床试验,验证复方制剂的安全性和有效性。
三、研究计划与进度安排1. 研究阶段一(1-6个月):药物成分筛选与配比优化。
2. 研究阶段二(7-12个月):制剂工艺研究。
3. 研究阶段三(13-18个月):临床前研究。
4. 研究阶段四(19-24个月):临床试验。
四、项目预算与资金需求1. 项目总预算:人民币XX万元。
2. 资金需求说明:包括药物采购、实验材料、试验设备购置、人力资源等费用。
五、项目风险与应对措施1. 药物筛选失败的风险:通过多渠道收集药物信息,加强前期研究,降低药物筛选失败的风险。
2. 临床试验失败的风险:严格遵循临床试验规范,确保试验质量和数据可靠性,减少临床试验失败的风险。
医药项目立项申请报告一、项目背景及意义随着人口老龄化和生活方式的改变,慢性疾病的发病率不断上升,医药市场潜力巨大。
本项目旨在开发一种新型药物,用于治疗其中一种慢性疾病,填补市场空白,提高患者的生活质量和生活预期。
该药物在前期的试验中已经显示出良好的疗效和安全性,具备市场推广的潜力。
二、项目目标1.开发一种新型药物,用于治疗其中一种慢性疾病。
2.在前期试验的基础上,进一步验证该药物的疗效和安全性。
3.尽快获得药物的上市许可,并投入市场推广。
三、项目内容及工作计划1.药物研发:通过临床试验等方式,进一步验证该药物的疗效和安全性。
2.生产设备采购:根据预计的产能需求,购买所需的生产设备。
3.临床试验申请:向相关部门提交临床试验申请,获取试验批准。
4.上市许可申请:根据临床试验结果,向药品监管部门申请上市许可。
5.市场推广:根据药物的特性和目标受众,制定市场推广策略,开展相关活动。
四、项目预期效益1.经济效益:该新药物在上市后,预计将获得可观的销售收入,为公司带来丰厚的利润。
2.社会效益:该药物的上市将提高患者的生活质量,减轻他们的病痛,同时也降低了社会的医疗负担。
五、项目投资及资金筹措1.项目总投资额预计为X万元,具体包括研发费用、生产设备采购费用、临床试验费用、市场推广费用等。
2.资金筹措方式主要包括自筹资金、银行贷款、投资者投资等。
六、项目风险及对策1.研发风险:存在开发周期延长、研发失败等风险。
应加强项目管理,提高研发效率,及时调整研发策略。
2.临床试验风险:可能出现招募困难、试验失败等风险。
应加大招募力度,确保试验的顺利进行。
3.上市许可风险:可能出现审批时间延长、不被批准等风险。
应积极配合审批部门的要求,及时提供相关材料,确保申请的顺利进行。
七、项目进度计划1.第一年:药物研发及生产设备采购。
2.第二年:临床试验及上市许可申请。
3.第三年:市场推广及销售启动。
八、可行性分析1.技术可行性:现有的前期试验结果已经证明了药物的疗效和安全性。