固相反应动力学.
- 格式:doc
- 大小:53.00 KB
- 文档页数:2










固相反应动力学的研究方法固相反应动力学是一门研究固体物质内部反应速率的领域,它在材料科学、化学、地球科学等众多领域具有重要的应用价值。
本文将介绍几种常见的固相反应动力学研究方法,包括热分析法、差示扫描量热法、X射线衍射法和傅里叶变换红外光谱法。
1. 热分析法热分析法是一种常用的固相反应动力学研究方法,它通过对固体样品在一定温升速率下的质量或尺寸的变化进行定量测量,得到反应速率与温度的关系。
常见的热分析仪器包括差热分析仪(Differential Thermal Analysis,DTA)和热重分析仪(Thermogravimetric Analysis,TGA)。
通过对样品在不同温度下的变化情况进行分析,可以确定固相反应的反应特征和反应动力学参数。
2. 差示扫描量热法差示扫描量热法是一种通过测量样品与参比物在温度变化过程中的热量差异来研究固相反应动力学的方法。
它能够定量地测定样品的吸放热效应,并根据反应过程中的热量变化确定反应速率常数和反应机理。
差示扫描量热法具有高灵敏度、快速测量等优点,被广泛应用于固相反应动力学的研究。
3. X射线衍射法X射线衍射法是一种通过测量晶体或非晶体材料对入射X射线的散射强度来研究固相反应动力学的方法。
通过分析样品在反应过程中晶格结构的变化情况,可以得到反应过程的动力学信息。
X射线衍射法具有非破坏性、精确度高等优点,被广泛应用于材料的相变、合成等领域。
4. 傅里叶变换红外光谱法傅里叶变换红外光谱法是一种通过测量样品在红外辐射下的吸收光谱来研究固相反应动力学的方法。
通过分析样品在反应过程中红外吸收峰的强度和频率的变化,可以研究固相反应的进程和反应机理。
傅里叶变换红外光谱法具有快速、灵敏度高等优点,广泛应用于催化剂、能源材料等领域的研究。
总结:固相反应动力学的研究方法包括热分析法、差示扫描量热法、X射线衍射法和傅里叶变换红外光谱法。
这些方法在研究固体内部反应速率、反应机理等方面起着重要的作用,对于材料科学、化学和地球科学等领域的发展具有重要的意义。
固相Mitsunobu反应动力学研究的开题报告1. 研究背景Mitsunobu反应是一种常用于合成醇、酸、酰胺等化合物的方法,因其反应条件温和、选择性好、反应效率高而广受研究者青睐。
然而,Mitsunobu反应在某些情况下会出现基底和试剂消耗不平衡、产物不纯等问题,影响反应的可控性和实用性。
因此,对于Mitsunobu反应的反应动力学进行深入研究,对于优化反应条件、提高产物纯度和降低反应成本具有重要意义。
2. 研究目的本研究旨在探究固相Mitsunobu反应的反应动力学,明确反应条件对反应速率的影响,为优化反应条件提供理论依据。
3. 研究内容本研究将以1-环己醇和苯甲酸为模型反应物,氮杂芳香化合物为受体试剂,探究固相Mitsunobu反应的反应动力学。
主要包括以下内容:(1)合成氮杂芳香化合物受体试剂(2)固相反应条件的选择和优化(3)探究反应温度、反应时间、试剂比和催化剂用量等因素对反应速率和产物收率的影响(4)构建反应动力学模型,分析反应机理4. 研究方法(1)化学合成:采用常规有机合成方法制备反应物和氮杂芳香化合物受体试剂。
(2)固相反应:采用固相化学技术,将反应物和试剂固定在固相载体上进行Mitsunobu反应。
(3)化学分析:采用液相色谱-质谱联用技术分析反应产物结构和纯度。
(4)统计分析:通过反应动力学模型和统计分析方法对反应数据进行分析。
5. 预期结果(1)获得固相Mitsunobu反应的反应动力学数据。
(2)明确反应条件对反应速率和产物收率的影响规律。
(3)构建反应动力学模型,解释反应机理。
6. 研究意义本研究将为固相Mitsunobu反应的优化提供理论依据,有助于进一步提高反应的可控性、选择性和效率,推动Mitsunobu反应在有机合成中更广泛的应用。
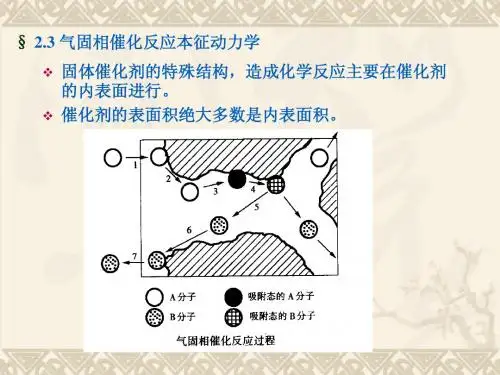
2.2.2气~固相催化反应动力学宏观动力学:工业反应器中实际反应速度(不排除外界因素影响)的动力学关系。
本征动力学(微观动力学):排除外界因素影响,进行动力学研究得出的规律。
(一)气-固相催化反应速率气~固相催化反应速度定义:单位催化剂质量(或体积),单位时间内反应物数量的变化。
()dtdN w r A A 1-=-=反应消耗A 的摩尔数/催化剂质量、反应时间()/A r -=反应消耗A 的摩尔数/催化剂体积,反应时间=dtdN V Ap 1-(2—9)Cat V p ~体积有时以单位床层体积为基准,()dtdN V r AB A 1//-=- (2—10)~B V 床层体积关系()()()BA pA A r r r ρρ///-=-=- ~p ρ催化剂密度粒子[][][]33/m mkg kg 密度质量体积=~B ρ 催化剂床层堆积密度 (二)双曲线型的反应速率式(L-H-H-W )型基本假设:①反应发生在吸附分子之间或吸附分子与气体分子之间 ②()A r -与各组分在催化剂表面上的覆盖率成正比 基本步骤:①已知:反应物,产物,设想反应机理 ②定出每种机理的动力学方程式③实验推定动力学方程式参数的最佳值 ④检验模型的准确性 (一)表面反应控制1.双分子不可逆反应 S R B A +→+ 设想机理步骤:A 的吸附:σσA ↔+A ~σ吸附位B 的吸附:σσB ↔+B表面反应:σσσσS R +→B +A (控制步骤) R 的脱附:σσ+↔R R 其它步骤达到平衡 S 的脱附:σσ+↔S A表面反应速度:()B A r A k r θθ=- r k ~反应速率常数 根据L-H 吸附模型:SS R R B B A A AA A p K p K p K p K p K ++++=1θ (2—11)SS R R B B A A BB B p K p K p K p K p K ++++=1θ (2—12)()()()21S S R R B B A A BA B A r A p K p K p K p K p p K K k r ++++=-则()21S S R R B B A A BA p K p K p K p K p kp ++++=(2—13)2.双分子可逆反应S R B A +⇔+表面反应为 σσσσS R +⇔B +A 其它吸附、脱附同不可逆反应()SR k k r θθθθ21-=-B A A()2211S S R R B B A A SR S R B A B A p K p K p K p K p p K K k p p K K k ++++-=B A K K k k 1=令()221S S R R B B A A RS S R B A p K p K p K p K p p K K k k kp kp ++++-= SR B A K K k K K k K 21=令 ()()21/S S R R B B A A S R B A p K p K p K p K K p p p p k ++++-=(2—14)k K K k K SR 21=SS R R B B A A R R R p K p K p K p K p k ++++=1θ SS R R B B A A SS S p K p K p K p K p k ++++=1θ说明:分子有两项→可逆反应分母 A 、B 、R 、S→四种物质被吸附括号上的平方项→控制步骤是三步及到两个吸附位之间的反应(双分子反应) 3.2A 在吸附时解离 +⇔B +A R 2S 与上不同的是:*2σσσσσ++⇔B +A S R 反应速率式:()V S R A A k k r θθθθθ221-=-B ~V θ裸露率整理 ()()32221/SS R R B B A A S R B A p K p K p K p K K p p p p k ++++-=(2—15)说明:分母222A →A A p K 是解离吸附 4.吸附的A 与气相的B 进行不可逆反应 S R +→B +A 机理:σσA ⇔+Aσσ++→B +A S R反应速率:()AA BA A rB A r A p K p p K k p k r +==-1θ (2—16)其中 AA AA A p K p K +=1θ5.两类不同吸附位的情况 R →B +A机理11σσA ⇔+A22σσB ⇔+B 1σ吸附A *1221σσσσ+→B +A R 2σ吸附B 22σσ+⇔R R反应速率 ()B A r A k r θθ=-其中A θRR B B BB B A A A A p K p K p K p K p K ++=+=11θ()()()R R B B A A BA A p K p K p K p kp r +++=-11 (2—17)B A r K K k k = 说明:分母两个因子→两类不同吸附位吸附(二)吸附控制 化学反应式R ⇔B +A 若A 的吸附是控制步骤设想,机理: σσA ⇔+A σσB ⇔+Bσσσσ+⇔B +A R σσ+⇔R R反应速率(为A 的净吸附速度): ()b a A r r r -=-A d V A A k p k θθ-=其余各步达平衡:V B B B p K θθ= (2—18)V R R R p K θθ= (2—19) 而:1=+++V R B A θθθθ (2—20)令BB A VR R B R B A V R r p K p K K θθθθθθθθ⎪⎪⎭⎫ ⎝⎛=代入 BA VR r K R θθθθσσσσ=∴+⇔B +A 则V BRB r R A p p K K K θθ=(2—21) V V R R B B B RB r R R B A p K p K p p K K K θθθθθ-=⎪⎪⎭⎫⎝⎛++=++1 (2—22)RR B B BRB r R V p K p K p p K K K +++=∴11θ (2—23)则()A d A A a A k p k r θθ-=- (2—24)V B RB r R d A a p p K K K k p k θ⎪⎪⎭⎫⎝⎛-= (2—25)RR B B BR B r R BR B r r d A a p K p K p p K K K p p K K K k p k ++⎪⎪⎭⎫ ⎝⎛+-=1RR B B BRRB B R A a p K p K p p K K p p p k +++⎪⎪⎭⎫ ⎝⎛-=1 (2—26)其中R b B r a K k K K k K =Br RRB K K K K =⎪⎪⎭⎫⎝⎛=B A θθθθVR r K (三)脱附控制设:R 的脱附为控制步骤:④*σσ+⇔R RR ⇔B +A (①σσA ⇔+A ②σσB ⇔+B ③σσσR →B +A ) 推导结果:()()BA AB B B A A R B A A p p K p K p K Kp p p k r +++-=-1 (2—27)式中:B A r AB K K K K =;B A r b K K K k k =;BA r b aK K K k k K =例1镍催化剂在200℃进行苯加氢反应,若催化剂的平均孔径0510d m=⨯,p,4τ=,求系统总压力为3039.3kpa时,氢在催化剂内的有效扩散系数e D。
实验四 固相反应动力学
一、目的:
1.探讨Na 2CO 3-SiO 2系统的固相反应动力学; 2.熟悉运用失重法进行固相反应的研究。
二、原理:
固态物质中的质点,在温度升高时,振动相应增大,而达到一定温度时,其中若干原子或离子具有一定的活度,以至可以跳离原来位置,与周围的其它离子产生换位作用。
在一元系统中表现为烧结的开始,如果是二元或多元系统则表现为表面相接触的物质间有新化合物的产生,亦即固相反应的存在。
这时的反应是在没有气相和液相参加的情况下进行的,反应发生的温度低于液相出现的温度。
测定固相反应速度的问题,实际上就是测定反应过程中各反应阶段的反应量的问题,因此有许多方法,对于反应中有气体产生的反应可以用重量法或量体积法即测量反应过程中生成的气体的量,进而计算出物质的反应量。
本实验是测定Na 2CO 3-SiO 2系统的固相反应速度,采用的方法是重量法,该反应式可以表示为:
Na 2CO 3+SiO 2=Na 2O ·SiO 2+CO 2↑
在反应进行的过程中,在某一温度下随时间的增长,Na 2SiO 2量增多,生成的CO 2气量也越多,若测得系统各时间下失去的CO 2的重量,则可按杨德公式的要求先算出各时间下对应的G 值,再根据杨德尔公式(1-31G -)2=K τ可求出(1-31G -)2~τ的关系曲线。
若此曲线是一直线,则表示杨德尔公式具有正确性,说明K 是常数。
二、仪器装置:
1.WZK-1可控硅温度控制器; 2.1/万光电天平; 3.管式电阻炉; 4.温控热电偶 三、操作步骤:
1.用差重法准确称取按分子量比1:1配制成的Na 2CO 3+SiO 2混合物0.3-0.4克,置于小铂金皿中(注意:不可装得太满)。
2.打开WZK 温度控制器电源开关,将黑色定温指针定于700℃,将控制开关拨到
“手
图4-1 固相反应原理图 图4-2 固相反应装置
动”位置,用调节旋扭调电压至150V ,此时炉子开始升温,当温度升到300℃时,电压加大到200V ,温度升到500℃时,将控制小开关拨到“自动”位置,炉子将继续升温。
3.炉温升到700℃,恒温10分钟,将试样小心放入炉子,记录此时间,开启天平,两分钟后开始记录失重量。
每隔5分钟读数一次记录11~12次。
4.实验结束时,先关闭天平,关闭WZK 温控器各开关。
四、数据处理:
1.按各时间测得的失重量,计算物质的转化率G ,计算方法如下: 料重=埚料总重-埚重
Na 2CO 3量=料重×
混合物分子量和
分子量
32 CO Na
总失重量=埚料总重-末次称量时埚料总重 混合物中CO 2总量= Na 2CO 3量×
分子量
分子量
322 CO Na CO
转化率G=
总量
总失重量
2 CO ×100%
2.将实验所得G 值代入杨德尔方程: (1-3
100
100G -)2
=K τ
进行计算,填入下表。
并以(1-3
100
100G -)2
为纵坐标,t 为横坐标作图。
3.从图上求出K 值。
五、注意事项
1.挂于天平上的吊丝较长,易受震动,气流的影响,实验时不准高声喧哗,来回走动。
2.坩埚与吊丝不得与炉体相碰撞。
思考题:
1.所获得的结果是否符合杨德尔方程? 2.影响本实验准确性的因素有哪些?。