第二章热力学第一定律
- 格式:doc
- 大小:412.00 KB
- 文档页数:8





第二章 热力学第一定律主要内容1.热力学基本概念和术语(1)系统和环境:系统——热力学研究的对象。
系统与系统之外的周围部分存在边界。
环境——与系统密切相关、有相互作用或影响所能及的部分称为环境。
根据系统与环境之间发生物质的质量与能量的传递情况,系统分为三类: (Ⅰ)敞开系统——系统与环境之间通过界面既有物质的质量传递也有能量的传递。
(Ⅱ)封闭系统——系统与环境之间通过界面只有能量的传递,而无物质的质量传递。
(Ⅲ)隔离系统——系统与环境之间既无物质的质量传递亦无能量的传递。
(2)系统的宏观性质:热力学系统是大量分子、原子、离子等微观粒子组成的宏观集合体。
这个集合体所表现出来的集体行为,如G A S H U T V p ,,,,,,,等叫热力学系统的宏观性质(或简称热力学性质)。
宏观性质分为两类:(Ⅰ)强度性质——与系统中所含物质的量无关,无加和性(如T p ,等); (Ⅱ)广度性质——与系统中所含物质的量有关,有加和性(如H U V ,,等)。
而强度性质另一种广度性质一种广度性质= n V V =m 如,等V m =ρ(3)相的定义:相的定义是:系统中物理性质及化学性质完全相同的均匀的部分。
(4)系统的状态和状态函数:系统的状态是指系统所处的样子。
热力学中采用系统的宏观性质来描述系统的状态,所以系统的宏观性质也称为系统的状态函数。
(Ⅰ) 当系统的状态变化时,状态函数的改变量只决定于系统的始态和终态,而与变化的过程或途径无关。
即系统变化时其状态函数的改变量=系统终态的函数值-系统始态的函数值。
(Ⅱ) 状态函数的微分为全微分,全微分的积分与积分途径无关。
即:2121X X X dX X X ∆==-⎰y yX x x X X x y d d d ⎪⎪⎭⎫⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂=(5)热力学平衡态:系统在一定环境条件下,经足够长的时间,其各部分可观测到的宏观性质都不随时间而变,此后将系统隔离,系统的宏观性质仍不改变,此时系统所处的状态叫热力学平衡态。




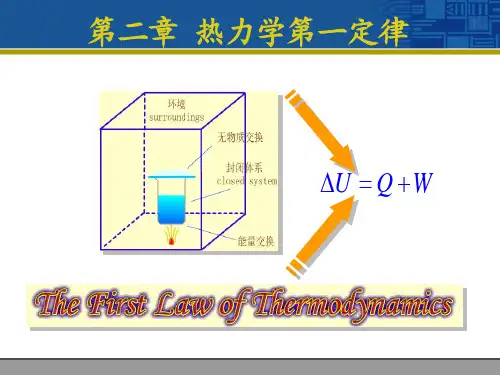

第二章热力学第一定律基本公式功: δW = -P外dV热力学第一定律: dU =δQ + δW ΔU = Q + W焓的定义: H ≡ U + PV热容的定义: C=limΔT→0δQ/ ΔT等压热容的定义: C P =δQ P /dT =(∂H/∂T)P等容热容的定义: C V =δQ V /dT =(∂U/∂T)V任意体系的等压热容与等容热容之差: C P - C V = [P + (∂U/∂V)T] (∂V/∂T)P 理想气体的等压热容与等容热容之差: C P - C V = nR理想气体绝热可逆过程方程: γ = C P / C VPVγ-1 =常数T Vγ-1 =常数P1-γTγ=常数理想气体绝热功: W =C V(T1 – T2 ) W = P1V1 – P2V2 /γ-1热机效率: η = W/Q2可逆热机效率: η = T2 – T1 / T2冷冻系数: β= Q1′/W可逆制冷机冷冻系数: β = T1 / T2 – T1焦汤系数: μ = ( ∂T/ ∂P)H = - (∂H/∂P)/C P反应进度: ξ= n B – n B0 / νB化学反应的等压热效应与等容热效应的关系: Q P = Q V + ΔnRT当反应进度ξ= 1 mol 时Δr H m= Δr U m +ΣBνB RT化学反应等压热效应的几种计算方法:Δr H m⊖=ΣBνBΔf H m⊖(B)Δr H m⊖=ΣB (єB )反应物 - ΣB(єB )产物Δr H m⊖= -ΣBνBΔC H m⊖(B)反应热与温度的关系: Δr H m(T2) =Δr H m(T1) + ∫21T TΔr C P dT表 1-1 一些基本过程的W 、Q、△U 、△H 的运算过程W Q △U △H 理想气体自由膨胀0 0 0 0 理想气体等温可逆 -nRTLnV2/V1 -nRTLnV2/V10 0任意物质等容可逆理想气体0∫C V dT∫C V dTQ v∫C V dT△U + V△P∫C P dT任意物质等压可逆理想气体-P外△V-P外△V∫C P dT∫C p dTQ P - P△V∫C V dTQ P∫C P dT理想气体绝热过程C V(T2 – T1)1/γ-1(P2V2-P1V1) 0 ∫C V dT ∫C P dT理想气体多方可逆过程PVδ=常数n R/1-δ(T2-T1) △U + W ∫C V dT ∫C P dT 可逆相变(等温等压) -P外△V Q P Q P -W Q P化学反应(等温等压) -P外△VQ PQ P – WΔr H m=Δr U m+ΣBνB RTQ PΔr H m⊖=ΣBνBΔf H m⊖(B) 例题例1 0.02Kg 乙醇在其沸点时蒸发为气体。
黄淑清《热学教程》习题解答第二章 热力学第一定律0.2kg 的氮气等压地从20℃加热别100℃,问要吸收多少热量氮气的内能增加了多少它对外界作了多少功(氮的比热容:11..04.1--=K kg kJ c p 、11..740.0--=K kg kJ c V )解:比热容 M C c m=知M c C p m p =, M c C v m V =,吸收热量:kJ T mc T C Q p m p 6.16)293373(1004.12.03,==-⨯⨯⨯=∆=∆=ν 内能增量:kJ T mc T C U vm V 8.1180)293373(740.02.0,=-⨯⨯=∆=∆=∆ν对外界作功:由 A U Q +∆= 得:kJ U Q A 8.48.116.16=-=∆-=一定量的氮在压强为Pa 51001.1⨯时的体积为1V =321000.1m -⨯,试求它在下述不同条件下体积膨胀到3221020.1m V -⨯=的过程中所发生的内能改变. (1)压强不变;(2)绝热变化。
怎样解释这两种不同条件下内能变化的不同(氦的定容摩尔热容R C m V 25,=;定压摩尔热容R C m p 27,=) 解:由理想气体物态方程 RT PV ν= 得R PVT =ν 4.12527,,===R RC C r mv m p 内能改变 )()(1122,12,V P V P RC T T C U m V m V -=-=∆ν(1)压强不变 )()(12,1122,V V P RC V P V P RC U m V m V -=-=∆J 505)1000.11020.1(1001.125225=⨯-⨯⨯⨯=-- (2)绝热变化 γγ1122V P V P = Pa V V PP 4211210825.7)(⨯==γJ V P V P RC U m V 177)1000.11001.11020.110825.7(25)(25241122,-=⨯⨯⨯-⨯⨯⨯⨯=-=∆--分别通过下列过程把标准状态下0.014kg 的氮气压缩为原体积的一半:(1)等温过程;(2)绝热过程;(3)等压过程,试分别求出在这些过程中气体内能的增量,传递的热量和外界对气体所作的功。
已知氮的R C m V 25,=。
解:(1)等温过程 内能增加 0=∆U 热力学第一定律 Q=A 对外作功J V V RT A 78621ln 27331.81028014.0ln3121-=⨯⨯⨯⨯==-ν 外界对气体作功J A 786=' 传递热量 J Q 786-=(2)绝热过程 传递热量Q=0 A U -=∆ 4.12527,,===R R C C r mv m p 906)211(114.127331.821)(11)(114.0121112111-=⎥⎥⎦⎤⎢⎢⎣⎡--⨯⨯=⎥⎦⎤⎢⎣⎡--=⎥⎦⎤⎢⎣⎡--=--r r V V r RT V V r V P A γJ 外界对气体作功J A 906=' 内能增量 J U 906=∆(3)等压过程2211T V T V = 内能增量 )1()1()(121,121,12,-=-=-=∆V VT C T T T C T T C U m v m v m v ννν J J 31042.11418)121(27331.82521⨯-=-=-⨯⨯⨯⨯=传递能量 )1()1()(121,121,12,-=-=-=V VT C T T T C T T C Q m p m p m p νννJ J 31099.11985)121(27331.82721⨯-=-=-⨯⨯⨯⨯=J U Q A 567)1418(1985-=---=∆-= 外界对气体作功J A 567='在标准状态下0.016kg 的氧气,分别经过下列过程从外界吸收了334J 的热量(1)总为等温过程,求终态体积 (2)若为等体过程,求终态压强 (3)若为等压过程 求气体内能的增量。
氧的R C m V 25,=。
解:0.016kg 氧气 mol 5.01032016.03=⨯=-ν331102.11m V -⨯= (1)等温过程 吸热 121lnV V RT Q ν= 294.027331.85.0334ln112=⨯⨯==J RT Q V V ν 终态体积 323294.012105.134.1102.11m e V V --⨯=⨯⨯== (2)等体过程 吸热 )1()1()(121,121,12,-=-=-=P PT C T T T C T T C Q m v m v m v ννν294.05225111,12⨯===-RT Q T C Q P P m v νν 终态压强 Pa P 5521013.110013.1)1294.052(⨯=⨯⨯+⨯=(3)等压过程 内能增量 T C U m v ∆=∆,ν 吸热 T C Q m p ∆=,ν mp C QT ,ν=∆ 得 J R R Q C C C QC U mp m v m p m v 6.2383342725,,,,=⨯===∆νν如图表示一个除底部外都绝热的气筒,被一位置固定的导热板隔成相等的两部分A 和B ,其中各盛有1摩尔的理想气体氮,今将334J 的热量缓慢地由底部供给气体,设活塞上的压强始终保持为Pa 51001.1⨯。
求A 部和B 部温度的改变以及各自吸收的热量。
(导热板的热容可忽略)若将位置固定的导热板换成可以自由活动的绝热板,重复上述的讨论。
解:(1)若隔板的位置固定且是导热的,则B 部吸热后按等压过程变化。
A 部既能吸收热量又向B 部放热,按等体过程变化。
A 部吸收的热量=A 部内能增加+向B 部释放的热量。
A 部等体过程 A m v A A T C U Q ∆=∆=, B 部等压过程 B m p B T C Q ∆=, 隔板是导热的 T T T B A ∆=∆=∆ A 部从底部吸收的热量为:J T R T R R T C C Q Q m p m v B A 3346)2725()(,,=∆=∆+=∆+=+A 部和B 部温度改变 K T T B A 69.631.86334=⨯=∆=∆A 部净吸收热量 J R R T R Q A A 13963342525=⨯=∆=B 部净吸收热量 J R R T R Q B B 19563342727=⨯=∆=(2)若隔板是自由活动的绝热板,则A 部吸热后按等压过程变化。
A 部B 部压强始终相等且为大气压。
B 部不吸收热量且通过活塞和外界相连,B 压强始终和外界相等不作功,所以内能不变。
A 部吸收热量=A 部内能增加+对外作功 A A m p A T R T C Q ∆=∆=27,A 部净吸收热量 J Q A 334= K T A 5.1131.827334=⨯=∆B 部隔板绝热 0=B Q 状态不变化 0=∆B T如图,用绝热壁作成一圆柱形的容器,在容器中间放置一无摩擦的、绝热的可动活塞,活塞两侧各有ν摩尔的理想气体,开始状态均为0P 、0V 、0T , 设气体定体摩尔热容m V C ,为常数,5.1=γ。
将一通电线圈放到活塞左侧气体中,对气体缓慢地加热,左侧气体膨胀同时通过活塞压缩右方气体,最后使右方气体的压强增为0827P ,问: (1)对活塞右侧气体作了多少功 (2)右侧气体的终温是多少 (3)左侧气体的终温是多少 (4)左侧气体吸收了多少热量解:由题知终态压强o P P P 82721== 力平衡。
设最终左、右侧气体压强分别为1P 和2P ,温度分别为1T 和2T ,体积分别为1V 和2V(1)过程中左侧气体对右侧气体作准静态绝热压缩功右侧气体r rV P V P 2200= 得005.1100120294)827()(V V P P V P P V r ===左侧气体对右侧气体作功 02827P P = 5.1=r 00000002200)94827(15.11)(11RT V P V P V P V P V P r A ν==--=---=(2)右侧气体绝热过程 r r rr T P T P 212010--= 得0322302110102223)827()(T T T P P T rr r =⎥⎦⎤⎢⎣⎡=⎥⎦⎤⎢⎣⎡=- (3)由(1)知0002019149422V V V V V V =-=-=由理想气体状态方程111000T V P T V P = 左侧气体最终温度 000000000111421914278T T V P V P T V P V P T === (4)思路1左方气体吸收热量不仅增加自己内能,同时还对右方气体作绝热功,绝热功增加右方气体内能。
思路2把左右气体作为研究对象,不对外做功,左侧气体吸热就是左、右气体内能的增量。
左侧气体吸收的热量 )()(02,01,21T T C T T C U U Q m v m v -+-=∆+∆=νν0,0000,419)23()421(T C T T T T C m v m v νν=⎥⎦⎤⎢⎣⎡-+-=由5.1=γ,得R C m v 2,= RT RT Q νν21924190=⨯=如图)(V T -所示为一理想气体(其γ值为已知)的循环过程,其中CA 为绝热过程。
A 点的状态参量),(11V T 和B 点的状态参量),(22V T 均为已知。
(1)试列表说明各分过程的名称,各过程中系统内能的增量U ∆、自外界吸收的热量Q 和对外界做的功A 正负。
(2)求这个循环的效率η。
解:(1)设C 点状态参量为(T 3,V 2),则有123111--=γγV T V T 2111213)(T T T V V T <<=-γ AB 为等温过程 0)(12,=-=∆T T C U m V ν0ln121>==V V RT A Q ν BC 为等体过程 0=A0)(23,<-=∆=T T C U Q m V νCA 为绝热过程 0=Q0)(31,<-=∆=-T T C U A m V ν(2) 1211lnV V RT Q Q AB ν==⎥⎦⎤⎢⎣⎡-=-=-==-1211,31,32,2)(1)()(γνννV VT C T T C T T C Q Q m V m V m V BC12121,12132,12ln )(11ln)(111V V V V RC V V RT T T C Q Q Q Q m V m V AB BC ---=--=-=-=γννη1212112121,,,ln )(1111ln )(11V V V V V V V V C C C mV m P m V -----=---=γγγη。