傅克反应及芳香族亲核取代反应简介
- 格式:pptx
- 大小:1.00 MB
- 文档页数:31

傅克反应傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。


傅克反应机理
傅克反应(Fukui Reaction) des RCies 是有名的有机化学家傅克(Kenzo Fukui)
在1950年发现的一种反应,是取代性反应的一种重要方式。
傅克反应是指将经过缩合反应由杂环结构形成的交叉饱和芳香化合物中的一个取代基
原子(电子密集基)通过反应物的绝对选择性攻击而被新的取代基(电子稀疏基)替换的
反应过程。
反应的机理是共价键的断裂,其中的绝对选择性攻击原子被新的取代基所替换,这是交叉饱和芳香化合物的取代反应的一种新机理。
根据傅克反应机理,当经过缩合反应形成的杂环结构中有一个电子密集基,而另一个
取代基是电子稀疏基,当实验室环境中添加一种电子稀疏基时,因为这种电子稀疏基的泛
电子集合体比电子密集基的泛电子集合体更优先,它会使程序中的电子密集基受到攻击,
发生电子密集基和电子稀疏基之间的亲电取代反应,从而达到取代的目的。
傅克反应的特征有:
1、反应机理是断裂共价键,使电子密集基被电子稀疏基替换。
2、在此反应中,环境中的反应物是电子稀疏基,结构中电子密集基所在的位置易受
到攻击,进而发生取代反应。
3、反应温度较低,反应进行快。
4、有时可以将结构中的电子密集基和电子稀疏基同时取代,进而实现化改造和分子
合成反应。
5、在反应过程中,当改性有机物的配位基变化时,反应的路线也可能有所不同。
傅克反应的发现和实践为一些新的化学反应开发和应用提供了新思路,为合成新的有
机化合物、多组分化合物的研究和发展提供基础。
它对有机化学的研究和发展产生了深远
的影响。

苯环和二氯甲烷的傅克反应
苯环和二氯甲烷之间的傅克反应是有机化学中的一种重要反应,它通常在惰性溶剂中进行。
该反应的反应物是苯环(C6H6)和二氯甲烷(CH2Cl2),产物是1,1-二氯环己烷(C6H10Cl2)。
傅克反应是一种亲电取代反应,涉及到一个亲电试剂(这里是二氯甲烷)和一个芳香化合物(这里是苯环)之间的反应。
傅克反应通常需要催化剂存在,常用的催化剂包括氟化铯(CsF)或氟化银(AgF)等。
傅克反应的机理如下:
1. 初始阶段,催化剂(如氟化铯)使二氯甲烷发生亲电化,生成亲电试剂CH2Cl+。
2. 芳香环(苯环)中的π电子云与亲电试剂中的亲电中心(CH2Cl+)发生反应。
亲电试剂攻击苯环中的一个氢原子,形成一个过渡态。
3. 过渡态经历重排和亲核攻击的步骤,最终生成1,1-二氯环
己烷作为主要产物。
傅克反应是一种选择性较好的反应,通常只发生单取代。
此外,傅克反应对苯环上的取代基有一定的容忍性,因此可以应用于合成有机化合物的过程中。
需要注意的是,傅克反应是一个亲电取代反应,因此在实验条件下要注意反应的安全性和操作规范,避免对实验人员造成伤害。
同时,傅克反应的条件和反应物选择也需要根据具体的实验要求进行调整。
总结起来,苯环和二氯甲烷的傅克反应是一种重要的有机合成反应,通过亲电取代的机制在苯环上引入取代基。
这一反应对于有机化学合成和功能化合物的制备具有重要意义。

有机化学反应机理2025年知识点归纳有机化学反应机理是理解有机化学的关键,它能够帮助我们解释反应为何发生、如何发生以及产物的形成。
在 2025 年,有机化学反应机理的研究和教学又有了新的进展和重点。
以下是对一些重要知识点的归纳。
一、亲电加成反应机理亲电加成反应是烯烃和炔烃的重要反应类型。
以烯烃与溴的加成反应为例,反应首先是溴分子在极性条件下发生极化,产生带正电的溴离子(Br⁺)和带负电的溴离子(Br⁻)。
带正电的溴离子作为亲电试剂进攻烯烃的双键,形成一个环状的溴鎓离子中间体。
然后,带负电的溴离子从背面进攻溴鎓离子,得到加成产物。
理解亲电加成反应机理的关键在于认识到亲电试剂的进攻和中间体的形成。
在预测反应产物时,需要考虑反应的区域选择性和立体选择性。
例如,不对称烯烃与不对称亲电试剂的加成遵循马氏规则,即氢原子加到含氢较多的双键碳原子上。
二、亲核取代反应机理亲核取代反应分为 SN1 和 SN2 两种机理。
SN1 反应通常发生在三级卤代烃中,反应分两步进行。
第一步是卤代烃解离生成碳正离子中间体,这是反应的慢步骤,也是决定反应速率的步骤。
第二步是碳正离子与亲核试剂结合得到产物。
SN1 反应的特点是有碳正离子中间体生成,可能会发生重排,并且反应速率只与卤代烃的浓度有关,与亲核试剂的浓度无关。
SN2 反应则常见于一级卤代烃,反应是一步完成的协同过程。
亲核试剂从离去基团的背面进攻碳原子,同时离去基团离去,形成新的化学键。
SN2 反应的特点是反应速率与卤代烃和亲核试剂的浓度都有关,并且构型发生翻转。
三、消除反应机理消除反应主要包括 E1 和 E2 两种机理。
E1 反应类似于 SN1 反应,分两步进行。
首先是卤代烃解离生成碳正离子中间体,然后从β碳原子上脱去一个质子生成烯烃。
E1 反应的速率也只与卤代烃的浓度有关。
E2 反应是一步完成的协同过程,碱试剂进攻β氢原子,同时卤原子离去,形成双键。
E2 反应的速率与卤代烃和碱试剂的浓度都有关。

傅克反应烷基化反应
傅克反应烷基化反应是一种芳香族亲电取代反应,可以在强路易斯酸的催化下,将烷基连接到富电子的苯环或衍生物上。
该反应主要分为两类:烷基化反应和酰基化反应。
在烷基化反应中,使用卤代烃作为烷基化试剂,而在酰基化反应中,使用酰氯或酸酐作为酰化试剂。
催化剂可以是路易斯酸,如
AlCl3、FeCl3、ZnCl2等,也可以是酸性氧化物,如TiO2、VO(acac)2等。
该反应的反应机理可以分为三步。
首先,卤代烃在路易斯酸的作用下产生碳正离子,然后芳香环进攻碳正离子,形成碳-碳键和新的碳正离子中间体。
最后,去质子化恢复芳香性,同时生成烷基化的产物。
需要注意的是,该反应的反应条件较为剧烈,可能会导致底物降解。
此外,烷基化试剂和催化剂的选择以及反应条件的优化对于提高反应的效率和选择性非常重要。

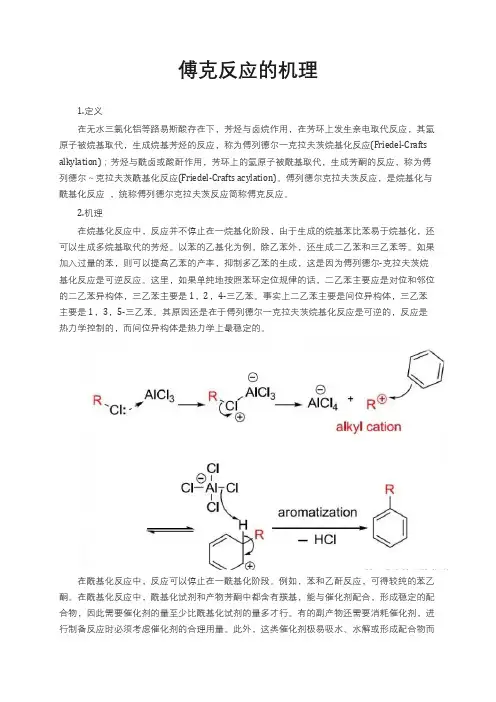
傅克反应的机理1.定义在无水三氯化铝等路易斯酸存在下,芳烃与卤烷作用,在芳环上发生亲电取代反应,其氢原子被烷基取代,生成烷基芳烃的反应,称为傅列德尔一克拉夫茨烷基化反应(Friedel-Crafts alkylation);芳烃与酰卤或酸酐作用,芳环上的氢原子被酰基取代,生成芳酮的反应,称为傅列德尔~克拉夫茨酰基化反应(Friedel-Crafts acylation)。
傅列德尔克拉夫茨反应,是烷基化与酰基化反应,统称傅列德尔克拉夫茨反应简称傅克反应。
2.机理在烷基化反应中,反应并不停止在一烷基化阶段,由于生成的烷基苯比苯易于烷基化,还可以生成多烷基取代的芳烃。
以苯的乙基化为例,除乙苯外,还生成二乙苯和三乙苯等。
如果加入过量的苯,则可以提高乙苯的产率,抑制多乙苯的生成,这是因为傅列德尔-克拉夫茨烷基化反应是可逆反应。
这里,如果单纯地按照苯环定位规律的话,二乙苯主要应是对位和邻位的二乙苯异构体,三乙苯主要是1,2,4-三乙苯。
事实上二乙苯主要是间位异构体,三乙苯主要是1,3,5-三乙苯。
其原因还是在于傅列德尔一克拉夫茨烷基化反应是可逆的,反应是热力学控制的,而间位异构体是热力学上最稳定的。
在酰基化反应中,反应可以停止在一酰基化阶段。
例如,苯和乙酐反应,可得较纯的苯乙酮。
在酰基化反应中,酰基化试剂和产物芳酮中都含有羰基,能与催化剂配合,形成稳定的配合物,因此需要催化剂的量至少比酰基化试剂的量多才行。
有的副产物还需要消耗催化剂,进行制备反应时必须考虑催化剂的合理用量。
此外,这类催化剂极易吸水、水解或形成配合物而失去催化作用。
3.反应特点(1)烷基化反应亲电试剂为碳正离子,有重排现象,故烷基化产物有异构化现象;(2)烷基化反应为可逆反应故烷基苯可进行歧化反应即一分子烷基苯脱烷基变成苯另一分子烷基苯增加烷基变成二烷基苯;(3)生成的烷基苯更容易进行烷基化反应故烷基化反应能生成多元取代产物;(4)苯环上有强吸电子基如硝基、磺基时不易发生烷基化反应。

芳香族化合物的亲核取代反应是有机化学反应中的一类重要反应,与饱和碳上的亲核取代不同处在于芳香亲核取代很少是一步反应,而大多数涉及不同的中间体,亲核试剂先同芳环加成,形成中间体络合物,然后消去一个取代基完成亲核取代反应。
该方法也被广泛应用于芳醚类聚合物的合成,单体为两类双酚单体和双卤单体。
对于亲核取代路线,由于合成中所用单体只有两个离去基团,因此亲核取代反应在缩聚过程中不会发生大分子链的支化、交联现象。
只要保证单体有足够的纯度,可得到单一的线性分子结构,可确保树脂的性能。
这比傅克反应要强很多!OH K 2CO 3+O K H 2O CO 2++O Y O +Y OY slow fast所有影响亲核体的亲核能力以及Y 离去能力的各因素都将影响到反应的难易及快慢。
在亲核取代的过程中,首先进行亲核质体的形成的反应,亲核质体产生的难易程度以及其亲核性和稳定性是络合物的形成的主要影响因素。
一般选用K 2CO 3有较好的催化效果。
碳酸盐与酚中H 质子反应生H 2O (常采用分水器甲苯为带水剂,反复抽提逐步将体系中的水蒸除)和CO 2高温可排除到体系外,可促进亲核质体的形成;K+离子半径较大,更利于O -离子的稳定。
亲核质体的亲核性和受体离去基的离去能力是决定反应快慢的主要因素。
而络合物的生成的难易程度,在很大程度上取决于反应单体的选择。
最初采用二硝基化合物与双酚的反应,由于聚合过程中生成的副产物为亚硝酸盐,一方面由于亚硝酸盐对聚合单体有氧化作用,尤其是在高温条件下,这种氧化作用加剧,破坏单体化学计量比,难于得到高分子量聚合物;另一方面,亚硝酸盐副产物会对环境产生一定的污染,因此后来,广泛的被双卤与双酚的反应所取代。
卤素电负性越大,与其相连的碳原子电正性越强,越容易受到亲核体的进攻,形成络合物的速度越快,因此芳烃卤代物的活性顺序为:F>Cl>>Br>I 。
亲核取代反应溶剂必须能够溶解单体,促进单体之间的混合与接触,降低反应体系的粘度以利于反应进行;也能够溶解或溶胀增长着的分子链,使大分子链伸展,从而有利于分子链的继续增长,使反应速率增加,分子量提高。


傅克反应药物合成傅克反应属于有机合成中的重要反应类型之一,通常被广泛应用于药物合成和材料科学等领域。
在本文中,我们将逐步介绍傅克反应的机理和其在药物合成中的应用。
一、傅克反应的机理傅克反应的本质是亲电性芳香取代反应,其基本步骤如下:1. 首先,单个亲电性取代剂(通常是卤代烷或磺酸酯等)进行亲电攻击,打开芳香环;2. 然后,一个芳香环中的π键上的另一对电子被亲电取代剂附加;3. 最后,原先的离子体失去一个负电荷并结合上一个卤化物离子生成新的化合物。
傅克反应的重要特征是,它可以在碳-碳双键和三键上发生,并且可以形成碳-碳单键和双键。
此外,该反应在酸性和碱性条件下都能进行。
二、傅克反应在药物合成中的应用由于傅克反应在药物合成中是一种十分有用的方法,因此在药物大环化合物的合成中,它经常被用到。
以下是几个傅克反应在药物合成中的应用实例:1. 吡啶类化合物吡啶类化合物是一类具有强大生化活性的大环化合物,常常被用于蛋白质抑制剂和免疫抑制剂等药物的制备。
傅克反应可以用于吡啶类化合物的制备。
其中一个典型的例子是在一项针对Bcl-xL蛋白质中心凹槽结合战略的研究中,使用傅克反应成功地合成了具有良好生物活性的吡啶衍生物。
2. 沙星类化合物沙星类化合物是一种被广泛用于动物生产以及医学领域的药物,该类药物与细菌DNA损伤的修复有关。
傅克反应可以用于沙星类化合物的制备,例如,沙星、氟氯沙星和环丙沙星等化合物。
3. 类红霉素化合物类红霉素化合物是一类具有广谱抗菌活性的化合物,由于其制备复杂,因此傅克反应被广泛用于类红霉素类化合物的制备。
例如,泰索霉素的制备中就使用了傅克反应。
三、结论傅克反应是一种非常有用的有机合成方法,广泛应用于药物合成和材料科学领域。
在药物合成中,傅克反应可以用于合成各种大环化合物,包括吡啶类化合物、沙星类化合物和类红霉素化合物等。
因此,傅克反应在药物合成研究中将发挥更加重要的作用。
傅克反应傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877 年由法国化学家查尔斯·傅里德( Friedel C)和美国化学家詹姆斯·克拉夫茨Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS 的供卤素能傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
例如,在用溴乙烷对苯的多重取代当中,由于烷基是一个活化基团,原来期待能够得到邻对位取代的产物。
傅-克反应12傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877 3年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨4(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
56傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应7傅-克烷基化反应8傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
9假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,10碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总11反应式如下:1213傅-克烷基化机理14这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更15高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化16现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基17团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时18间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间19位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正20离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空21间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化22反应。
23241,4-二甲氧基苯的叔丁基化25烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中26间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
27如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:28291-氯-2-甲基-2-苯基丙烷的合成30曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
3132通过烯烃的傅-克烷基化33在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
傅克反应加入硝基苯促进反应的原因引言傅克反应是一种常见的有机化学反应,可用于生成取代的芳香族化合物。
利用硝基苯作为催化剂加入傅克反应中,能够显著提高反应速率和产物收率。
本文将探讨硝基苯参与傅克反应并促进反应的原因。
硝基苯的结构和性质硝基苯是一种芳香族化合物,化学式为C6H5N O2。
它是一种黄色的液体,具有特殊的芳香气味。
硝基苯分子中的硝基基团(-N O2)使其具有一些特殊的化学性质,例如亲电性和电子吸引性。
傅克反应的基本原理傅克反应是一种取代反应,通常用于合成取代的芳香族化合物。
在傅克反应中,芳香族化合物与卤代烷(如溴代烷或氯代烷)在存在催化剂的条件下发生取代反应。
催化剂通常是路易斯酸,例如亚铁三氯化铝(F eC l3)。
傅克反应的机理复杂,涉及芳香族化合物的亲电取代和芳香环的亲核取代步骤。
硝基苯作为催化剂的作用硝基苯可以作为一种有效的催化剂参与傅克反应,并显著促进反应的进行。
以下是硝基苯参与傅克反应的几个原因:1.硝基苯的亲电性硝基苯分子中的硝基基团(-NO2)具有较强的亲电性。
亲电性是指分子或离子对电子的亲和力,可以促使它们参与亲电取代反应。
硝基基团的电子云密度偏低,容易从硝基苯中吸引含有富电子的亲核试剂参与取代反应。
2.硝基苯的电子吸引性硝基苯分子中的硝基基团通过电子吸引效应,可以吸引周围电子云密度较高的芳香族化合物中的电子。
这种电子吸引效应可以进一步加强亲电试剂与芳香族化合物之间的相互作用,促进反应进行。
3.硝基苯与路易斯酸的相互作用硝基苯作为一种特殊的催化剂,可以与路易斯酸形成复合物。
傅克反应中常用的催化剂亚铁三氯化铝(Fe Cl3)与硝基苯的相互作用会增强整个反应的速率和效果。
硝基苯与亚铁三氯化铝形成的复合物具有更好的催化性能,能够有效地催化反应过程。
4.硝基苯的稳定性硝基苯分子本身具有较高的稳定性,不易发生分解或其他副反应。
这种稳定性使得硝基苯可以在傅克反应中充当催化剂,并保持催化活性,从而促进反应的进行。