亲核取代
- 格式:pdf
- 大小:610.79 KB
- 文档页数:29

亲核取代反应机理
亲核取代反应是一种有机合成化学反应。
其机理基于亲核试剂(通常为碱性)攻击有机化合物中的卤化碳原子,从而将卤素原子替换为亲核试剂中的基团。
这个反应过程通常在惰性溶剂(如二甲基亚砜)中进行,并且加热会显著提高反应速率。
一般来说,亲核取代反应可以通过初始的亲核试剂的进攻路径,伴随着有机化合物分子的结构改变,逐步构建反应前体、反应中间体和反应产物的化学键。
在这个反应中,亲核试剂的缺点是被取代的卤化碳原子所产生的正电荷带动原子间的化学反应,产生新化学键。
总的来说,亲核取代反应是一种常见的有机合成技术,可以用于制备各种重要的有机化合物。
这个反应的机理和条件可以根据具体的化学实验进行调整和优化,以达到目标产物的高产率和高纯度。

有机化学基础知识点亲核取代反应的机理在有机化学领域中,亲核取代反应是一类重要的反应类型,它涉及一个亲核试剂与有机物中电子不足的位点之间的亲核攻击和断裂反应。
亲核取代反应机理的理解对于合成新颖的有机化合物以及研究有机反应有着至关重要的意义。
本文将介绍亲核取代反应的一些基础知识点,并详细解析其机理。
一、亲核试剂的选择亲核取代反应中,亲核试剂的选择通常是根据底物的特性来确定的。
常见的亲核试剂包括氢离子(H^-)、氧化物离子(O^-)、卤素离子(Cl^-、Br^-、I^-)等。
不同的亲核试剂对应着不同的反应类型和机理。
二、亲核取代反应的机理亲核取代反应的机理大致分为两步:亲核攻击和断裂反应。
1. 亲核攻击在亲核取代反应中,亲核试剂通过自身的强电子亲合性,攻击有机底物上的电子不足的位点(如C=O双键、C-X键等)。
亲核试剂的亲核攻击会导致分子内电子重新分布,形成新的共价键。
2. 断裂反应亲核攻击后,原有的化学键会发生断裂,底物分子会发生结构改变。
通常情况下,在亲核取代反应中,断裂反应是一个带有正电荷的离去基团的离去,形成新的化学键。
三、亲核取代反应的分类和示例亲核取代反应可以根据亲核试剂的种类和底物中亲电子受体的特点进行分类。
下面将以常见的亲核试剂和底物为例,介绍几种典型的亲核取代反应:1. 氢离子(H^-)的亲核取代反应氢离子亲核取代反应是有机化学中最基础的反应类型之一,常用来合成醇、胺等化合物。
例如,酯的水解反应就是氢离子亲核取代反应的一个典型例子:[示例反应方程式]2. 水氧离子(OH^-)的亲核取代反应水氧离子亲核取代反应广泛应用于合成醇、酚等化合物。
这类反应以醇的合成反应为代表,其机理与氢离子亲核取代反应类似。
3. 卤素离子(Cl^-, Br^-, I^-)的亲核取代反应卤素离子亲核取代反应是常见的有机反应类型,用于制备卤代烃等化合物。
其中,氯离子亲核取代反应最为常见。
以氯离子的亲核取代反应为例,其机理如下:[示例反应方程式]四、亲核取代反应的影响因素亲核取代反应的速度和产率受多种因素的影响,包括溶剂、温度、底物结构等。

有机化学基础知识点取代反应的机理和规律有机化学是研究有机物(含碳元素)的合成、性质和结构等方面的科学。
在有机化学中,取代反应是一种常见的反应类型,它涉及到一个原子或基团取代另一个原子或基团的过程。
了解取代反应的机理和规律是掌握有机化学基础知识的重要一环。
一、取代反应的机理1. 亲核取代反应机理亲核取代反应是指一个亲核试剂(如NH3、Br-等)攻击一个有机化合物中的亲电中心,使其离开并被亲核试剂取代的反应。
亲核试剂中的亲核部分在反应中发挥了重要作用。
亲核取代反应机理主要包括以下几个步骤:(1)亲核试剂攻击:亲核试剂中的亲核部分与有机化合物中的亲电中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲核试剂取代了一个原有基团的化合物。
2. 亲电取代反应机制亲电取代反应是指一个亲电试剂(如H+, Br+, AlCl3等)攻击一个有机化合物中的亲核中心,使其离开并被亲电试剂取代的反应。
亲电试剂中的亲电部分在反应中发挥了重要作用。
亲电取代反应机制主要包括以下几个步骤:(1)亲电试剂攻击:亲电试剂中的亲电部分与有机化合物中的亲核中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲电试剂取代了一个原有基团的化合物。
二、取代反应的规律1. Sn1和Sn2反应Sn1反应和Sn2反应是亲核取代反应中的两种常见机制。
Sn1反应是典型的两步反应,第一步是亲电离子形成,第二步是亲核试剂攻击。
Sn2反应是典型的一步反应,在反应中,亲核试剂直接攻击有机化合物中的亲电中心,并与离去基同时发生。
Sn1反应适用于三级卤化合物等离子体生成较容易的化合物;Sn2反应适用于一级卤化合物等亲电离子形成较困难的化合物。


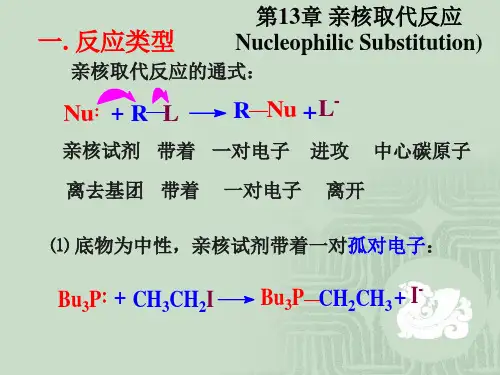
亲核取代反应亲核取代反应是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。
中文名亲核取代反应外文名nucleophilic substitution reaction别称亲核性取代反应举例单分子亲核取代反应应用学科有机化学目录.1基本性质.2反应类型.? SN1 反应.? SN2反应.3影响因素.4举例基本性质以卤代烃为例:卤素连在饱和碳原子上,碳带有部分正电荷,卤素带有部分负电荷,富电子试剂—亲核试剂(nucleophile,简写Nu)进攻带部分正电荷的碳子,亲核试剂与碳原子形成共价键,卤原子则带着一对电子以负离子的形式离去,即卤素被亲核试剂取代,这种有机分子中的原子或基团被亲核试剂取代的反应称为亲核取代反应,用S N表示。
卤代烷R—X为底物(substrate),常用“S”表示,Nu-为亲核试剂,X-为离去基团,常用“L”表示。
与离去基团相连的碳原子称为中心碳原子。
亲核试剂属于Lewis碱,可以是带负电荷的离子(如OH-、RO-、RCOO-、NO3-、NH2-、RS-、HS-、N3-、CN-、RMgX、X-等),也可以是拥有孤对电子的中性分子(如H2O、ROH、RNH2、R2NH、R3N、PPh3等)。
如果反应中所用的溶剂同时又作为亲核试剂,这样的亲核取代反应也称为溶剂解,如水解、醇解等,亲核取代反应又分为单分子亲核取代反应(S N1)与双分子亲核取代反应(S N2)。
反应类型SN1 反应第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。
由于速控步为第一步,只涉及一种分子,故称S N1 反应。
常发生于:碳上取代基较多,如:(CH3)3CX,使得相应碳正离子的能量更低,更加稳定。
同时位阻效应也限制SN2 机理中亲核试剂的进攻。
对碳阳离子生成有利条件:有许多释电子基团帮助稳定碳阳离子的正电荷(3级碳>2级碳>1级碳),一级碳几乎不能够单独存在,而会立刻发生化学反应而形成内能更低的分子。


《有机化学反应类型》亲核取代机制有机化学反应类型——亲核取代机制在有机化学的广袤领域中,亲核取代反应是一类极其重要的反应类型。
它就像是有机化学反应这个大舞台上的一位常客,频繁地登场,演绎着分子结构的变化与转化。
亲核取代反应,简单来说,就是一个亲核试剂取代了一个原子或基团的过程。
为了更好地理解这一反应,我们先来明确几个关键的概念。
亲核试剂,顾名思义,是具有亲核性的试剂。
它通常是一些带有孤对电子的分子或负离子,比如氢氧根离子(OH⁻)、氨(NH₃)、氰离子(CN⁻)等。
这些亲核试剂“虎视眈眈”地盯着有机分子中的某个位置,准备发动“进攻”。
而被取代的原子或基团呢,通常被称为离去基团。
常见的离去基团有卤素(如氯、溴、碘)、磺酸酯基等。
它们在反应中“功成身退”,为亲核试剂腾出位置。
亲核取代反应可以分为两种主要的机制:单分子亲核取代(SN1)和双分子亲核取代(SN2)。
先来说说 SN1 反应。
在 SN1 反应中,反应的第一步是离去基团自行离去,形成一个碳正离子中间体。
这个碳正离子就像是反应中的“关键人物”,它的稳定性决定了整个反应的速率。
一般来说,碳正离子越稳定,反应就越容易进行。
比如,三级碳正离子比二级碳正离子稳定,二级碳正离子又比一级碳正离子稳定。
当碳正离子形成后,亲核试剂迅速与之结合,完成反应。
由于第一步是反应的决速步,只涉及到一个分子的变化,所以被称为单分子亲核取代反应。
SN1 反应的速率通常只取决于形成碳正离子这一步的速率,与亲核试剂的浓度无关。
这就好比是一场接力赛,第一棒跑得快慢决定了整个比赛的结果,而第二棒的速度再快,也无法改变第一棒的成绩。
再来看 SN2 反应。
在 SN2 反应中,亲核试剂从离去基团的背面“悄悄接近”,然后与碳原子形成一个过渡态,同时离去基团“黯然离去”。
整个过程就像是一场“协同作战”,亲核试剂和离去基团的“进出”是同时进行的。
SN2 反应的速率与亲核试剂的浓度以及底物的浓度都有关系,因为亲核试剂和底物都参与了反应的决速步。

芳香族化合物的亲核取代反应是有机化学反应中的一类重要反应,与饱和碳上的亲核取代不同处在于芳香亲核取代很少是一步反应,而大多数涉及不同的中间体,亲核试剂先同芳环加成,形成中间体络合物,然后消去一个取代基完成亲核取代反应。
该方法也被广泛应用于芳醚类聚合物的合成,单体为两类双酚单体和双卤单体。
对于亲核取代路线,由于合成中所用单体只有两个离去基团,因此亲核取代反应在缩聚过程中不会发生大分子链的支化、交联现象。
只要保证单体有足够的纯度,可得到单一的线性分子结构,可确保树脂的性能。
这比傅克反应要强很多!OH K 2CO 3+O K H 2O CO 2++O Y O +Y OY slow fast所有影响亲核体的亲核能力以及Y 离去能力的各因素都将影响到反应的难易及快慢。
在亲核取代的过程中,首先进行亲核质体的形成的反应,亲核质体产生的难易程度以及其亲核性和稳定性是络合物的形成的主要影响因素。
一般选用K 2CO 3有较好的催化效果。
碳酸盐与酚中H 质子反应生H 2O (常采用分水器甲苯为带水剂,反复抽提逐步将体系中的水蒸除)和CO 2高温可排除到体系外,可促进亲核质体的形成;K+离子半径较大,更利于O -离子的稳定。
亲核质体的亲核性和受体离去基的离去能力是决定反应快慢的主要因素。
而络合物的生成的难易程度,在很大程度上取决于反应单体的选择。
最初采用二硝基化合物与双酚的反应,由于聚合过程中生成的副产物为亚硝酸盐,一方面由于亚硝酸盐对聚合单体有氧化作用,尤其是在高温条件下,这种氧化作用加剧,破坏单体化学计量比,难于得到高分子量聚合物;另一方面,亚硝酸盐副产物会对环境产生一定的污染,因此后来,广泛的被双卤与双酚的反应所取代。
卤素电负性越大,与其相连的碳原子电正性越强,越容易受到亲核体的进攻,形成络合物的速度越快,因此芳烃卤代物的活性顺序为:F>Cl>>Br>I 。
亲核取代反应溶剂必须能够溶解单体,促进单体之间的混合与接触,降低反应体系的粘度以利于反应进行;也能够溶解或溶胀增长着的分子链,使大分子链伸展,从而有利于分子链的继续增长,使反应速率增加,分子量提高。

有机化学基础知识点亲核取代反应的机理和规律有机化学是一门研究碳元素的化合物及其反应的学科。
其中,亲核取代反应是有机化学中一类重要的反应类型,它在有机合成、药物开发以及材料科学等领域起着关键性作用。
本文将重点介绍亲核取代反应的机理和规律,帮助读者更好地理解和应用这一有机化学基础知识点。
一、亲核取代反应的基本概念和机理亲核取代反应是一种典型的酸碱反应,即亲核试剂(通常是含有亲核试剂的阴离子)攻击了一个电子亏损的反应物,将其取代出来,形成新的化学键。
这种反应过程中,亲核试剂的亲电性中心与电子亏损的反应物的亲电性中心发生作用,从而实现取代反应。
亲核取代反应的机理可归纳为以下几个步骤:1. 亲核试剂的进攻:亲核试剂中具有亲电性的部分与电子亏损的反应物发生反应,亲核试剂的亲电性中心接近反应物的亲电性中心。
2. 形成临时五元环中间体:亲核试剂与反应物亲电性中心的结合形成一个临时的五元环中间体。
具体形成过程中,亲核试剂中的亲电性碳离子(通常是负离子)与反应物中的亲电性碳离子形成新的化学键。
3. 断裂反应物化学键:在形成临时的五元环中间体过程中,反应物中的一个化学键断裂,释放出一个亲核试剂与离去基团。
4. 形成新的化学键:离去基团离开后,亲核试剂中的亲电性碳离子与反应物中的亲电性碳离子形成新的化学键,得到产物。
二、亲核取代反应的规律和影响因素亲核取代反应的速率和产物选择性受到多种因素的影响。
下面介绍一些常见的规律和影响因素:1. 亲核试剂的选择:不同的亲核试剂具有不同的亲电性中心和亲核性,因此在不同的反应中选择适合的亲核试剂是十分重要的。
2. 电子密度和空间位阻效应:反应物中存在不同的亲电性中心时,选择攻击电子密度较高的中心更有利于反应进行。
此外,反应物或产物中的取代基团的位阻效应也会影响反应速率和选择性。
3. 溶剂选择:不同的溶剂对反应速率和产物选择性有一定影响。
一些溶剂可以稳定或降低亲核试剂的亲电性,从而影响反应速率和选择性。

有机化学基础知识点整理亲核取代反应的机理有机化学基础知识点整理:亲核取代反应的机理亲核取代反应是有机化学中一类重要的反应类型,它是指亲核试剂(通常是带有孤对电子的分子或离子)与有机化合物发生反应,将其替代掉。
本文将对亲核取代反应的机理进行整理。
一、亲核试剂的特性和作用亲核试剂一般是带有孤对电子的分子或离子,具有以下特性和作用:1. 孤对电子的存在:亲核试剂通过孤对电子攻击有机分子中的反应中心进行取代反应。
2. 拉断键:亲核试剂与反应物形成化学键时,需要拉断原有的化学键。
3. 中性或带正电:亲核试剂可以是中性分子,也可以是带正电的离子。
二、亲核取代反应的机理亲核取代反应的机理可分为三个关键步骤:亲核试剂的加入、化学键的形成和产物生成。
1. 亲核试剂的加入:亲核试剂向反应物靠近,并通过孤对电子攻击反应物中的反应中心,形成化学键。
这一步是反应的速率决定步骤。
2. 化学键的形成:在形成新的化学键的同时,原有的化学键被拉断,形成过渡态。
亲核试剂和反应物之间会发生电子重新分配的过程。
3. 产物生成:经过化学键形成和原有键的断裂后,形成了新的化学物质,即产物。
三、亲核取代反应的机制亲核取代反应的机制可以分为两种类型:S_N1和S_N2反应机制。
1. S_N1反应机制:S_N1反应机制是指亲核试剂首先取代离子化的反应物上的离去基团,然后再形成新的化学键。
其关键特点如下:- 易产生重排:由于反应物中离去基团的离去速度决定反应的速率,因此在离去基团稳定性较差的情况下,易产生重排反应。
- 两步反应:S_N1反应机制经历两个步骤,第一步是离去基团的离去形成离子化的反应物,第二步是亲核试剂与离子化的反应物发生反应。
2. S_N2反应机制:S_N2反应机制是指亲核试剂直接与反应物发生反应,形成新的化学键。
其关键特点如下:- 一步反应:S_N2反应机制只经历一个步骤,即亲核试剂与反应物同时发生反应,形成新的化学键。
- 全程立体控制:S_N2反应机制中反应的速率不仅取决于亲核试剂的浓度,还受到空间位阻的影响。
亲核取代反应一.亲核取代反应机理。
亲核取代反应是指有机分子中的与碳相连的原子或原子团被作为亲核试剂的某原子或原子团取代的反应。
反应分为SN1型(单分子取代反应),与SN2型双分子取代反应。
1.SN1型(单分子取代反应)第一步是碳原子上正电荷增加,离去基团负点性增加,经过过渡态(1)并最终解离,生成活性中间体碳正离子与离去基团负离子。
由于这一步反应的活化能较高,速率较慢,所以这一步是反应的决速步。
第二步是活性中间体的碳正离子与亲和试剂作用,生成反应产物。
这一步仅需少量能量,速率很快。
反应特点:(1)SN1反应的决速步是中心碳原子与离去基团之间化学键的异裂。
反应速率只取决于一种分子的浓度,因此,它在动力学上是一级反应。
(2)一般是一个两步反应。
第一步生成的碳正离子采取SP2杂化,是平面构型。
故若反应物的中心碳原子是手性碳,反应产物一般是一对等量的对映异构体的混合物——外消旋体。
(3)反应中间体生成的碳正离子导致反应有重排的趋势。
2.SN2型(双分子取代反应)反应中,离去基团离开中心碳原子的同时,亲核试剂与中心碳原子发生部分键合,无中间体生成。
有机反应中,将两种分子参与决速步的亲核取代反应陈伟双分子亲核取代反应。
反应特点:(1)SN2反应是一步反应,只有一个过渡态。
(2)在SN2反应中,亲核试剂进攻中心碳原子是总是从离去基团溴原子的背面沿着碳原子和离去基团连接的中心线方向进攻。
这个过程会使得碳原子与三个未参与反映的键发生翻转,这种翻转称为瓦尔登翻转,又称构型翻转。
二.影响亲核取代反应的因素1.烃基结构的影响。
对SN1反应,主要考虑碳正离子的稳定性。
对SN2反应,主要取决于过渡态形成的难易,也就是空间效应的影响。
2.离去基团的影响。
离去基团的性质对SN1和SN2将产生相似的影响:离去基团的离去能力越强,亲核取代反应越易进行。
对于离去基团:键能越弱,离去基团的稳定性越好,该离去基团的离去能力就越强。
3.亲核试剂的影响仅对SN2有影响。
亲核取代反应总结1、反应定义:亲核取代反应(Nucleophilic Substitution Reaction)是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去.2、反应意义:这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是在有机合成实际中都是极其有用的一类反应.3、反应分类:亲核取代反应的主要类型为脂肪族饱和碳上的亲核取代反应,即饱和卤代烃与亲核试剂的取代反应,较特殊结构的有苄基卤代物、烯丙基卤代物亲核反应。
其他类型还包括与酰氯、磺酸酯、磺酰卤、卤代苯等的取代反应.从电荷类型来分,亲核取代反应只能有四种类型:(1)中性底物和负离子亲核试剂反应(2)中性底物和中性亲核试剂反应(3)正离子底物和负离子亲核试剂反(4)正离子底物和中性亲核试剂反应亲核试剂包括有机和无机两类分子或离子:无机类亲核试剂:OH—、CN-、X—、H2O、NH3等有机类亲核试剂:ROH、RO—、PhO-、RS—、RMgX、RCOO-等4、反应机理类型分类:(1)双分子亲核取代反应(S N2)有两种分子参与了决定反应速率关键步骤的亲核取代反应称为双分子亲核取代反应。
反应过程中,亲核试剂从反应物离去基团的背面向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团与碳原子的键有一定程度的减弱,两者与碳原子成一条直线,碳原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,即活化能,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个键由平面向另一边偏转,整个过程犹如大风将雨伞由里向外反转一样,这时就要释放能量,形成产物,S N2反应机理一般式表示为:Nu-+R X[Nuδ-···R···Xδ- ] NuR+X—例如,溴甲烷与OH—的水解反应:(2)单分子亲核取代反应(S N1)只有一种分子参与了决定反应速率关键步骤的亲核取代反应称为单分子亲核取代反应,反应中,反应物首先解离成碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一部.当分子解离后,碳正离子马上与亲核试剂结合,速率极快,是快的一步。
亲核取代反应总结1、反应定义:亲核取代反应(Nucleophilic Substitution Reaction)是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。
2、反应意义:这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是在有机合成实际中都是极其有用的一类反应。
3、反应分类:亲核取代反应的主要类型为脂肪族饱和碳上的亲核取代反应,即饱和卤代烃与亲核试剂的取代反应,较特殊结构的有苄基卤代物、烯丙基卤代物亲核反应。
其他类型还包括与酰氯、磺酸酯、磺酰卤、卤代苯等的取代反应。
从电荷类型来分,亲核取代反应只能有四种类型:(1)中性底物和负离子亲核试剂反应(2)中性底物和中性亲核试剂反应(3)正离子底物和负离子亲核试剂反(4) 正离子底物和中性亲核试剂反应亲核试剂包括有机和无机两类分子或离子:无机类亲核试剂:OH -、CN -、X -、H 2O 、NH 3等有机类亲核试剂:ROH 、RO -、PhO -、RS -、RMgX 、RCOO -等4、反应机理类型分类:(1)双分子亲核取代反应(S N 2)有两种分子参与了决定反应速率关键步骤的亲核取代反应称为双分子亲核取代反应。
反应过程中,亲核试剂从反应物离去基团的背面向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团与碳原子的键有一定程度的减弱,两者与碳原子成一条直线,碳原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,即活化能,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个键由平面向另一边偏转,整个过程犹如大风将雨伞由里向外反转一样,这时就要释放能量,形成产物,S N 2反应机理一般式表示为:Nu -+ R X [Nuδ-···R···X δ- ] NuR + X -例如,溴甲烷与OH -的水解反应:(2)单分子亲核取代反应(S N 1)只有一种分子参与了决定反应速率关键步骤的亲核取代反应称为单分子亲核取代反应,反应中,反应物首先解离成碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一部。
亲核取代反应sn1机理
亲核取代反应(SN1)是一种重要的有机化学反应,它涉及一个步骤的离子解离和生成。
SN1反应是一种两步反应,首先是生成一个离子中间体,然后是它被亲核试剂攻击的步骤。
在SN1反应中,亲核试剂通常是一个带有孤对电子的分子或离子,例如水、醇或卤素离子。
SN1反应的机理可以从多个角度来理解。
首先,它涉及亲核试剂攻击离子中间体,这种攻击通常会导致立体化学反应。
其次,SN1反应的速率决定步骤是生成离子中间体,这意味着反应速率只依赖于底物的浓度,而与亲核试剂的浓度无关。
此外,SN1反应通常发生在次级或三级碳中心上,因为这些底物的离子中间体相对稳定。
另一个角度来理解SN1反应是通过考虑反应条件对其影响。
例如,溶剂的选择可以影响SN1反应的速率和产物选择。
极性溶剂通常会促进SN1反应,因为它们有助于离子中间体的形成和稳定。
此外,温度和反应物的结构也会影响SN1反应的速率和产物选择。
从反应动力学的角度来看,SN1反应通常表现出一级反应的特征,其速率与底物的浓度成正比。
这意味着SN1反应是一个较慢的
反应,通常在较高温度下进行以提高反应速率。
总的来说,亲核取代反应(SN1)是一个复杂而重要的有机化学反应,其机理涉及离子中间体的生成和亲核试剂的攻击。
理解SN1反应的机理对于预测其产物和优化反应条件非常重要。