脂肪族亲核取代反应
- 格式:doc
- 大小:552.00 KB
- 文档页数:15

脂肪亲核取代反应和消除反应脂肪亲核取代反应和消除反应是有机化学中两种常见的反应类型。
它们在合成有机化合物和调控分子结构方面都具有重要的意义。
下面将详细介绍这两种反应的原理、机理和应用。
一、脂肪亲核取代反应脂肪亲核取代反应是指一个亲核试剂与一个电子不足的亲电试剂反应,以形成一个新的化学键的过程。
它的原理可以归纳为以下几点:1.亲核试剂:亲核试剂具有孤对电子或自由基的特性,可以与电子不足的亲电试剂发生反应。
常见的亲核试剂包括氨、水、醇、酚、醚等。
2.亲电试剂:亲电试剂是指具有正电荷、部分正电荷、或含有亲电性官能团的化合物。
亲电试剂可以提供一个带正电荷的中心原子或原子团,使其与亲核试剂发生反应。
3.当亲电试剂与亲核试剂接近时,电子密度会发生改变,使得亲电试剂中带有正电荷的原子更容易与亲核试剂的孤对电子或自由基结合。
脂肪亲核取代反应的机理有多种类型,包括S_N2、S_N1、E1、E2等。
其中S_N2和E2是比较常见和重要的类型。
S_N2反应是指亲核试剂在一个步骤中与亲电试剂发生反应,并且亲核试剂的取代基与离开基是同时发生的。
这种反应具有一定的立体化学控制,因为亲核试剂会在空间上与亲电试剂相互作用。
E2反应也是一个一步反应,亲电试剂和亲核试剂同时发生反应,生成的产物通常是具有双键的化合物。
E2反应也具有一定的立体化学控制,因为亲核试剂和亲电试剂通常在反应中产生空间位阻。
脂肪亲核取代反应在有机化合物的合成中具有广泛的应用。
例如,它可以用于合成醇、酚、醚、胺等化合物。
通过选择不同的亲核试剂和亲电试剂,可以在分子中引入不同的官能团,从而实现有机合成的多样性。
二、脂肪消除反应脂肪消除反应是指一个有机化合物分子中的某个原子或原子团被取代,并且同时发生一个新的键的生成,以形成一个双键或三键的反应。
它的原理可以归纳为以下几点:1.碱性条件:脂肪消除反应通常需要在碱性条件下进行,以提供碱性条件下的亲核试剂。
2.去质子化:在脂肪消除反应中,亲核试剂需要先与亲电试剂结合,并从原有的结构中去除一个质子,以形成一个碳碳双键或碳碳三键。

Nu +C LNu CNu C L 亲核取代反应一. 概说: 脂肪族亲核取代反应是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中, 取代基团提供形成新键的一对电子, 而被取代的基团则带着旧键的一对电子离去(带着一对电子来, 带着一对电子去)。
底物: 受亲核试剂进攻的对象。
Nu: 是亲核试剂, 带有一对孤对电子。
与离去基团相连的碳原子叫做中心碳原子。
二.通式: R—L+Nu: R—Nu+L:亲核取代的反应速率与分类:按照机理的不同:如果反应速率只与底物浓度有关, 那么这个反应是一级反应——SN1反应。
V=k[R—L]如果反应速率除了与底物浓度有关外, 还与亲核试剂的浓度有关——SN2反应。
V=k[R—L][Nu: ]1.按照底物一亲核试剂的性质来分:1.中性底物+ 中性亲核试剂2. 中性底物+ 负离子亲核体3.正离子底物+ 中性亲核体4. 正离子底物+ 负离子亲核体2. 三.亲核取代的机理:反应速率呈现出两种情况, 为了解释这两种情况, 提出了两种机理——SN1, SN2。
3.S N2反应定义、机理、势能图定义: SN2反应又叫做双分子亲核取代反应。
有两种分子参与了决定反应速率关键步骤的亲核取代反应叫做双分子亲核取代反应。
可见该定义是从动力学角度来定义的。
机理:如图: 亲核试剂从离去基团的背面进攻底物的中心碳原子, 随着Nu: 不断接近碳原子, Nu上的负电荷逐渐减少到部分负电荷δ-, 此时由于Nu: 的不断接近C—L键不断延长L上有部分正电荷δ+, 即在Nu…C键逐渐形成, C-L键逐渐裂解这时就形成了过渡态, 这个过渡态由于5个原子所以很拥挤, 可想该过渡态的能量很高。
随着反应进行, Nu和C成键, L作为离去基团从中心碳原子上离去, 中心碳原子的杂化态也由sp2回到sp3。
特点:1) 从离去基团的背面进攻底物, 协同的一步反应。
2)没有中间体产生。
3)旧键的断裂和新键的形成几乎同时发生对过渡态的描述: 1.当Nu向C逐渐进攻的同时, L以相反的方向逐渐离去, 此过程中, Nu.............. .和L在同一直线上, 只有这样过渡态能量才能相对低。





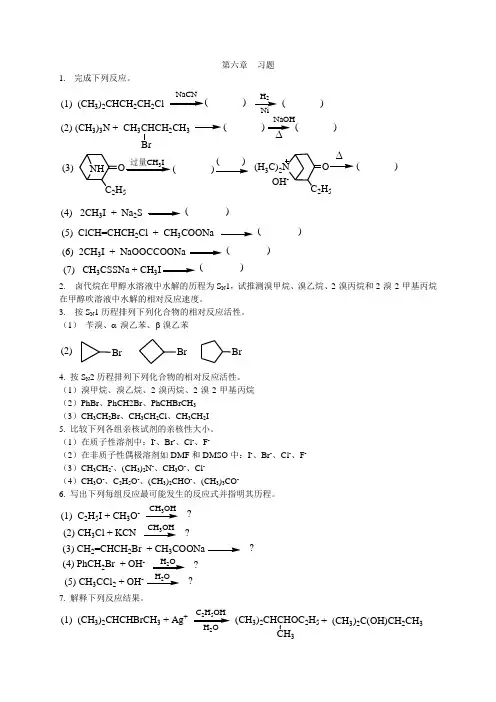
第六章习题1.完成下列反应。
(1)(CH3)2CHCH2CH2Cl2( )(2) (CH3)3N + CH3CHCH2CH3( )∆( )(3)NHC2H5过量CH3I( )( )(H3C)2N OC2H5OH-∆( )(4) 2CH3I + Na2S( )(5) ClCH=CHCH2Cl + CH3COONa( )(6) 2CH3I + NaOOCCOONa( )(7) CH3CSSNa + CH3( )2. 卤代烷在甲醇水溶液中水解的历程为S N1,试推测溴甲烷、溴乙烷、2-溴丙烷和2-溴-2-甲基丙烷在甲醇吹溶液中水解的相对反应速度。
3. 按S N1历程排列下列化合物的相对反应活性。
(1)苄溴、α-溴乙苯、β-溴乙苯(2)BrBrBr4. 按S N2历程排列下列化合物的相对反应活性。
(1)溴甲烷、溴乙烷、2-溴丙烷、2-溴-2-甲基丙烷(2)PhBr、PhCH2Br、PhCHBrCH3(3)CH3CH2Br、CH3CH2Cl、CH3CH2I5. 比较下列各组亲核试剂的亲核性大小。
(1)在质子性溶剂中:I-、Br-、Cl-、F-(2)在非质子性偶极溶剂如DMF和DMSO中:I-、Br-、Cl-、F-(3)CH3CH2-、(CH3)2N-、CH3O-、Cl-(4)CH3O-、C2H5O-、(CH3)2CHO-、(CH3)3CO-6. 写出下列每组反应最可能发生的反应式并指明其历程。
(1) C2H5I + CH3O-CH3OH?(2) CH3Cl + KCN CH3OH?(3) CH2=CHCH2Br + CH3COONa?(4) PhCH2Br + OH-H2O?(5) CH3CCl2 + OH-H2O?7. 解释下列反应结果。
(1) (CH3)2CHCHBrCH3 + Ag+252(CH3)2CHCHOC2H53+ (CH3)2C(OH)CH2CH3(2) (CH 3)3CCH 2Br + Ag +C 2H 5OH H 2O(CH 3)2C(OH)C 2H 5+ (CH 3)2C(OC 2H 5)CH 2CH 3+(CH 3)2C=CHCH 3CH 2Br-2CH 2OH+(3)8. 二战期间德国法西斯使用的战场毒气ClCH 2CH 2SCH 2CH 2Cl 是一种极活泼的烷基化试剂,与人体接触后使人体蛋白质迅速发生烷基化,从而中毒死亡。


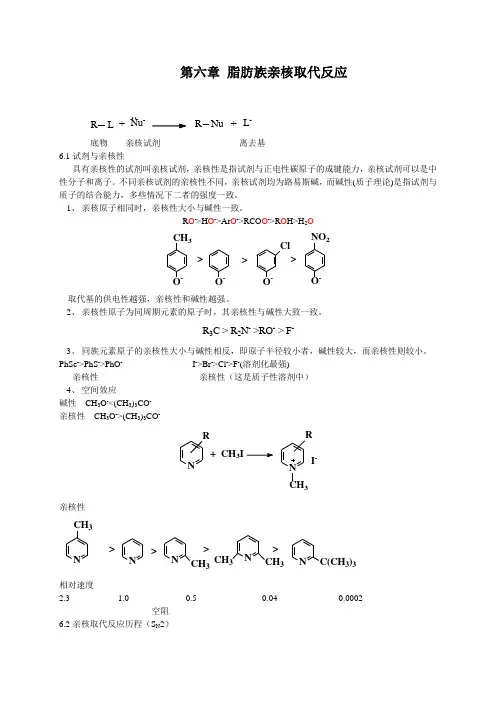
第六章 脂肪族亲核取代反应R L +Nu-R Nu +L -底物 亲核试剂 离去基6.1试剂与亲核性具有亲核性的试剂叫亲核试剂,亲核性是指试剂与正电性碳原子的成键能力,亲核试剂可以是中性分子和离子。
不同亲核试剂的亲核性不同,亲核试剂均为路易斯碱,而碱性(质子理论)是指试剂与质子的结合能力,多些情况下二者的强度一致。
1、 亲核原子相同时,亲核性大小与碱性一致。
R O ->H O ->Ar O ->RCO O ->R O H>H 2OCH 3O -O -O -Cl NO 2O ->>>取代基的供电性越强,亲核性和碱性越强。
2、 亲核性原子为同周期元素的原子时,其亲核性与碱性大致一致。
R 3C > R 2N - >RO - > F -3、 同族元素原子的亲核性大小与碱性相反,即原子半径较小者,碱性较大,而亲核性则较小。
PhSe ->PhS ->PhO - I ->Br ->Cl ->F -(溶剂化最强)亲核性 亲核性(这是质子性溶剂中) 4、 空间效应碱性 CH 3O -<(CH 3)3CO - 亲核性 CH 3O ->(CH 3)3CO -NR +CH 3I NCH 3R I -亲核性NCH 3NNCH 3NCH 3CH 3NC(CH 3)3>>>>相对速度2.3 1.0 0.5 0.04 0.0002空阻6.2亲核取代反应历程(S N 2)为协同的一步反应,新键的形成和旧键的断裂是同时进行的,亲核试剂从离去基背面进攻中心碳原子,过渡态为五配位的三角双锥构型。
NuC [Nu C X R2δ-]NuC RR 12+X -δ-+动力学上为二级反应。
单分子亲核取代反应历程(S N 1)动力学上为一级反应,因而反应速度只与反应底物有关而与亲核试剂的性质和浓度无关。
v =k 1[RX]R ++Nu-[R Nu]δ+δ-R Nu快R X[R X]R ++X-δ+δ-TS 1TS 2I两个过渡态和一个中间体。
第六章 脂肪族亲核取代反应RL +Nu-R Nu +L -底物 亲核试剂 离去基6.1试剂与亲核性具有亲核性的试剂叫亲核试剂,亲核性是指试剂与正电性碳原子的成键能力,亲核试剂可以是中性分子和离子。
不同亲核试剂的亲核性不同,亲核试剂均为路易斯碱,而碱性(质子理论)是指试剂与质子的结合能力,多些情况下二者的强度一致。
1、 亲核原子相同时,亲核性大小与碱性一致。
R O ->H O ->Ar O ->RCO O ->R O H>H 2OCH 3O -O -O -Cl NO 2O ->>>取代基的供电性越强,亲核性和碱性越强。
2、 亲核性原子为同周期元素的原子时,其亲核性与碱性大致一致。
R 3C > R 2N - >RO - > F -3、 同族元素原子的亲核性大小与碱性相反,即原子半径较小者,碱性较大,而亲核性则较小。
PhSe ->PhS ->PhO - I ->Br ->Cl ->F -(溶剂化最强)亲核性 亲核性(这是质子性溶剂中) 4、 空间效应碱性 CH 3O -<(CH 3)3CO - 亲核性 CH 3O ->(CH 3)3CO -NR +CH 3I NCH 3R I -亲核性NCH 3NNCH 3NCH 3CH 3NC(CH 3)3>>>>相对速度2.3 1.0 0.5 0.04 0.0002空阻6.2亲核取代反应历程(S N 2)为协同的一步反应,新键的形成和旧键的断裂是同时进行的,亲核试剂从离去基背面进攻中心碳原子,过渡态为五配位的三角双锥构型。
NuC [Nu C X R2δ-]NuC RR 12+X -δ-+动力学上为二级反应。
6.2.2单分子亲核取代反应历程(S N 1)动力学上为一级反应,因而反应速度只与反应底物有关而与亲核试剂的性质和浓度无关。
v =k 1[RX]R ++Nu-[R Nu]δ+δ-R Nu快R X[R X]R ++X-δ+δ-慢TS 1TS 2I两个过渡态和一个中间体。
6.3亲核取代反应的立体化学 1.S N 2历程发生Walden 转化即伞型效应C n-C 6H 13BrOH -HO CC 6H 13-nH 3+Br -[α]=-34.6 [α]=49.9+I-128I-+C n-C 6H CH 3I128IC 6H 13-nCH 3S-2-碘辛烷 R-2-碘辛烷-128I反应过程中,旋光性逐渐渐降低到零,即外消旋化v 外=2v 取2、S N 1历程碳正离子,sp 2杂化,平面结构,空p 轨道,理论是产物外消旋化.这取决于底物结构和试剂性质,通常情况是外消旋化与构型翻转同时存在。
C R 2Nu 12Nu+50%50%当形成的碳正离子稳定性较小时,当被试剂进攻时,此时离去基尚未离开,在一定的程度上产生了遮蔽效应,因而妨碍了Nu-从离去基的方向进攻,故主要得构型反转的产物;如果试剂浓度低,碳正离子可顺利成为自由离子,和离去基X -分开后才接受Nu -进攻,这时产物外消旋化。
如果进攻试剂的浓度较高,被X -遮蔽的碳正离子受试剂进攻的机会增加构型反转比例增加,在SN 1反应中,还有一些产物不是从离域的碳正离子中间体形成的,而是有离子对形成的。
离子对历程RXR +X-R +X -R ++X --N 2构型翻转紧密离子对构型翻转自由碳正离子外消旋化(100%)构型翻转 > 构型保持(部分外消旋化的同时,有部分构型翻转)溶剂分离对--Nu -S N 1底物6.4邻基参与如果亲核试剂与离去基共处于同一分子中,则发生分子内S N 2。
HO CH 2CH 2ClCa(OH)2CH 2CH 2Cl O -CH 2CH 2OClCH 2CH 2CH 2CH 2NH 2N HKOH 2离去基Cl 的离去是由氧负离子(或氮原子)的帮助下完成的,通常称为邻基协助,邻基参与或邻基效应(分子内的S N 2)条件:当邻近基团具有未共用电子对时,在与反应中心的距离适当时,就发生邻基参与。
结果:①生成环状化合物,②限制产物的结构,③反应速度异常增大。
6.4.1 n 参与 1.氧参与 包括:O -OH OCH 3OCR OC-OR O CHO CArO ,,,,,,MeO OTs CH COO -Me OAck 反/k 顺=6 反式的产物构型保持不变MeOOAc-H H OAcOTsH OAc HOAcCH 3COO -CH 3COOHk 1=2.9×10-7L.mol -1.S -1这是一个S N 2历程,由于AcO 的吸电子作用使得碳正离子的形成较困难。
OAc HHOTsOAc HHOAc CH 3COO -CH 3COOH+HOAcHOAc外消旋体k 2=1.9×10-4L.mol -1.S-1+MeOAc H HOAc H OAc OAcH OC Me50%50%镜面对称性(非手性分子)只有一个手性碳且反应中心为手性碳时,邻基参与的结果将是构型保持。
C EtEtHO C -C Et Et-OCl-Cl -C EtOMeCEtEt -O C OH 1231变成2为邻基参与(构型翻转),2变成3为S N 2反应(构型翻转,3的构型和1与底物相同)。
因此邻基参与和S N 2反应的总结果为构型保持。
C Br C O CO C CHO O -O总结果为构型保持 2.硫参与ClCH 2CH 2SCH 22ClCH 2CH 2CH CH 2-S N 22CH 2SCH 2CH 2OH 邻基参与反应速度较快3.卤素参与CH 3H OH Br HCH 3HCH 3OH Br CH 3HH CH 3Br Br CH 3H赤式dl 对赤式meso+HCH 3OH Br HCH 3H CH 3Br Br HCH 3CH 3HOH Br CH 3HCH 3HBr Br CH 3HHBr++苏式dl 对苏式dl 对H CH 3BrBr HCH 3CH 3HBr Br CH 3H+Br H CH 3HCH 3OH 3H +CH 32(2S,3S)(2S,3S)(2R,3S)(2R,3R)(2S,3S)对称性23CH (2R,3S)(2S,3S)H Br HBrCH 3CH 3mesoBrCH H 36.4.2 π参与 1.C=C 的参与AcO-AcOH构型不变k 乙酸解10111k 乙酸解113.2H 3H 3148π供电性增加,速度增加。
CONO 2NB :2.苯基参与苏式(2R,3S)进攻C进攻C3CH C C3PhOAcCH 3苏式dl(2S,3R)meso(2R,3S)(2S,3R)50%50%50%构型转化,50%构型翻转,结果为外消旋化。
赤式(2R,3R)进攻C进攻C3CCH 3C C 3PhOAcC 3赤式(2S,3S)(2R,3R)-H CH手性(2R,3R)构型保持不变。
6.5影响亲核取代反应的因素 6.5.1烃基的结构 1.对S N 1影响凡是能稳定C +的各种因素均有利于S N 1的进攻,中心碳原子上连接的供电基团,能分散碳正离子上的正电荷,提高碳正离子的稳定性。
(1)电子因素稳定性:3°R + > 2°R + > 1°R + 烷基的+I 和+C ’ S N 1的速度:3°RX > 2°RX > 1°RX (2)空间因素C XR 慢sp 2张力得到了释放sp3R'(3)苯基或乙烯基取代的卤甲烷按S N 1进行R Cl +CH 3CH 2OHS 1R OC 2H 5+HCl(4)当杂原子如O,N,S 等原子直接与中心碳相连时,按S N 1进行C 2H 5O CH 2Cl CH 3CH 2CH 2CH 2Cl C 2H 5O CH 2CH 2Clk 相对10910.2+C>-I ,有利于碳正离子的形成杂原子上的孤对电子与中心碳的空p 轨道交盖形成离域π键,使碳正离子稳定。
(5)卤原子位于桥头碳上时,只能按S N 1进行,但反应速度极慢。
25℃,80% H 2O-C 2H 5OHk 相对Me 3CBrBr110-310-710-13桥头碳难于形成平面碳正离子,刚性越大(桥原子数减小),反应速度越小。
2.S N 2的影响主要影响因素为空间效应Nu -+C RX慢(Nu C X R δ-δ-)NuC RR''+X -过渡态为五配位,张力增大因此不论是α-C 还是β-C 上的取代基增多均不利于S N 2反应。
Nu-S 2Nu R +X -R X +3空阻很大6.5.2离去基的影响不论S N 1还是S N 2的定速步骤中均存在C-X 断裂,故C-X 愈易断裂,反应速度愈快。
稳定性 F -<Cl -<Br -<I - (I -原子半径大,负电荷愈分散) 离去能力I ->Br ->Cl ->F -OH -R OH +Br -R Br +OH -为不好的离去基H +R OHR OH 2Br -R Br +H 2OH 2O 为好的离去基6.5.3试剂的影响试剂的亲核性对S N 1几乎无影响,对S N 2影响较大。
(1)亲核性越大,越有利于S N 2;(2)亲核试剂的体积越小越有利于S N 2;(3)强亲核试剂导致产物构型反转,故弱亲核试剂导致产物部分外消旋化。
6.5.4溶剂的影响1.对S N 1反应,增加溶剂极性和溶剂的离子—溶剂化能力,导致反应速度显著增大。
(1)在定速步骤中,反应物电离成过渡态所需的大部分能量可由在溶剂和极性过渡态之间形成偶极-偶极键来供给。
溶剂的极性越大,则溶剂化能力越强,电离作用越快。
(2)碳正离子或定速步骤的过渡态极性大于反应物,前者因溶剂化而稳定,极性溶剂有利于S N 1,且随着溶剂极性增强而加速。
2.对于S N 2L -Nu -+R L(Nu R L)Nu R +δ+δ-电荷分离溶剂极性增大,不利于反应;极性减小,有利于反应。
L -Nu +R L(Nu R L)NuR +δ+δ-极性增加溶剂极性增大,有利于反应。
极性降低Nu -L+R L +(Nu R L)Nu R +δ-δ+溶剂极性增大,不利于反应3.极性质子性溶剂使亲核试剂溶剂化增加亲核试剂的稳定性,降低其亲核活性。
NuR RO HNu -H H OR OR△G'3ROH Nu -+(NuR L)+δ-δ-R L △G''L△G'+△G''=△G这不利于S N 24.极性非质子溶剂如DMF,DMSO,HMPT 等,这时亲核试剂完全暴露未溶剂化,对S N 2有利的。