6章-亲核取代反应全解
- 格式:ppt
- 大小:3.92 MB
- 文档页数:166




亲核取代的反应机理亲核取代反应是有机化学中常见的一种反应类型。
这种反应是指:一个亲核试剂(通常是一个碱或是一个有机分子中的一个带负电荷的基团)进攻一个化学键上的一个有机基团,从而替换掉原来的原子或是基团。
这个反应在有机化学合成中非常重要,因为它可以用来构建新分子,并且可以控制其立体化学性质和化学反应性质。
在这篇文章中,我们将讨论亲核取代反应的机理,了解在这个反应中哪些因素会影响反应速率和选择性。
亲核取代反应的机理分为三个步骤:1)亲核进攻;2)失去离去基团;3)质子转移。
1) 亲核进攻:在亲核试剂进攻有机基团前,亲核试剂必须先与有机分子中的一个另一个原子形成一个键,这个反应称为亲核加成反应。
这样可以形成一个更好的亲核试剂,以便亲核试剂可以更容易地进攻到有机基团上。
在这个阶段,亲核试剂进攻有机基团时,该反应的速率取决于亲核试剂的浓度,相对于其反应物在反应体系中的相对位置以及反应体系的温度和压力。
2) 失去离去基团:亲核试剂进攻有机基团的结构不稳定,因为它们的电子云被扰乱了。
为了恢复这个结构稳定性,反应体系中的另外一个原子或基团必须被去除。
这个反应称为离去反应。
离去反应的速率取决于离去基团的稳定性和离去基团与碳原子之间的键的强度。
3) 质子转移:在这个阶段中,质子转移是由离去基团周围的一个质子转移到亲核试剂上。
这个反应的速率取决于质子可转移的可能性和质子从离去基团到亲核试剂转移的过度态的稳定性。
通过三个步骤的亲核取代反应可以产生一个新的有机分子,并且立体化学性质和化学反应性质可以控制。
在这个反应中,选择性是一个重要的因素,并且可以使用物化性质诸如温度、溶剂常数、极性等参数来控制反应的选择性。

有机化学中的亲核取代反应有机化学是研究碳化合物及其衍生物的科学,涵盖了广泛的知识和反应类型。
在有机化学中,亲核取代反应是一类重要的反应类型,它在有机合成中起着至关重要的作用。
本文将介绍有机化学中的亲核取代反应,包括基本概念、机理和实际应用。
亲核取代反应是一种核酸(亲核试剂)与一个带正电荷或部分正电荷的碳原子相互作用的反应。
亲核试剂指的是具有孤对电子或由共轭体系提供可用孤对电子的分子或离子。
在反应中,亲核试剂攻击带正电荷的碳原子,将其替换为亲核试剂中的原子或基团。
亲核取代反应可以分为以下几种类型:1. SN1反应(亲核取代一型):SN1反应是一种两步反应,首先发生离解步骤,生成一个离子中间体,然后亲核试剂与离子中间体发生反应。
SN1反应的速率仅取决于离解步骤,与亲核试剂无关。
2. SN2反应(亲核取代二型):SN2反应是一种一步反应,亲核试剂直接攻击带正电荷的碳原子,并将其替换。
SN2反应的速率与亲核试剂的浓度成正比。
3. SNi反应(亲核取代离解负离子反应):SNi反应类似于SN1反应,但离解步骤形成负离子中间体。
4. 过渡态化合物的亲核取代反应:过渡态化合物的亲核取代反应是一类特殊的反应,其中反应物形成一个比中间体更稳定的产物。
这种反应常见于环化合物的开环反应。
亲核取代反应在有机合成中有广泛的应用。
例如,通过SN2反应,可以合成含有新碳-亲核试剂键的化合物。
此外,亲核取代反应还可以用于合成酯、醚、胺等有机物。
通过选择适当的亲核试剂和反应条件,可以实现高效的选择性反应。
需要注意的是,亲核取代反应的机理和速率常受到多种因素的影响,包括亲核试剂的性质、反应物的结构和环境条件等。
因此,合理选择反应条件对于实现期望的反应结果非常重要。
总结起来,有机化学中的亲核取代反应是一类重要的反应类型,它在有机合成中具有广泛的应用。
通过理解亲核取代反应的基本概念和机理,我们可以更好地应用这些反应,合成有机化合物,并推动有机化学领域的进一步发展。

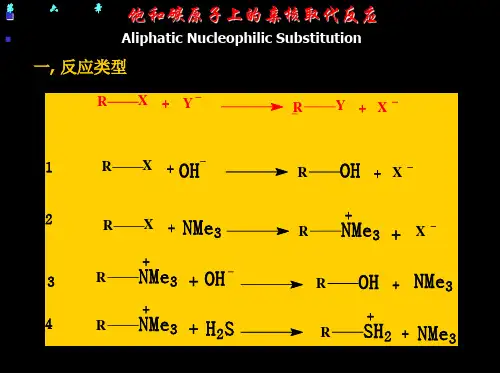
六, 卤代烃的亲核取代反应、消除反应及和金属的反应卤代烃的亲和取代和消除是有机化学中的难点,希望同学们能比较仔细地阅读本部分内容。
这里有一些内容和一般的教科书中介绍的有所不同。
6-1 卤代烃的亲核取代反应,S N1和S N2在有机化学反应中,常常把反应物分为底物和试剂。
在讨论卤代烃的反应中,卤代烃就是底物。
本节主要讨论卤代烷作为底物的取代反应。
卤代烷就是烷烃中的一个氢为卤素取代的“结构为RX(R=烷基,X=卤素)的化合物,又称为烷基卤[化物],P5。
”取代反应就是“分子中某一原子或基团被另一原子或基团替换的基元或分步反应,P86。
”卤代烷的亲核取代反应就是富电子的或带负电荷的试剂把卤代烃中卤素取代下来的反应。
这个反应在合成中非常有用。
例如:RX + Na+ -OH −→ROH + Na+X-RX + Na+ -OR’−→ROR’ + Na+X-制醚的重要方法,称为Williamson醚合成法RX + Na+ -CN −→RCN + Na+X-制腈的重要方法RX + Na+ -C≡CH −→RC≡CH + Na+X-把炔键引入分子从上面的几个反应来看,钠离子没有在反应中起作用,起作用的是-OH、-OR、-CN、-C≡CH等负离子。
是这些负离子把卤素负离子取代了下来。
在这个反应中卤代烷中的卤素是带着一对电子成为卤素负离子离去的,叫做离去基团。
如果把带负电荷的亲核试剂写成Nu-而把离去基团写成-L。
那么卤代烷的亲核取代反应就可以拓展为:R-L + Nu-−→RNu + L-这实际上可看成是一个广义的酸碱反应。
只要是带负电荷的亲核试剂Nu-的碱性比取代下来的离去基团L-的碱性强,这种反应就能发生。
亲核试剂可以是:HO-、RO-、CN-、HC≡C-、RCOO-、CH3COC-HCOOC2H5(以后会知道这就是乙酰乙酸乙酯的合成法)、C2H5OOCC-HCOOC2H5(丙二酸二乙酯合成法)……如果把上面的氧原子换成硫原子,又是一批亲核试剂。

有机化学反应方程式总结亲核取代反应亲核取代反应是有机化学中常见的一类反应。
在亲核取代反应中,亲核试剂(通常是带负电荷的离子或具有亲核性质的分子)与电子不足的溶液中的有机化合物发生反应,取代原有的官能团或取代子基。
这些反应在有机合成中具有重要的应用价值,因此对亲核取代反应的了解至关重要。
以下是几种常见的亲核取代反应及其对应的反应方程式:1. 醇的亲核取代反应醇的亲核取代反应常见的有醇的取代和醚的形成反应。
例如,溴代烷与醇发生取代反应,生成溴代醚和水。
反应方程式如下:R-OH + HBr → R-Br + H2O2. 烯烃的亲核取代反应烯烃是一类具有高度不饱和度的有机分子,容易与亲核试剂发生亲核取代反应。
例如,乙烯与溴化氢反应,发生加成反应生成溴代乙烷:CH2=CH2 + HBr → CH3CH2Br3. 酸的亲核取代反应酸的亲核取代反应是指酸与亲核试剂反应,生成酸的盐类或酯。
例如,乙酸与氨反应生成乙酰胺:CH3COOH + NH3 → CH3CONH24. 酯的亲核取代反应酯的亲核取代反应通常涉及酯键的断裂和取代。
例如,酯与碱反应生成相应的酸盐:R-COOR' + NaOH → R-COONa + R'OH5. 酰卤的亲核取代反应酰卤是一类常见的有机化合物,容易与亲核试剂发生取代反应。
例如,酰氯与水反应生成相应的酸:R-COCl + H2O → R-COOH + HCl6. 醛和酮的亲核取代反应醛和酮是有机化合物中常见的官能团,容易与亲核试剂发生取代反应。
例如,醛和酮与氨反应生成相应的胺:R1-CO-R2 + NH3 → R1-CO-NH2 + R2H上述只是亲核取代反应的一些常见例子,实际上亲核取代反应有很多不同的类型,具体的反应机理和生成物取决于反应条件和反应物的性质。
总结:亲核取代反应是有机化学中常见的反应类型,通过与亲核试剂的反应,有机化合物发生取代反应。
醇的取代反应、烯烃的加成反应、酸的盐类或酯的生成、酯键的断裂和取代、酰卤的取代反应、以及醛和酮的胺的生成等都是亲核取代反应的例子。

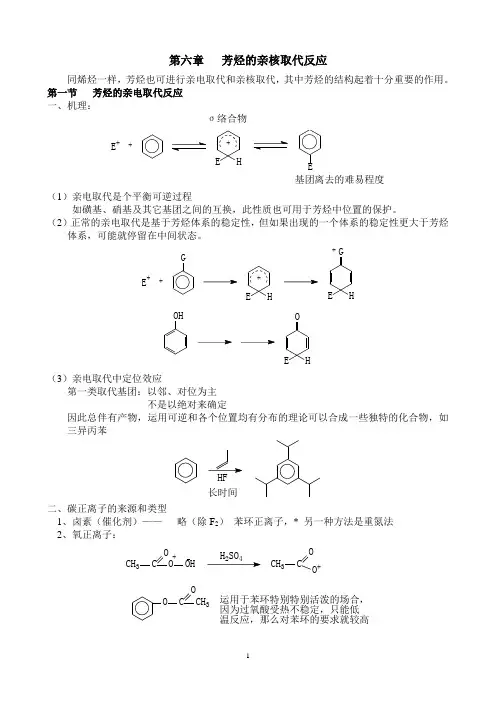
第六章 芳烃的亲核取代反应同烯烃一样,芳烃也可进行亲电取代和亲核取代,其中芳烃的结构起着十分重要的作用。
第一节 芳烃的亲电取代反应 一、机理:σ络合物E +++HE E基团离去的难易程度(1)亲电取代是个平衡可逆过程如磺基、硝基及其它基团之间的互换,此性质也可用于芳烃中位置的保护。
(2)正常的亲电取代是基于芳烃体系的稳定性,但如果出现的一个体系的稳定性更大于芳烃体系,可能就停留在中间状态。
E +++GHEGE H+OHOE H(3)亲电取代中定位效应第一类取代基团:以邻、对位为主不是以绝对来确定因此总伴有产物,运用可逆和各个位置均有分布的理论可以合成一些独特的化合物,如三异丙苯长时间二、碳正离子的来源和类型1、卤素(催化剂)—— 略(除F 2) 苯环正离子,* 另一种方法是重氮法2、氧正离子:CH 3C O O +24CH 3COO +OC OCH 3运用于苯环特别特别活泼的场合,因为过氧酸受热不稳定,只能低温反应,那么对苯环的要求就较高3、氮型正离子(i )+NO 2 硝基正离子 +NO 亚硝基正离子亚硝酸酯RO NONH 2OONH 2NO 2(ii )重氮离子 N ≡N +C l适用于苯环特别活泼的场合,理由同上+OHN N OH 偶合N N +Cl4、碳型正离子 两种形式: CH 2+(烷基化) +C=O (酰化) (i )不饱和体系在酸的催化下:(质子催化)H +CH 3C NCH 3C NH CH 3CH O H+CH 3C HOHOH +OHCH 2例:酚醛树脂的合成OHCH 2OHCH 2CH 2OH又例:氯甲基化:HCHO ,ZnCl 2,HCl其实经历了一取代过程(ii )羟基化合物的脱水,在酸性条件下OH H +(iii )卤代烷烃在路易斯酸催化 (iv )CO 2OHCH2OHOH CO2KOHOHOHCOOH起保护作用的OHOHBrOHOH5、其它正离子SOOOH磺酸型P ClCl磷型6、相互取代反应CH3OCH3CH3OCH3NO2+CH3OCH3NO2NO2第二节 芳香族的亲核取代 一、SN 2历程一般条件下,芳香族上的任何基团都稳定不易取代 此情况同烯烃但当邻、对位有强吸电子基团时,该官能团可被取代。

亲核取代反应一.亲核取代反应机理。
亲核取代反应是指有机分子中的与碳相连的原子或原子团被作为亲核试剂的某原子或原子团取代的反应。
反应分为SN1型(单分子取代反应),与SN2型双分子取代反应。
1.SN1型(单分子取代反应)第一步是碳原子上正电荷增加,离去基团负点性增加,经过过渡态(1)并最终解离,生成活性中间体碳正离子与离去基团负离子。
由于这一步反应的活化能较高,速率较慢,所以这一步是反应的决速步。
第二步是活性中间体的碳正离子与亲和试剂作用,生成反应产物。
这一步仅需少量能量,速率很快。
反应特点:(1)SN1反应的决速步是中心碳原子与离去基团之间化学键的异裂。
反应速率只取决于一种分子的浓度,因此,它在动力学上是一级反应。
(2)一般是一个两步反应。
第一步生成的碳正离子采取SP2杂化,是平面构型。
故若反应物的中心碳原子是手性碳,反应产物一般是一对等量的对映异构体的混合物——外消旋体。
(3)反应中间体生成的碳正离子导致反应有重排的趋势。
2.SN2型(双分子取代反应)反应中,离去基团离开中心碳原子的同时,亲核试剂与中心碳原子发生部分键合,无中间体生成。
有机反应中,将两种分子参与决速步的亲核取代反应陈伟双分子亲核取代反应。
反应特点:(1)SN2反应是一步反应,只有一个过渡态。
(2)在SN2反应中,亲核试剂进攻中心碳原子是总是从离去基团溴原子的背面沿着碳原子和离去基团连接的中心线方向进攻。
这个过程会使得碳原子与三个未参与反映的键发生翻转,这种翻转称为瓦尔登翻转,又称构型翻转。
二.影响亲核取代反应的因素1.烃基结构的影响。
对SN1反应,主要考虑碳正离子的稳定性。
对SN2反应,主要取决于过渡态形成的难易,也就是空间效应的影响。
2.离去基团的影响。
离去基团的性质对SN1和SN2将产生相似的影响:离去基团的离去能力越强,亲核取代反应越易进行。
对于离去基团:键能越弱,离去基团的稳定性越好,该离去基团的离去能力就越强。
3.亲核试剂的影响仅对SN2有影响。
亲核取代反应总结1、反应定义:亲核取代反应(Nucleophilic Substitution Reaction)是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去.2、反应意义:这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是在有机合成实际中都是极其有用的一类反应.3、反应分类:亲核取代反应的主要类型为脂肪族饱和碳上的亲核取代反应,即饱和卤代烃与亲核试剂的取代反应,较特殊结构的有苄基卤代物、烯丙基卤代物亲核反应。
其他类型还包括与酰氯、磺酸酯、磺酰卤、卤代苯等的取代反应.从电荷类型来分,亲核取代反应只能有四种类型:(1)中性底物和负离子亲核试剂反应(2)中性底物和中性亲核试剂反应(3)正离子底物和负离子亲核试剂反(4)正离子底物和中性亲核试剂反应亲核试剂包括有机和无机两类分子或离子:无机类亲核试剂:OH—、CN-、X—、H2O、NH3等有机类亲核试剂:ROH、RO—、PhO-、RS—、RMgX、RCOO-等4、反应机理类型分类:(1)双分子亲核取代反应(S N2)有两种分子参与了决定反应速率关键步骤的亲核取代反应称为双分子亲核取代反应。
反应过程中,亲核试剂从反应物离去基团的背面向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团与碳原子的键有一定程度的减弱,两者与碳原子成一条直线,碳原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,即活化能,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个键由平面向另一边偏转,整个过程犹如大风将雨伞由里向外反转一样,这时就要释放能量,形成产物,S N2反应机理一般式表示为:Nu-+R X[Nuδ-···R···Xδ- ] NuR+X—例如,溴甲烷与OH—的水解反应:(2)单分子亲核取代反应(S N1)只有一种分子参与了决定反应速率关键步骤的亲核取代反应称为单分子亲核取代反应,反应中,反应物首先解离成碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一部.当分子解离后,碳正离子马上与亲核试剂结合,速率极快,是快的一步。
有机化学基础知识点整理亲电和亲核取代反应亲电和亲核取代反应是有机化学中常见的两类反应类型。
在这篇文章中,我们将对亲电和亲核取代反应的基础知识进行整理和总结。
一、亲电取代反应亲电取代反应是指亲电子试剂与有机化合物中的亲核位点发生反应,形成新的化学键的过程。
亲电试剂通常具有正电荷或δ+电荷,它们能够与孤对电子或具有δ-电荷的亲核位点进行反应。
亲电取代反应主要涉及到以下几个重要的概念和知识点:1. 亲电试剂:亲电试剂可以是带正电荷的离子,也可以是带正电荷的分子。
常见的亲电试剂包括卤素化合物、酸、羧基化合物等。
亲电试剂的选择决定了反应的类型和机理。
2. 亲核位点:有机化合物中富含电子的原子或官能团被称为亲核位点,通常是孤对电子、π电子或负电荷较为集中的原子或官能团。
亲电试剂会与亲核位点发生反应,从而形成新的化学键。
3. 电子云的重排:亲电试剂与有机化合物的反应通常伴随着电子云的重排。
电子云的重排可以改变化合物的立体构型和键的位置,从而影响反应的产物。
4. 规则:亲电取代反应遵循一系列的规则和机理,例如亲电试剂的攻击方式、反应的立体化学控制等。
学习和理解这些规则对于掌握亲电取代反应至关重要。
二、亲核取代反应亲核取代反应是指亲核试剂与有机化合物中的亲电位点发生反应,形成新的化学键的过程。
亲核试剂通常具有负电荷或δ-电荷,它们能够与带正电荷或δ+电荷的亲电位点进行反应。
亲核取代反应也涉及到以下几个重要的概念和知识点:1. 亲核试剂:亲核试剂是富含电子的离子或分子,通常具有孤对电子或负电荷。
常见的亲核试剂包括氢氧根离子、醇、胺等。
亲核试剂的选择和性质决定了反应类型和机理。
2. 亲电位点:有机化合物中带正电荷或δ+电荷的原子或官能团被称为亲电位点,通常是阳离子或具有正电荷的原子或官能团。
亲核试剂会与亲电位点发生反应,形成新的键。
3. 反应机理:亲核取代反应可以通过不同的机理进行,如相邻基团迁移、加成-消除反应等。