诱导效应
- 格式:docx
- 大小:79.44 KB
- 文档页数:12


有机化学中的电子效应电子效应是影响有机化合物反应活性和反应规律的重要因素之一,深入理解有机化学中的电子效应,可以对有机化学的认识由感性向理性方向发展。
电子效应包括诱导效应、共轭效应和超共轭效应;有时三种效应同时存在,表现共同作用的综合结果。
一、诱导效应(Inductive effect )诱导效应是电子效应的一种,是由路易斯(Lewis )首先提出。
路易斯认为,对于有机化合物,诱导效应是由一个电负性较强的原子X 取代了碳原子上的氢原子后,在C -X 键上产生一个极性分布,这个极性分布通过电性诱导作用,在分子中其它键上引起一系列的极性变化,结果在整个分子中产生一个向着X 原子方向的较大范围的电子运动,这种电子运动称为诱导效应:CCδ-电负性比碳弱的元素原子也可以在分子中引起一系列的极性变化,只是所产生的诱导效应的方向刚好相反。
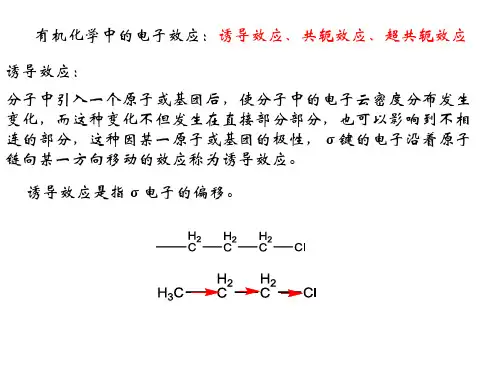
诱导效应是指在有机化合物分子中引入一个基团或原子后,由于原子的电负性差异,导致σ键电子的移动,使分子中的电子云密度分布发生变化,而这种变化不但发生在直接相连的部分,也可以影响到不直接相连的部分。
这种因某一原子或基团的极性而引起电子沿碳链向某一方向移动的效应,称为诱导效应。
如氯丙烷分子中,取代在碳上的氯原子的电负性较强, C -Cl 键产生偶极,使与氯原子连接的第一个碳原子(α-碳原子)产生部分正电荷(δ+),也使第二个碳原子带有部分正电荷,第三个碳原子带有更少的正电荷,依次影响下去。
这种影响的特征是沿着碳链传递,并随着碳链的增长而迅速减弱或消失,一般传递到第三个碳原子就可忽略不计。
诱导效应是一种静电作用,共用电子并不能完全转移到另一原子,只是电子云密度分布发生变化,亦即键的极性发生变化。
δ+ δ+ δ+ δ- CH 3—CH 2—CH 2→Cl1.静态诱导效应(I s )诱导效应分为静态诱导效应和动态诱导效应。
静态诱导效应是由分子本身结构决定的,是分子本身所固有的极化效应,与由极性溶剂或反应试剂等产生的外电场无关。

诱导效应,即因分子中原子或基团极性(电负性)不同而致使成键电子云在原子链上向某一方向移动的效应。
其本质是静电感应。
电子云偏向电负性较强的基团或原子(如氟)移动。
诱导效应的强弱程度可以通过测量偶极矩而得知,也可以通过比较相关取代羧酸的酸解离常数而大致估量。
它随距离的增长而迅速下降,故一般情况下只需要考虑三根键的影响。
诱导效应的另外一个特点是电子云是沿原子链移动或传递的,这一点与场效应不同。
诱导作用的大小一般以氢为标准进行比较:吸电子能力比氢强的基团或原子具吸电子诱导效应,用−I表示;给电子能力比氢强的基团或原子则具给电子诱导效应,用+I表示。
取代基的诱导效应强弱有如下规律:
∙同族元素中,原子序数越大,吸电子诱导效应越弱;同周期元素中,原子序数越大,吸电子诱导效应越强。
∙基团不饱和程度越大,吸电子诱导效应越强。
这是由于各杂化态中s轨道成分不同而引起的,s成分越高,吸电子能力越强。
∙正电荷基团和含配位键(直接相连)的基团具吸电子诱导效应,负电荷基团具给电子诱导效应。
∙烷基具给电子诱导效应和给电子超共轭效应。
常见基团的诱导效应顺序如下:
∙吸电子基团:NO2 > CN > F > COOH > Cl > Br > I > C≡C > OCH3 > OH >
C 6H
5
> C=C > H
∙给电子基团:(CH3)3C- > (CH3)2CH- > CH3CH2- > CH3- > H。


诱导效应、场效应、共轭效应和位阻效应在化学的奇妙世界里,有四个非常重要的概念,那就是诱导效应、场效应、共轭效应和位阻效应。
它们就像是化学舞台上的四位独特的“明星”,各自展现着独特的魅力。
先说诱导效应,这就好比是一场接力比赛中的传力棒。
在分子中,电负性不同的原子或基团会相互影响,电子云就像那接力棒一样,从电负性强的一端“传递”到电负性弱的一端。
你想想,这是不是很像一个团队中,强者带动弱者,共同前进?比如说,氯原子的电负性比氢原子大,当氯原子与氢原子相连时,电子云就会偏向氯原子,从而产生诱导效应。
场效应呢,它就像是一个神秘的磁场。
在分子中,通过空间传递的静电作用会对分子的性质产生影响。
这就好像是,即使两个人没有直接接触,但彼此的磁场也能相互影响。
比如说,羧酸根负离子的场效应,会使得羧酸的酸性发生变化。
共轭效应就像是一群手拉手的小伙伴。
分子中的电子云不再局限于两个原子之间,而是像小伙伴们手拉手一样形成了一个整体。
这使得分子的稳定性增加,性质也发生了变化。
就好比大家一起团结协作,力量就变得更强大了。
比如苯环中的共轭大π键,让苯环具有了特殊的化学性质。
位阻效应,这可有点像道路上的障碍物。
当分子中的基团过于庞大时,就会相互阻挡,影响反应的进行。
就好像你在路上遇到了大石头,挡住了你的去路,让你不得不绕路走。
比如说,在一些有机反应中,由于基团的位阻较大,反应的选择性和速率都会受到影响。
这四种效应在化学中可不是孤立存在的,它们常常相互交织,共同影响着化学反应和分子的性质。
难道这不就像一场精彩的交响乐,每个乐器都发挥着独特的作用,共同演奏出美妙的乐章?咱们在学习和研究化学的时候,如果能深刻理解这四种效应,那简直就像是拥有了一把打开化学世界大门的金钥匙。
比如说,在设计合成新的化合物时,我们可以通过考虑这些效应来预测反应的结果和产物的性质。
这不就像是未卜先知,能让我们在化学的道路上少走弯路吗?所以啊,朋友们,好好掌握这四种效应,让我们在化学的海洋中畅游,探索更多的奥秘吧!。

诱导效应和运动后效
诱导效应
诱导效应由于一个物体的运动使其相邻的静止的产生运动的现象。
比如,夜空中的月亮是静止,云是运动,如果以云为参照系,就会发现原来不会月亮就运动了,这样的现象,直接晚上看夜晚的月亮和云,这样就可以理解了。
强调相对运动。
运动后效
运动后效是在注视一个方向运动的物体之后,如果注视点转向静止的物体,那么会看到静止的物体似乎朝相反的方向运动。
比如,先注视瀑布的某一处(瀑布是往下流),在看某个静止的田野,田野上静止的一切在向上飞升。
原理在于感知这种运动的视神经会感到疲劳,出现了相反方向的现象。
举个例子:当一列火车经过时,感觉树木向反方向运动,诱导效应。
当一列火车经过后,感觉树木向反方向运动,运动后效。
最大的区别是同时发生还是先后发生。
诱导效应可以理解为物理上的相对运动。
运动后效可以理解为心理上的视觉后效。
运动后效的原理是由于感知这种运动的视觉神经会变疲劳,疲劳后的视觉由快速运动物体转为看较为慢速、较为静止物体的时候,视觉神经的感应就会出错,而人的大脑会将此解释为反方向的运动。
诱导效应中,如果只是单眼接受运动刺激,而双眼出现了运动
后效,说明运动后效不是产生于视网膜水平,而是出现在中枢或皮层。



诱导效应和共轭效应的基团1.引言1.1 概述概述诱导效应和共轭效应是有机化学中重要的概念,它们描述了基团对分子性质和化学反应的影响。
这些效应可以通过基团中电子的分布和能级重新排布来解释。
在有机化学中,分子的性质和化学反应往往受到其结构中基团的影响。
基团是分子中与主要化学反应有关的部分,它们通过共享或吸引电子的方式参与到反应过程中。
诱导效应和共轭效应描述了基团通过电子的重新分布来影响分子的性质和反应性。
诱导效应是指一个基团通过共享电子对另一个基团施加一定的电子密度或电荷的效应。
通过共享电子,基团可以增加或减少某个区域的电子密度,进而影响分子的极性和电荷分布。
这种效应可以通过电子云的极性和取向来实现。
例如,一个含有引入电子密度的基团可以通过共享电子而使周围区域的电子密度增加,从而增强其亲电性。
相反,一个含有吸引电子的基团可以通过共享电子而减少周围区域的电子密度,从而降低其亲电性。
共轭效应是指存在共轭结构的基团通过重新排布电子能级来影响分子的性质。
共轭结构是指分子中存在两个或多个相互共享电子的不饱和中心。
这些共轭结构可以具有特定的能级分布,使得分子的π电子在共轭系统中流动。
由于共轭结构的存在,分子的共振能级发生变化,导致分子的电子分布和性质发生改变。
共轭效应可以影响分子的化学稳定性、光学性质以及反应性。
本文将详细介绍诱导效应和共轭效应的基本概念、定义和解释,并通过一些实例加以说明。
同时,还将讨论它们在有机化学反应中的应用,并探讨它们对分子性质的重要影响。
最后,我们将总结这两种效应的特点和应用,并展望它们在未来有机化学研究中的潜在价值。
在接下来的章节中,我们将详细讨论诱导效应和共轭效应的定义、机制和实际应用。
我们希望本文能够帮助读者更好地理解这些基团效应,并将其应用于有机合成和反应设计中。
1.2 文章结构文章结构部分的内容可以按照以下方式来编写:文章结构本文将按照以下结构进行讨论。
首先,在引言部分(章节1)中,我们将简要介绍诱导效应和共轭效应的概念,并明确本文的目的。

诱导效应(inductive effect)★★★由于成键原子的电负性不同,而使整个分子的电子云沿着碳链向某一方向移动的现象叫诱导效应。
用符号I表示,“→”表示电子移动的方向。
例如:氯原子取代了烷烃碳上的氢原子后。
由于氯的电负性较大,吸引电子的能力较强,电子向氯偏移,使氯带部分负电荷(δ)、碳带部分正电荷(δ)。
带部分正电荷的碳又吸引相邻碳上的电子,使其也产生偏移,也带部分正电荷(),但偏移程度小一些,这样依次影响下去。
诱导效应沿着碳链移动时减弱得很快,一般到第三个碳原子后,就很微弱,可以略而不计。
为了判断诱导效应的影响和强度,常以碳氢化合物的氢原子作为标准。
一个原子或基团吸引电子的能力比氢强,就叫吸电子基。
由吸电子基引起的诱导效应为负诱导效应,用-I表示。
一个原子或基团吸引电子的能力比氢弱,就叫斥电子基。
由斥电子基引起的诱导效应为正诱导效应,用+I表示。
R C ← Y R C - H R C → X+I效应比较标准-I效应下面是一些原子或基团诱导效应的大小次序:吸电子基团:NO>CN>F>Cl>Br>I>C≡CH>OCH>C H>CH=CH>H斥电子基团:(CH)C>(CH)CH>CH CH>CH>H上面讲的是由未起反应的分子所表现出来的诱导效应叫做静态诱导效应,它是分子固有的性质。
在起化学反应时,分子的反应中心如受到极性试剂的进攻,键的电子云分布将受到试剂电场影响而发生变化,即引起诱导极化或者说加深了键的极化而导致分子的活化。
这种改变与外界电场强度和键的极化能力有关。
分子在试剂电场影响下所发生的诱导极化是一种暂时现象,只有在进行化学反应的瞬间才表现出来。
这种由于外界电场引起的诱导极化效应叫动态诱导效应。
诱导效应可以说明分子中原子间的相互影响。
例如:氯原子取代乙酸的α-H后,生成氯乙酸,由于氯的吸电子作用通过碳链传递,使羟基中O-H键极性增大,氢更易以质子形式解离下去,从而酸性增强。
所以ClCH COOH的酸性强于CH COOH的酸性。
诱导效应力学嘿,朋友!咱们来聊聊诱导效应和力学这俩看似高深,其实挺有趣的玩意儿。
你知道吗?诱导效应就像是一场看不见的“影响力大赛”。
比如说,在一个分子大家庭里,原子们就像个性不同的兄弟姐妹。
有的原子特别有“魅力”,能把电子紧紧吸引在自己身边,这就形成了电负性较大的原子。
而当这样的原子和其他原子手拉手组成分子时,它的“魅力”就会发挥作用,把共用的电子对拉向自己这边。
这就好像是一个有权威的大哥,大家都愿意听他的,电子们也不例外,都往他那边靠。
这会造成啥结果呢?就会让分子内部的电荷分布不再均匀啦!就像在一个班级里,如果老师总是偏爱某些同学,那整个班级的氛围和关系不就变得不平衡了嘛。
再来说说力学。
力学啊,就像是生活中的各种“力量较量”。
想象一下,你推一个大箱子,得用多大的力气才能推动它?这就是力学在起作用。
力的大小、方向、作用点,每一个都至关重要。
诱导效应和力学之间也有千丝万缕的联系呢!比如说,在一些化学反应中,因为诱导效应,原子之间的结合力会发生变化。
这就好像原本两个好朋友,因为其中一个人的性格变了,他们之间的关系也变得不一样了。
举个例子,有机化学里的一些反应,因为诱导效应,化学键的强度会改变,就像拔河比赛中绳子的某一端突然多了几个人帮忙,力量的平衡被打破了。
咱们生活中也到处都有诱导效应和力学的影子。
比如,你骑自行车的时候,脚蹬子的力量传递到链条上,这链条的拉力不就是一种力学现象吗?而自行车零件材质的不同,导致它们对力的承受和传递能力不一样,这是不是有点像诱导效应里原子的电负性差异呢?还有啊,建筑结构中,梁柱的受力分析,那可是力学的大舞台。
而材料的选择,不同材料的特性,就好比诱导效应中原子的“个性”。
总之,诱导效应和力学虽然看起来很复杂,但只要咱们细心观察,就会发现它们无处不在,影响着我们生活的方方面面。
难道不是吗?它们就像是隐藏在幕后的神秘力量,默默推动着这个世界的运转。
所以,多去了解它们,能让咱们更好地理解这个奇妙的世界哟!。
电子效应:诱导效应、共轭效应、场效应等一.诱导效应1.基础知识存在于不同的原子形成的极性共价键中如:X d- ←A d+在多原子分子中,这种极性还可以沿着分子链进行传递X d- ←A d+ ←B dd+ ←C ddd+Y d+→A d- →B dd- →C ddd-由于原子或原子团电负性的影响,引起分子中电子云沿σ键传递的效应称为诱导效应。
这种效应经过三个原子后其影响就很小诱导效应的方向,是以氢原子作为标准。
用-I表示Y d+ →d-CR3H—CR3 X d- ←d+CR3+I效应比较标准-I 效应+I诱导效应与-I诱导效应相反。
具有+I效应的原子或原子团与碳原子成键后,可使电子云偏向该碳原子。
正诱导效应用+I表示。
例:C H3C H3C CH H常见的具有+I 效应的基团有:―O―>(CH3)3C―>(CH3)2CH―>CH3CH2―>CH3―>D―常见的具有-I效应的基团有:―CN,―NO2>―F >―Cl >―Br >―I >RO―>C6H5―>CH2=CH―一般来说,诱导效应的强弱变化有以下规律:A.同一族的元素随着原子层的增加而吸电子诱导效应降低。
如:—F > —Cl > —Br > —I—OR > —SR—NR2 > —PR2B.同一周期的元素从左到右吸电子诱导效应增加。
如:—F > —OR > —NR2 > —CR3C.不同杂化状态的碳原子以s轨道成分多者吸电子能力强。
(sp>sp2>sp3)反映在基团方向时,如:D.带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。
与硫直接相连的原子,具有共价键,有强的吸电子诱导效应。
上面为静态分子中所表现出来的诱导效应,称静态诱导效应,它仅与键本身的极性有关。
另外,在化学反应中,由于分子受到许多外界条件的影响,例另一分子的影响,其它进攻试剂的影响,溶剂的影响等等。
在外界电场的作用下,分子会发生诱导极化,这种在外界电场影响下在化学反应时才表现出来的诱导效应称为动态诱导效应。
高中化学奥林匹克竞赛辅导元素电负性表电子效应电子效应分为诱导效应、共轭效应、超共轭效应、场效应。
一、诱导效应诱导效应是电子效应的一种,是由路易斯首先提出的。
诱导效应是指在有机化合物分子中由于原子的电负性差异,导致σ键电子的移动,使分子中的电子云密度分布发生变化。
这种因分子中原子或基团的极性(电负性)不同而引起成键电子对向电负性大的方向移动的现象称为诱导效应,其特点是能沿分子链传递且迅速减弱。
如氯丁烷分子中,取代在碳原子上的氯原子的电负性较强,C-Cl键产生偶极,使与氯原子连接的第一个碳原子(α–C)产生部分正电荷(δ+),也使第二个碳原子(β-C)带有部分正电荷,第三个碳原子(γ-C)带有部分更少的正电荷,依次影响下去。
这种影响的特征是沿着碳链传递,随着碳链的增长而迅速减弱,一般传递到第三个碳原子这种影响就忽略不计了。
(其中δ表示微小,δδ表示更微小,依次类推)诱导效应是一种静电作用,共用电子并不能完全转移到另一原子上,只是电子云密度分布发生变化,即键的极性发生变化。
由极性键所表现出的诱导效应称作静态诱导效应( Is),而在化学反应过程中由于外电场(如溶剂、试剂)的影响而产生键的极化称作动态诱导效应(Id)。
实验测得原子或基团的吸电子能力顺序为:1.吸电子诱导效应(–I)和给电子诱导效应(+I)静态诱导效应通常采用烷烃H-CR3上的氢作为比较标准,规定其为0。
如果用电负性较碳原子小的Y取代了H-CR3上的氢原子,化合物Y-CR3中-CR3部分的电子云密度比H-CR3中大,Y 叫做给电子基团。
由给电子基团引起的诱导效应叫做给电子诱导效应(+I)。
如果用电负性较碳原子大的X取代了H-CR3上的氢原子后,化合物X-CR3中-CR3部分的电子云密度比在H-CR3中的小,X叫做吸电子基团。
由吸电子基团引起的诱导效应叫做吸电子诱导效应(–I)。
2.吸电子诱导效应(–I)和给电子诱导效应(+I)的相对强度静态诱导效应的强弱与取代基或原子的电负性强弱相关。
诱导效应目录[隐藏]概述简史诱导效应的产生诱导效应的递降率诱导效应指数番茄叶挥发性物质诱导效应[编辑本段]概述诱导效应是指在有机分子中引入一原子或基团后,使分子中成键电子云密度分布发生变化,从而使化学键发生极化的现象,称为诱导效应(Inductive Effects)。
在有机化合物分子中,由于电负性不同的取代基(原子或原子团)的影响,使整个分子中的成键电子云密度向某一方向偏移,使分子发生极化的效应,叫诱导效应。
诱导效应的特征是电子云偏移沿着ζ键传递,并随着碳链的增长而减弱或消失。
例如,醋酸是弱酸(pKi=4.76),醋酸分子中的α-碳原子上引入一个电负性比氢强的氯原子后,能使整个分子的电子云向氯原子偏移,结果增强了羟基中氢原子的质子化,使一氯醋酸成为强酸(pKi=2.86,酸性比醋酸强)。
比较各种原子或原子团的诱导效应时,常以氢原子为标准。
吸引电子能力(电负性较大)比氢原子强的原子或原子团(如—X、—OH、—NO2、—CN等)有吸电子的诱导效应(负的诱导效应),用-I表示,整个分子的电子云偏向取代基。
吸引电子的能力比氢原子弱的原子或原子团(如烷基)具有给电子的诱导效应(正的诱导效应),用I表示,整个分子的电子云偏离取代基。
在诱导效应中,一般用箭头“→”表示电子移动的方向,表示电子云的分布发生了变化。
诱导效应是一种短程的电子效应,一般隔三个化学键影响就很小了。
诱导效应只改变键内电子云密度分布,而不改变键的本性。
在分子中各相邻的共价键上以静电诱导方式引起的各价电子对的偏移(ζ 键电子的偏移)。
诱导效应在有机化学中是一个非常重要的理论,它在研究有机化合物的结构、有机反应机理和有机合成中起很重要的作用。
[编辑本段]简史1923年G.N.路易斯首先提出取代基团吸引或释放电子的作用可以在整个分子中的各键上引起价电子对移动的概念。
C.K.英戈尔德等将常见的基团和原子排列成一个诱导效应强弱的定性序列。
还有不少科学工作者根据化合物的物理化学性质、反应平衡常数和速率常数等方面的大量实验结果,提出了各种基团特性常数,以定量或半定量地表达基团的诱导效应强弱。
其中最著名的是L.P.哈米特的取代常数ζ(见哈米特方程)和R.W.塔夫脱的极性取代常数ζ*。
1962年蒋明谦和戴萃辰认为诱导效应不仅与成键原子的电负性有关,还与键长有关,并根据原子的电负性及其共价半径,提出用诱导效应指数来定量地表示基团的诱导效应强弱。
[编辑本段]诱导效应的产生诱导效应是由于一个共价键的价电子对在两原子间的不对称状态(键的极性状态),或由于一个成键原子带有电荷所引起。
一个共价键价电子对的不对称共用状态是由这两个成键原子的电负性不同引起的。
例如在氯乙烷分子中由于氯的电负性比碳大,Cl─C键中共用电子对偏向氯原子,并由此使相邻碳-碳键本来应是对称共用的电子对也往氯原子方向偏移,使碳-氢键已偏向碳原子的不对称共用电子对向碳原子进一步偏移。
当分子处于外界极化电场中,如发生化学反应的瞬间,外来的极性中心接近分子时,或分子处于静电场中,此时分子中的共价电子对的正常分布也可能发生改变。
这种由于外来因素引起的电子分布状态的改变,叫做诱导极化作用,或叫动态诱导效应。
这种作用决定于分子中价键的极化率和外界极化电场的强度。
以氢为基准,根据原子或基团是吸收电子的或给电子的,诱导效应可分吸电子诱导效应和给电子诱导效应二类。
上例中氯原子就具有吸电子诱导效应。
[编辑本段]诱导效应的递降率诱导效应是一种静电诱导作用,其作用随所经距离的增大而迅速减弱。
诱导效应在一个ζ 键体系中传递时,一般认为每经过一个链上原子,即降低为原来的约三分之一。
通常以ε或1/α来表示递降率。
经过n个原子后,其诱导效应只有原来的(1+α)n。
一般认为,经过三个原子后诱导作用可忽略。
[编辑本段]诱导效应指数化学活性的定量尺度——“诱导效应指数”1962年蒋明谦和戴萃辰提出诱导效应指数的新概念和计算任何一个非共轭化合物性能的方法:任何一个基团的诱导效应指数(I),都可以表征为原子B本身对A—B键的影响(i0),B上所带基团或原子对A—B键的累积影响(i),以及B上所带原子或基团的电荷(i±)之和:(公式见图片)式中δ/r为极性强度,δ为两个成键原子电负性之差与电负性之和的比值,r为键长,1/α(=0.3)为诱导效应传递中的递降率,±N为原子或基团所带的电荷,r′为荷电原子的共价半径。
从这几个基本参数出发可以计算任何类型的非共轭化合物的分子结构与化学活性间明确而简单的定量关系:诱导效应指数(I)与化学活性(P),包括反应能量,反应速度常数的对数以及反应平衡常数的对数成直线关系;反应生成物产率(%)与诱导效应指数(I)成S形曲线关系。
这种方法的特点是用原子电负性表达基团电负性,是根据分子结构最根本的原子特性来计算基团常数。
虽然布朗斯台德(Bronsted)、哈梅特(Hammett)以及塔夫脱(Taft)等化学家在三十年代已经提出了某些基团常数,但都是由实验个别指定的。
诱导效应指数的研究论文和专著发表之后,引起国内外广泛重视。
1963年美国柯亨(Cohn)等主编的《物理有机化学的进展》第二卷中详细引证了这项成果,并指出“蒋戴文中列举的大量物化性质的数据以及诱导效应指数I与Taftζx之间有很好的关联,都表明这篇论文值得重视……”1984年美藉华裔学者凌宁博士在他著的《生命的科学基础》一书中详细介绍了这个理论,并给予很高的评价。
他写道:“蒋和戴以最基本的方式对诱导效应进行了探讨。
他们不仅提出了一整套新的,叫作诱导效应指数的常数,而且提供了计算任何基团的诱导效应指数的方法和公式,所依据的则是原子的电负性和共价键的键长等一些已知的参数。
”“蒋和戴关于诱导效应的研究,最引人注目的方面是它用于反应速度和平衡的预测的普适性。
”1 964—1987年国内外陆续发表的引用诱导效应指数的论文已有30余篇,广泛用于萃取剂、杀虫剂、杀草剂、缓蚀剂以及抗癌药物的研究中,对选择有效化合物以及预测反应速度和百分产率,起到了理论指导作用。
[编辑本段]番茄叶挥发性物质诱导效应以Nd┗3+┛诱导番茄叶,测定其对番茄叶挥发性物质组成和含量的影响. 结果表明,番茄叶经60 m g·L┗-1┛Nd┗3+┛诱导120 h后,挥发性物质的总含量较对照组的增加57%;氧合脂类、萜类化合物、芳香族化合物的含量分别较对照组的提高73%,38%和32%. 含量最高组分(E)-2-己烯醛较对照组的提高7 4%. 含量显著性提高的组分还包括萜类化合物的β-水芹烯和α-石竹烯,芳香族化合物的丁子香酚,分别较对照组的提高129%,65%和309%. 不同浓度的Nd┗3+┛均可促进挥发性物质的释放,且随诱导时间呈不同的变化趋势. 一定浓度的Nd┗3+┛还可诱导番茄叶活性氧的释放以及几丁质酶和β-1,3-葡聚糖酶活力的提高. 说明Nd┗3+┛可能通过提高番茄叶挥发性物质的含量,以增强其抗病能力.诱导效应是指在有机分子中引入一原子或基团后,使分子中成键电子云密度分布发生变化,从而使化学键发生极化的现象,称为诱导效应。
诱导效应在有机化合物分子中,由于电负性不同的取代基(原子或原子团)的影响,使整个分子中的成键电子云密度向某一方向偏移,这种效应叫诱导效应。
诱导效应的特征是电子云偏移沿着ζ键传递,并随着碳链的增长而减弱或消失。
例如,醋酸是弱酸(pKi=4.76),醋酸分子中的α-碳原子上引入一个电负性比氢强的氯原子后,能使整个分子的电子云向氯原子偏移,结果增强了羟基中氢原子的质子化,使一氯醋酸成为强酸(pKi=2.86,酸性比醋酸强)。
比较各种原子或原子团的诱导效应时,常以氢原子为标准。
吸引电子能力(电负性较大)比氢原子强的原子或原子团(如—X、—OH、—NO2、—CN等)有吸电子的诱导效应(负的诱导效应),用-I表示,整个分子的电子云偏向取代基。
吸引电子的能力比氢原子弱的原子或原子团(如烷基)具有给电子的诱导效应(正的诱导效应),用I表示,整个分子的电子云偏离取代基。
在诱导效应中,一般用箭头“→”表示电子移动的方向,表示电子云的分布发生了变化。
诱导效应是一种短程的电子效应,一般隔三个化学键影响就很小了。
诱导效应(inductive effect)★★★由于成键原子的电负性不同,而使整个分子的电子云沿着碳链向某一方向移动的现象叫诱导效应。
用符号I表示,“→”表示电子移动的方向。
例如:氯原子取代了烷烃碳上的氢原子后。
由于氯的电负性较大,吸引电子的能力较强,电子向氯偏移,使氯带部分负电荷(δ)、碳带部分正电荷(δ)。
带部分正电荷的碳又吸引相邻碳上的电子,使其也产生偏移,也带部分正电荷(),但偏移程度小一些,这样依次影响下去。
诱导效应沿着碳链移动时减弱得很快,一般到第三个碳原子后,就很微弱,可以略而不计。
为了判断诱导效应的影响和强度,常以碳氢化合物的氢原子作为标准。
一个原子或基团吸引电子的能力比氢强,就叫吸电子基。
由吸电子基引起的诱导效应为负诱导效应,用-I表示。
一个原子或基团吸引电子的能力比氢弱,就叫斥电子基。
由斥电子基引起的诱导效应为正诱导效应,用+I表示。
R C ← Y R C - H R C → X+I效应比较标准-I效应下面是一些原子或基团诱导效应的大小次序:吸电子基团:NO>CN>F>Cl>Br>I>C≡CH>OCH>C H>CH=CH>H斥电子基团:(CH)C>(CH)CH>CH CH>CH>H上面讲的是由未起反应的分子所表现出来的诱导效应叫做静态诱导效应,它是分子固有的性质。
在起化学反应时,分子的反应中心如受到极性试剂的进攻,键的电子云分布将受到试剂电场影响而发生变化,即引起诱导极化或者说加深了键的极化而导致分子的活化。
这种改变与外界电场强度和键的极化能力有关。
分子在试剂电场影响下所发生的诱导极化是一种暂时现象,只有在进行化学反应的瞬间才表现出来。
这种由于外界电场引起的诱导极化效应叫动态诱导效应。
诱导效应可以说明分子中原子间的相互影响。
例如:氯原子取代乙酸的α-H后,生成氯乙酸,由于氯的吸电子作用通过碳链传递,使羟基中O-H键极性增大,氢更易以质子形式解离下去,从而酸性增强。
所以ClCH COOH的酸性强于CH COOH的酸性。
诱导效应不但能影响物质的酸碱性,而且能影响物质的物理性质和其他化学性质。
例如:醛酮羰基的特性反应是亲核加成反应,如连有吸电子基,使羰基碳上电子云密度减小,正性增大,更易发生亲核加成反应。
如连有斥电子基,羰基碳上电子云密度增大,正性减小,亲核加成活性减小。
所以反应速度变慢。
第一节诱导效应一.共价键的极性与诱导效应共价键虽然由电子对共用所构成,但电子并不一定是平均共用的,也就是说,在成键原子之间电子云的分布并不一定是完全对称的,除非是相同双原子分子如氢分子H-H,或是连有相同基团的如H3C-CH3。