诱导效应和共轭效应超详细解析PPT课件
- 格式:ppt
- 大小:816.50 KB
- 文档页数:46


共轭效应和诱导效应共轭效应和诱导效应是有机化学中两个重要的概念,用于描述分子中电子的重新分布及其对分子性质的影响。
这些效应对于理解有机化合物的结构和反应性质是至关重要的。
共轭效应是指在分子中的共轭体系中,电子可以自由地在不同的原子之间传递。
共轭体系通常包括具有相邻的π键或具有相邻的孤对电子的原子。
例如,苯分子是一个经典的共轭体系,其中6个碳原子形成一个环状结构,并具有交替的单键和双键。
共轭体系可以通过增加或减少π键的数量来扩展或收缩。
共轭效应可以影响共轭体系中的电子密度和分子能量,从而影响其光学性质、化学反应性和稳定性。
共轭效应对于有机分子的光学性质非常重要。
在共轭体系中,电子可以在分子中自由地移动,这种电子的运动可以吸收特定波长的光。
因此,具有共轭体系的有机化合物通常具有较长的共轭系统,从而吸收更长波长的光,呈现出较为明亮的颜色。
例如,花青素等天然色素就是由共轭体系构成的。
诱导效应是指由于一个原子或基团的电子密度分布不均匀而引起的邻近原子或基团的电子重新分布。
诱导效应通常通过化学键的极性来产生,其中一个原子或基团对电子的吸引力更强。
这种不平衡的电子分布可以传递到相邻的原子或基团,并产生相应的效应。
诱导效应可以影响分子的极性、酸碱性、溶解性等性质。
诱导效应可以分为正诱导和负诱导。
正诱导是指电子密度在分子中向正电荷较强的部分移动,而负诱导则是指电子密度向负电荷较强的部分移动。
例如,苯环上的甲基基团是正诱导基团,因为它将电子向苯环传递,增加了苯环的电子密度。
相反,氟原子是负诱导基团,因为它吸引了周围电子,降低了相邻碳原子的电子密度。
总的来说,共轭效应和诱导效应是描述有机化合物中电子分布的重要概念。
共轭效应主要涉及电子在共轭体系中的自由传递,而诱导效应则涉及邻近原子或基团间电子的重新分布。
这些效应对于理解有机分子的结构、性质和反应性都至关重要,并在有机化学的研究和应用中发挥着重要的作用。




诱导效应与共轭效应首先介绍诱导效应:诱导看相连原子的电负性,即该原子吸电子的能力,是最简单粗暴的处理方式。
可以理解为静电吸引,远了就吸引弱了,所以隔两根键或隔三个原子后基本可忽略诱导效应。
诱导效应为什么能这么简单粗暴的对待,主要我们研究的对象是连接两原子成键的sigma键,也就是头碰头重叠的键,电子在两原子间共享穿梭,受两原子束缚,所以电子怎么分配由两原子的吸电子能力决定。
而电负性大的原子,即吸电子能力强的原子犹如带更多正电荷的带电小球(想象做高中物理带电小球受力分析的情景),对电子的吸引力就是比电负性小的原子要强,所以两原子间的电子就偏向电负性大的原子,基团也一样。
从这一角度(sigma键电子偏移结果)来看,电子偏向某一方的原子或基团就称为诱导吸电子基,反之则称为诱导给电子基。
诱导吸电子能力只看原子电负性大小,电负性越大,电负性大的原子越多,吸电子能力越强。
所以那些电负性大的原子(氟 F.氧O.氮N等),或带有很多个这样原子的基团(硝基NO2,羧基COOH,三氟甲基CF3等),一般就是吸电子基。
有机化学中都是碳原子做骨架,因此一般原子电负性都跟碳比较,电负性比碳大的就是吸电子诱导,比碳小的就是给电子诱导,说起来诱导基团或原子不多,一般是含硅基团,高中学过,同一主族自上而下原子电负性减小,或者说氧化性降低,还原性升高,所以硅电负性比碳小,那诸如三甲基硅基等含硅的烷基取代的基团都是诱导给电子基。
当然硅这族下面的原子也是诱导给电子基,只是不常见。
其次介绍共轭效应:共轭效应看pai键中某原子的电子云密度。
注意!讨论的电子与诱导效应的电子不一样!我们都知道共轭体系稳定,这是由于共轭能分散电荷,使体系的电子分布趋于平均化(理想状态,苯环就是如此,但链状共轭体系达不到,我们只是借鉴思考方式),链状共轭体系的共轭范围越大越稳定。
环状共轭体系由于涉及芳香性,不能下此结论。
诱导效应就像资本主义,弱肉强食,电负性谁大电子归谁;共轭效应就像社会主义,电子共享且均匀化(相信学习离子键和共价键时老师打过这比方)。



共轭效应是指两个以上双键(或三键)以单键相联结时所发生的电子的离位作用。
英戈尔德,C.K.称这种效应为仲介效应,并且认为,共轭体系中这种电子的位移是由有关各原子的电负性和p 轨道的大小(或主量子数)决定的。
据此若在简单的正常共轭体系中发生以下的电子离位作用:(例如:CH2 CH—CH CH2、CH2 CH—CH O)。
Y 原子的电负性和它的p 轨道半径愈大,则它吸引电子的能力也愈大,愈有利於基团—X Y从基准双键A B—吸引电子的共轭效应(如同右边的箭头所示)。
与此相反,如果A原子的电负性和它的p 轨道半径愈大,则它释放电子使其向Y 原子移动的能力愈小,愈不利於向—X Y基团方向给电子的共轭效应。
中间原子B 和X 的特性也与共轭效应直接相关。
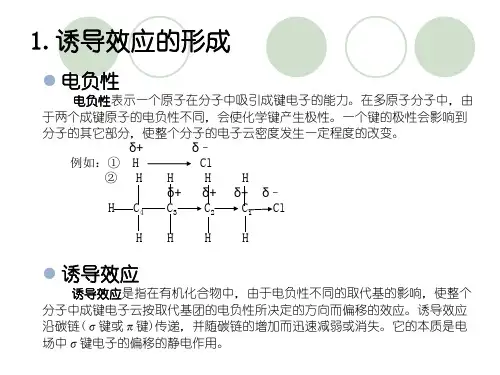
诱导效应是指在有机分子中引入一原子或基团后,使分子中成键电子云密度分布发生变化,从而使化学键发生极化的现象,称为诱导效应。
诱导效应在有机化合物分子中,由于电负性不同的取代基(原子或原子团)的影响,使整个分子中的成键电子云密度向某一方向偏移,这种效应叫诱导效应。
诱导效应的特征是电子云偏移沿着σ键传递,并随着碳链的增长而减弱或消失。
例如,醋酸是弱酸(pKi=4.76),醋酸分子中的α-碳原子上引入一个电负性比氢强的氯原子后,能使整个分子的电子云向氯原子偏移,结果增强了羟基中氢原子的质子化,使一氯醋酸成为强酸(pKi=2.86,酸性比醋酸强)。
比较各种原子或原子团的诱导效应时,常以氢原子为标准。
吸引电子能力(电负性较大)比氢原子强的原子或原子团(如—X、—OH、—NO2、—CN等)有吸电子的诱导效应(负的诱导效应),用-I表示,整个分子的电子云偏向取代基。
吸引电子的能力比氢原子弱的原子或原子团(如烷基)具有给电子的诱导效应(正的诱导效应),用I表示,整个分子的电子云偏离取代基。
在诱导效应中,一般用箭头“→”表示电子移动的方向,表示电子云的分布发生了变化。
诱导效应是电子共轭是原子间成键的一种的方式吧,具体:1单双键交替出现的体系称为共轭体系。

共轭效应与诱导效应一.共轭效应1、概念:共轭效应(conjugated effect) ,又称离域效应,是指由于共轭π键的形成而引起分子性质的改变的效应。
何为离域效应呢?对于H2C=CH2,π键的两个π电子的运动范围局限在两个碳原子之间,这叫做定域运动。
而CH2=CH-CH=CH2中,可以看作两个孤立的双键重合在一起,π电子的运动范围不再局限在两个碳原子之间,而是扩充到四个碳原子之间,这叫做离域现象。
这种发生离域现象的分子叫共轭分子。
共轭分子中任何一个原子受到外界试剂的作用,其它部分可以马上受到影响。
2、特点:共轭效应相对于诱导效应最特殊的特点是共轭效应沿共轭体系传递不受距离的限制,而诱导效应一般超过三个c原子之后就可以忽略不计了!其主要表现电子效应:组成共轭体系的原子处于同一平面,共轭体系的p电子,不只局限于两个原子之间运动,而是发生离域作用,使共轭体系的分子产生一系列特征,如分子内能低、键长趋于平均化、折射率升高,整个分子更趋稳定,以及在外电场影响下共轭分子链发生极性交替现象和引起分子其他某些性质的变化。
3、共轭效应的形式:(1)正常共轭效应:1、π-π共轭。
是指两个以上双键(或叁键)以单键相联结时所发生的π电子的离位作用。
具有共平面性、键长趋于平均化、共轭体系能量降低等特点!C.K.英戈尔德称这种效应为中介效应,并且认为,共轭体系中这种电子的位移是由有关各原子的电负性和p轨道的大小(或主量子数)决定的。
例如:--A=B-X=Y--,原子的电负性和它的p轨道半径愈大,则它吸引π电子的能力也愈大,愈有利于基团-X =Y-从基准双键A=B-吸引π电子的共轭效应。
与此相反,如果A原子的电负性和它的p轨道半径愈大,则它释放π电子使其向Y原子移动的能力愈小,愈不利于向-X=Y基团方向给电子的共轭效应。
中间原子B和X的特性也与共轭效应直接相关。
2、p-π,又称共轭多电子共轭效应。
在简单的多电子共轭体系中,Z为一个带有p电子对(或称n电子)的原子或基团。