2018-2019学年高考二轮复习水溶液中的离子平衡专题卷
- 格式:doc
- 大小:186.00 KB
- 文档页数:9

高考真题分析专题11 水溶液中的离子平衡(2018·江苏卷)下列有关电解质溶液中微粒的物质的量浓度关系正确的是A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-)C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+)D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)(2018·安徽卷)室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。
下列有关说法正确的是A. a点由水电离出的c(H+)=1.0×10-14mol/LB. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)C.c点:c(Cl-)= c(NH4+)D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热(2018·浙江卷)海水中含有丰富的镁资源。
某同学设计了从模拟海水中制备MgO的实验方案:1.0 LMgO (25℃实验过程中,假设溶液体积不变。
已知:K sp(CaCO3)=4.96×10-9;K sp(MgCO3)=6.82×10-6;K sp[Ca(OH)2]=4.68×10-6;K sp[Mg(OH)2]=5.61×10-12。
下列说法正确的是 A .沉淀物X 为CaCO 3B .滤液M 中存在Mg 2+,不存在Ca 2+C .滤液N 中存在Mg 2+、Ca 2+D .步骤②中若改为加入4.2 g NaOH 固体,沉淀物Y 为Ca(OH)2和Mg(OH)2的混合物(2018·福建卷)常温下0.1mol·L -1醋酸溶液的pH=a ,下列能使溶液pH=(a +1)的措施是A .将溶液稀释到原体积的10倍B .加入适量的醋酸钠固体C .加入等体积0.2 mol·L -1盐酸 D .提高溶液的温度(2018·广东卷)对于0.1mol •L -1 Na 2SO 3溶液,正确的是A 、升高温度,溶液的pH 降低B 、c (Na +)=2c (SO 32―)+ c (HSO 3―)+ c (H 2SO 3)C 、c (Na +)+c (H +)=2 c (SO 32―)+ 2c (HSO 3―)+ c (OH ―) D 、加入少量NaOH 固体,c (SO 32―)与c (Na +)均增大(2018·山东卷)室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是A.溶液中导电粒子的数目减少B.溶液中)()()(33--∙OH c COOH CH c COO CH c 不变 C.醋酸的电离程度增大,c(H +)亦增大D.再加入10mlpH=11的NaOH 溶液,混合液pH=7(2018·天津卷)25℃时,向10ml0.01mol/LKOH 溶液中滴加0.01mol/L 苯酚溶液,混合溶液中粒子浓度关系正确的A.pH>7时,c(C 6H 5O -)>c(K +)>c(H +)>c(OH -) B.pH<7时,c(K +)>c(C 6H 5O -)>c(H +)>c(OH -)C.V[C 6H 5OH(aq)]=10ml 时,c(K +)=c(C 6H 5O -)>c(OH -)=c(H +) D.V[C 6H 5OH(aq)]=20ml 时,c(C 6H 5O -)+c(C 6H 5OH)=2c(K +)(2018·天津卷)下列说法正确的是A.25℃时NH 4Cl 溶液的K W 大于100℃时NH 4Cl 溶液的K WB.SO 2通入碘水中,反应的离子方程式为SO 2+I 2+2H 2O=SO 32-+2I -C.加入铝粉能产生氢气的溶液中,可能存在大量的Na +、Ba 2+、AlO 2-、NO 3-D.100℃时,将pH =2的盐酸与pH =12的NaOH 溶液等体积混合,溶液显中性(2018·重庆卷) 对滴有酚酞试液的下列溶液,操作后颜色变深的是A.明矾溶液加热B.CH 3COONa 溶液加热C.氨水中加入少量NH 4Cl 固体D.小苏打溶液中加入少量NaCl 固体(2018·新课标全国卷)将浓度为0.1mol ·L -1HF 溶液加水不断稀释,下列各量始终保持增大的是A. c (H +) B. )(HF K a C. )()(+-H c F c D. )()(HF c H c +(2018·海南卷)用0.1026mol ·L -1的盐酸滴定25.00mL 未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为A. 22.30mLB. 22.35mLC. 23.65mLD. 23.70Ml(2018·全国II 卷)等浓度的系列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的PH 由小到大排列的正确是A .④②③①B .③①②④C .①②③④D .①③②④(2018·全国II 卷)温室时,将浓度和体积分别为c 1、v 1的NaOH 溶液和c 2、v 2的CH 3COOH 溶液相混合,下列关于该混合溶液的叙述错误的是A .若PH>7时,则一定是c 1v 1=c 2v 2B .在任何情况下都是c (Na +)+c (H +)=c (CH 3COO -)+c (OH -) C .当pH=7时,若V 1=V 2,则一定是c 2>c 1D .若V 1=V 2,C 1=C 2,则c (CH 3COO -)+C(CH 3COOH)=C(Na +)(2018·四川卷)25℃时,在等体积的① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是A.1:10:1010:109B.1:5:5×109:5×108C.1:20:1010:109D.1:10:104:109(2018·上海卷)常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是A.b不可能显碱性 B. a可能显酸性或碱性C.a不可能显酸性 D.b可能显碱性或酸性(2018·天津卷)工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。
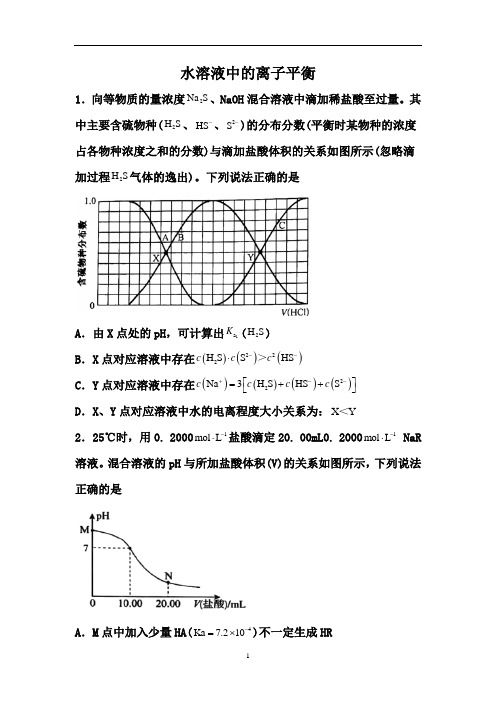
水溶液中的离子平衡1.向等物质的量浓度2Na S 、NaOH 混合溶液中滴加稀盐酸至过量。
其中主要含硫物种(2H S 、HS -、2S -)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程2H S 气体的逸出)。
下列说法正确的是A .由X 点处的pH ,可计算出1a K (2H S ) B .X 点对应溶液中存在()()()222H S S HS c c c --⋅>C .Y 点对应溶液中存在()()()()22Na 3H S HS S c c c c +--⎡⎤=++⎣⎦D .X 、Y 点对应溶液中水的电离程度大小关系为:X Y <2.25℃时,用0. 20001mol L -⋅盐酸滴定20. 00mL0. 20001mol L -⋅ NaR 溶液。
混合溶液的pH 与所加盐酸体积(V)的关系如图所示,下列说法正确的是A .M 点中加入少量HA(4Ka 7.210-=⨯)不一定生成HRB .N 点溶液的pH 约为4C .M 点到N 点溶液中水的电离程度先减弱后增强D .当盐酸加入体积为10. 00ml 时,此时溶液中的微粒浓度大小关系为()()()()+---+c Na =c Cl =c R =c(HR)>c(OH )=c H3.已知p -c(HX)c(X )=-lg -c(HX)c(X )。
室温下,向20.00 mL 0.10 mol/LHX 溶液中逐滴滴加0.10 mol ·L -1NaOH 溶液,溶液pH 随p -c(HX)c(X )变化关系如图所示。
下列说法错误的是( )A .当p -c(HX)c(X )=1时,溶液的pH=5.75 B .当p -c(HX)c(X )=0时,加入NaOH 溶液的体积小于10.00 mL C .当加入10.00 mL NaOH 溶液时:c(H +)+c(HX)=c(Na +)+c(OH -)D .如图所示各点对应溶液中水电离出来的H +浓度:a>b>c 4.邻苯二甲酸()是酸碱中和滴定中常用的标准溶液。

重庆市语文高考化学二轮专题 11 水溶液中的离子平衡(II)卷姓名:________ 班级:________ 成绩:________一、单选题 (共13题;共26分)1. (2分) (2019高二上·吉林期末) 下列溶液或浊液中,关于离子浓度的说法正确的是()A . 一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小B . 浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)]C . 0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH -)=c(CH3COOH) + 2c(H+)D . 常温下,已知:Ksp(AgCl)=1.8×10-10 , Ksp(Ag2Cr2O4)=2.0×10-12 ,则Ag2CrO4悬浊液中的c(Ag +)一定小于AgCl悬浊液中的c(Ag+)2. (2分) (2018高二上·武汉期末) 下列说法不正确的是()A . Ksp只与难溶电解质的性质和温度有关B . 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀C . 其他条件不变,离子浓度改变时,Ksp不变D . 两种难溶电解质作比较时,Ksp小的,溶解度一定小3. (2分)(2018·濮阳模拟) 化学的实用性表现在它与人们的生活紧密联系。
下列常用物质的主要化学成分溶于水后对水的电离有抑制作用的是()A . 明矾B . 苏打C . 84消毒液D . 洁厕灵4. (2分) (2017高二上·上饶期中) 在100℃时,100mL蒸馏水中c(OH﹣)=1×10﹣6mol•L﹣1 ,当改变下列条件之一时,c(OH﹣)仍然等于1×10﹣6mol•L﹣1的是()①温度降低到25℃②加入10﹣6mol NaOH固体,保持100℃③加入10﹣6molNaCl,保持100℃④蒸发丢掉50mL水,保持100℃A . ①②B . ③④C . ①③D . ②④5. (2分) (2015高二上·宁城期末) 已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10﹣18、1.3×10﹣36 .常温时下列有关说法正确的是()A . 向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强B . 将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10﹣35 mol/LC . 因为H2SO4是强酸,所以反应:CuSO4+H2S═CuS↓+H2SO4不能发生D . 除去工业废水中的Cu2+可以选用FeS作沉淀剂6. (2分)关于小苏打水溶液的表述正确的是()A . 存在的电离平衡为HCO3-+H2O H2CO3+OH-B . c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)C . HCO3-的电离程度大于HCO3-的水解程度D . c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)7. (2分) (2015高一上·宜昌期末) 对于某些离子的检验及结论一定正确的是()A . 某物质进行焰色反应时呈现黄色,则该物质中一定含有Na+B . 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣C . 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+D . 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+8. (2分) CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是()A . 相对于途径①,途径②更好地体现了绿色化学思想B . Y可以是葡萄糖溶液C . 利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1molD . 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:29. (2分) (2017高二上·晋江期末) 常温下含碳各微粒H2CO3、HCO3﹣和CO32﹣存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是()A . pH=10.25时,c(Na+)═c(CO32﹣)+c(HCO3﹣)B . 为获得尽可能纯的NaHCO3 ,宜控制溶液的pH为7~9之间C . 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10﹣6.37D . 若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3﹣)>c (CO32﹣)>c(OH﹣)>c(H+)10. (2分) (2018高二上·惠州期末) 25℃时,水的电离达到平衡:H2O H++ OH-,下列叙述正确的是()A . 向水中加入稀氨水,平衡逆向移动,c(OH-)降低B . 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变C . 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D . 将水加热,Kw增大,pH不变11. (2分)下列说法正确的是()A . 物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同B . 25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小与7C . 25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7D . 将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡12. (2分) (2019高三上·哈尔滨期末) 下列有关电解质溶液的说法正确的是()A . 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)B . pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③C . 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH -) >c(H+)D . 向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/ c(NH3·H2O)增大13. (2分)已知25℃时,Mg(OH)2的Ksp = 5.6×10-12 , MgF2的Ksp = 7.4×10-11。

2017-2018-2019三年高考化学真题分类汇编专题水溶液中的离子平衡(2019·全国Ⅰ卷)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
下列叙述错误的是A. 混合溶液的导电能力与离子浓度和种类有关B. Na+与A2−的导电能力之和大于HA−的C. b点的混合溶液pH=7D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)【答案】C(2019·全国Ⅱ卷)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。
硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。
下列说法错误的是A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度B. 图中各点对应的K sp的关系为:K sp(m)=K sp(n)<K sp(p)<K sp(q)C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动【答案】B【2018新课标3卷】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动【答案】C【2017新课标1卷】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。

1.【2017新课标1卷】(14分)Li 4Ti 5O 12和LiFePO 4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO 3,还含有少量MgO 、SiO 2等杂质)来制备,工艺流程如下:(5)若“滤液②”中21(Mg)0.02mol L c +-=⋅,加入双氧水和磷酸(设溶液体积增加1倍),使3Fe +恰好沉淀完全即溶液中351(Fe) 1.010mol L c +--=⨯⋅,此时是否有Mg 3(PO 4)2沉淀生成? (列式计算)。
FePO 4、Mg 3(PO 4)2的K sp 分别为22241.310 1.010--⨯⨯、。
【答案】(5)Fe 3+恰好沉淀完全时,c (34PO -)=2251.3101.010--⨯⨯mol·L −1=1.3×10–17 mol·L −1,c 3(Mg 2+)×c 2(34PO -)=(0.01)3×(1.3×10–17)2=1.7×10–40<K sp [Mg 3(PO 4)2],因此不会生成Mg 3(PO 4)2沉淀。
2.【2017新课标1卷】(14分)近期发现,H 2S 是继NO 、CO 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。
回答下列问题:(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_________(填标号)。
A .氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B .氢硫酸的导电能力低于相同浓度的亚硫酸C .0.10 mol·L −1的氢硫酸和亚硫酸的pH 分别为4.5和2.1D .氢硫酸的还原性强于亚硫酸 【答案】(1)D【解析】(1)A .根据复分解反应的规律:强酸+弱酸盐=强酸盐+弱酸,可知酸性H 2SO 3>H 2CO 3>H 2S ,A 错误;B .亚硫酸、氢硫酸都是二元弱酸,由于溶液中离子浓度越大,溶液的导电性就越强,所以等浓度的亚硫酸的导电性比氢硫酸的强,可以证明酸性:H 2SO 3> H 2S ,B 错误;C .等浓度的二元弱酸,酸电离产生的c (H +)越大,溶液的酸性越强,则其pH 就越小。

2019年高考题型70题专项训练之溶液中的离子平衡一、单选题(本大题共70小题,共70.0分)1.常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
下列叙述错误的是()A. K a2(H2X)的数量级为10−6B. 曲线N表示pH与lg c(HX−)的变化关系H2XC. NaHX溶液中c(H+)>c(OH−)D. 当混合溶液呈中性时,c(Na+)>c(HX−)>c(X2−)>c(OH−)=c(H+)2.下列说法正确的是()A. 将BaSO4放入水中不能导电,所以硫酸钡不是电解质B. NaCl溶液能导电,所以NaCl溶液是电解质C. 氯化氢溶于水能导电,所以盐酸是电解质D. 固态的NaCl不导电,熔融态NaCl可以导电3.下列说法错误的是()A. 0.1mol/LCH3COOH溶液中:c(CH3COO−)+c(CH3COOH)=0.1mol/LB. Na2S溶液中:c(OH−)=c(H+)+c(HS−)+2c(H2S)C. 配制FeCl3溶液,应加少量盐酸D. 将Al2(SO4)3溶液蒸干,灼烧得Al2O34.某浓度的氨水中存在下列平衡:NH3⋅H2O⇌NH 4++OH−,若想增大NH 4+的浓度,而不增加OH−的浓度,应采取的措施是()①适当升高温度②加入NH4Cl固体③通入NH3④加入少量盐酸.A. ①②B. ②③C. ③④D. ②④5.下列有关电解质溶液的说法不正确的是()A. 向Na2CO3溶液中通入NH3,c(Na+)减小c(CO32−)B. 将0.1mol⋅L−1的K2C2O4溶液从25℃升温至35℃,c(K+)增大c(C2O42−)=1C. 向0.1mol⋅L−1的HF溶液中滴加NaOH溶液至中性,c(Na+)c(F−)D. 向0.1mol⋅L−1的CH3COONa溶液中加入少量水,c(CH3COOH)增大c(CH3COO−)⋅c(H+)6.下列表述中,与盐类水解有关的是()①明矾和FeCl3可作净水剂.②为保存FeCl3溶液,要在溶液中加少量盐酸.③AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3④NH4Cl与ZnCl2溶液可作焊接中的除锈剂.⑤实验室盛放NaOH溶液的试剂瓶应用橡皮塞,而不能用玻璃塞.⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂.⑦草木灰与铵态氮肥不能混合施用.A. ①②③⑤⑥⑦B. ①②③④⑥⑦C. ①③⑤⑥⑦D. 全有关7.在湿法炼锌的电解循环溶液中,较高浓度的Cl−会腐蚀阳极板而增大电解能耗。
专题十三 水溶液中的离子平衡 (解析版)1.【2019 江苏 】14.室温下,反应3HCO -+H 2OH 2CO 3+OH −的平衡常数K =2.2×10−8。
将NH 4HCO 3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO 。
若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是 A. 0.2mol·L −1氨水:c (NH 3·H 2O)>c (4NH +)>c (OH −)>c (H +)B. 0.2mol·L −1NH 4HCO 3溶液(pH>7):c (4NH +)>c (3HCO -)>c (H 2CO 3)>c (NH 3·H 2O)C. 0.2mol·L −1氨水和0.2mol·L −1NH 4HCO 3溶液等体积混合:c (4NH +)+c (NH 3·H 2O)=c (H 2CO 3)+c (3HCO -)+c (23CO -) D. 0.6mol·L −1氨水和0.2mol·L −1NH 4HCO 3溶液等体积混合:c (NH 3·H 2O)+c (23CO -)+c (OH −)=0.3mol·L −1+c (H 2CO 3)+c (H +)【答案】BD 【解析】A.NH 3∙H 2O 属于弱电解,部分电离,氨水中存在的电离平衡有:NH 3∙H 2O NH 4++OH -,H 2OH ++OH -,所以c(OH -)>c(NH 4+),故A 错误;B.NH 4HCO 3溶液显碱性,说明HCO 3-的水解程度大于NH 4+的水解,所以c(NH 4+)>c(HCO 3-),HCO 3-水解:HCO 3-H 2CO 3+OH -,NH 4+水解:NH 4++H 2O NH 3∙H 2O+H +,前者水解程度大,则c(H 2CO 3)>c(NH 3∙H 2O),故B 正确;C.由物料守恒,n(N):n(C)=2:1,则有c(NH 4+)+c(NH 3∙H 2O)=2[c(H 2CO 3)+c(HCO 3-)+c(CO 32-)],故C 错误;D.由物料守恒,n(N):n(C)=4:1,则有c(NH 4+)+c(NH 3∙H 2O)=4[c(H 2CO 3)+c(HCO 3-)+c(CO 32-)]①;电荷守恒有:c(NH 4+)+c(H +)=c(HCO 3-)+2c(CO 32-)+c(OH -)②;结合①②消去c(NH 4+)得:c(NH 3∙H 2O)+c(OH -)=c(H +)+4c(H 2CO 3)+3c(HCO 3-)+2c(CO 32-)③,0.2mol/LNH 4HCO 3与氨水等体积混合后,c(NH 4HCO 3)=0.1mol/L ,由碳守恒有,c(H 2CO 3)+c(HCO 3-)+c(CO 32-)=0.1mol/L ④,将③等式两边各加一个c(CO 32-),则有c(NH 3∙H 2O)+c(OH -)+c(CO 32-)=c(H +)+c(H 2CO 3)+3c(H 2CO 3)+3c(HCO 3-)+3c(CO 32-),将④带入③中得,c(NH 3∙H 2O)+c(OH -)+c(CO 32-)=c(H +)+3c(H 2CO 3)+0.3mol/L ,故D 正确; 故选BD 。
高考化学二轮复习考点知识专题强化训练水溶液中的离子平衡(原卷+解析卷)1.25 ℃时,浓度均为0.1 mol·L-1的溶液,其pH如下表所示。
有关说法正确的是序号①②③④溶液NaCl CH3COONH4NaF NaHCO3pH7.0 7.0 8.1 8.4A.酸性强弱:H2CO3>HFB.①和②中溶质均未水解C.离子的总浓度:①>③D.④中:c(HCO-3)+2c(CO2-3)+c(H2CO3)=0.1 mol·L-12.柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化曲线如图所示。
下列说法中正确的是A.H3R的第二步电离常数K a2(H3R)的数量级为10-4B.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)C.Na2HR溶液中HR2-的水解程度大于电离程度D.pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)3.类比pH的定义,对于稀溶液可以定义pC=-lg c。
常温下,某浓度的H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)的变化如图所示。
下列说法中正确的是A.曲线Ⅱ表示pC(HA-)随pH的变化B.当pH=1.40时,c(H2A)>c(A2-)>c(HA-)C.常温下,c H2A·c A2-c2HA-=104.50D.a、b、c三点对应的溶液中,c(H2A)+c(HA-)+c(A2-)的值相等4.(1)已知常温下,K a(HNO2)=5×10-4,则反应HNO2(aq)+OH-(aq)NO-2(aq)+H2O(l)的平衡常数K=__________,相同物质的量浓度的HNO2、NaNO2混合溶液中,各离子的物质的量浓度由大到小的顺序为_______________________________________。
专题10 水溶液中的离子平衡一、选择题1.将纯水加热至较高温度,下列叙述正确的是( )A.水的离子积变大、pH变小、呈酸性B.水的离子积不变、pH不变、呈中性C.水的离子积变小、pH变大、呈碱性D.水的离子积变大、pH变小、呈中性解析:将纯水加热,平衡H2O H++OH-向右移动,[H+]、[OH-]均变大,但仍然相等,所以K w变大pH变小,仍然呈中性。
答案:D2.下列事实不能证明氨水是弱碱的是( )A.pH=11的氨水加入水稀释到原溶液体积100倍时,pH大于9B.氯化铵溶液呈酸性C.常温下0.01 mol/L氨水的pH=10.6D.体积相同的0.1 mol/L氨水和0.1 mol/L NaOH溶液中和盐酸的量相同答案:D3.(2018·德州模拟)将0.1 mol/L醋酸溶液加水稀释,下列说法正确的是( )A.溶液中[H+]和[OH-]都减小B.溶液中[H+]增大C.醋酸电离平衡向左移动D.溶液的pH增大解析:加水稀释,电离程度增大,[H+]减小,[OH-]增大,溶液的pH增大。
答案:D4.(2018·北京西城区测试)一定条件下,碳钢腐蚀与溶液pH的关系如下:13.pH 2 4 6 6.5 8145腐蚀快慢较快慢较快主要产物Fe2+Fe3O4Fe2O3FeO2-下列说法不正确...的是( )A.在pH<4溶液中,碳钢主要发生析氢腐蚀B.在pH>6溶液中,碳钢主要发生吸氧腐蚀C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓解析:A项,在pH<4溶液中,碳钢主要发生析氢腐蚀;B项,在pH>6溶液中,碳钢主要发生吸氧腐蚀;C项,在pH>14溶液中,碳钢腐蚀的正极反应为O2+2H2O+4e-=4OH-;D项,在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓。
答案:C5.(2018·肇庆一模)关于常温下pH=12的NaOH溶液,下列说法错误..的是A.c(OH-)=c(Na+)+c(H+)B.由水电离出的c(OH-)=1.0×10-12 mol·L-1C.与等体积pH=2的醋酸混合后所得溶液显碱性D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+)>c(NH4+)答案:C6.(2018·惠州第二次调研)下列各组离子能大量共存的是( )A.加入KSCN显红色的溶液中:K+、NH4+、Cl-、I-B.含“84”消毒夜(有效成分NaClO)的溶液中:Fe2+、Cl-、Ca2+、Na+C.常温下,pH=1的溶液中:NH4+、Na+、Cl-、Cu2+D.常温下,pH=13的无色溶液中:K+、NO3-、HCO3-、Al3+解析:A项,加入KSCN显红色的溶液含有Fe3+,Fe3+与I-发生氧化还原反应而不能大量共存;B项,Fe2+与ClO-发生氧化还原反应而不能大量共存;C项,pH=1的溶液为强酸性溶液,四种离子均能大量共存;D 项,pH=13的无色溶液为强碱性溶液,HCO3-、Al3+均不能大量共存,且二者能发生相互促进的水解反应。
水溶液中的离子平衡一、单项选择题1.下列关于水的说法正确的是()A.常温下正常雨水的pH为7.0,酸雨的pH小于7.0B.将25 ℃纯水加热至95 ℃时,K Wc(OH-)增大C.将纯水加热到95 ℃时,水的离子积变大,pH不变,水仍呈中性D.向水中加入醋酸或醋酸钠,均可促进水的电离解析:选B正常雨水的pH为5.6,酸雨的pH小于5.6;将纯水加热后,水的离子积变大,B项算式表示氢离子浓度,其值变大,pH变小,水仍呈中性;向水中加入醋酸可抑制水的电离,而加入醋酸钠会促进水的电离。
2.在25 ℃时,某稀溶液中由水电离产生的H+浓度为1×10-13 mol·L-1,下列有关该溶液的叙述,正确的是()A.该溶液可能呈酸性B.该溶液一定呈碱性C.该溶液的pH一定是1 D.该溶液的pH不可能为13解析:选A在25 ℃时,某稀溶液中由水电离产生的c(H+)为1×10-13 mol·L-1<1×10-7 mol·L-1,说明溶液中的溶质抑制水的电离,溶质为酸或碱,溶液可能呈酸性或碱性,A 正确,B错误;如果该溶液呈酸性,则溶液的pH=1,如果该溶液呈碱性,则溶液的pH=13,C、D错误。
3.一定条件下,下列说法正确的是()A.向氨水中加入氯化铵固体,会使溶液的pH减小B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大C.常温时,把pH=1的醋酸溶液稀释10倍后,其pH大于2D.稀释Na2CO3溶液,溶液中c(OH-)增大解析:选A向氨水中加入氯化铵固体,铵根离子浓度增大,一水合氨的电离平衡逆向移动,氢氧根离子浓度减小,溶液的pH减小,A项正确;溶度积常数随温度变化而变化,温度不变,溶度积常数不变,B项错误;醋酸是弱酸,部分电离,加水稀释促进醋酸电离,故稀释10倍后pH小于2,C项错误;稀释碳酸钠溶液,虽然促进了碳酸钠的水解,氢氧根离子的物质的量增大,但溶液的体积增大更多,所以溶液中c(OH-)减小,D项错误。
4.25 ℃时某些弱酸的电离常数如下表所示:常温下,稀释CH3COOH 、HClO 两种酸时,溶液的pH 随加水量变化的曲线如图所示,下列说法正确的是( )A .相同浓度的CH 3COOH 和HClO 的混合溶液中,各离子浓度的大小关系是:c (H +)>c (ClO -)>c (CH 3COO -)>c (OH -)B .图像中a 、c 两点所处的溶液中c (R -)c (HR )·c (OH -)相等(HR 代表CH 3COOH 或HClO) C .图像中a 点酸的浓度大于b 点酸的浓度D .向NaClO 溶液中通入少量二氧化碳的离子方程式为2ClO -+CO 2+H 2O===2HClO +CO 2—3 解析:选B CH 3COOH 的电离常数大于HClO ,相同浓度的CH 3COOH 和HClO 的混合溶液中,各离子浓度的大小关系是:c (H +)>c (CH 3COO -)>c (ClO -)>c (OH -),A 错误;把c (R -)c (HR )·c (OH -)的分子、分母同乘以c (H +)可得:K (HR )K W ,温度不变,则该比值不变,B 正确;酸性CH 3COOH >HClO ,pH 相等的CH 3COOH 、HClO ,稀释相同的倍数时,CH 3COOH 中c (H +)小于HClO 中c (H +),所以a 曲线表示CH 3COOH ,b 曲线表示HClO ,a 、b 两点相比,加入相同体积的水后次氯酸的浓度较大,即图像中a 点酸的浓度小于b 点酸的浓度,C 错误;由于酸性HCO -3<HClO <H 2CO 3,则向NaClO 溶液中通入少量CO 2的离子方程式为ClO -+CO 2+H 2O===HClO +HCO -3,D 错误。
5.下列说法不正确的是( )A .将pH 均为a 的氢氧化钠溶液和氨水分别加水稀释100倍,pH 变为b 和c ,则a 、b 、c 的大小关系是a >c >bB .常温下,浓度均为0.1 mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②C .常温下,将相同体积的pH =3的硫酸和pH =11的一元碱BOH 溶液混合,所得溶液可能为中性,也可能为酸性D .物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH 的顺序为③>①>②解析:选C 碱溶液稀释时,pH 逐渐变小,稀释相同倍数时,氢氧化钠溶液的pH 变化幅度较大,氨水继续发生电离,pH 变化幅度较小,A 项正确;醋酸钠为强碱弱酸盐,发生水解反应,促进水的电离,醋酸和盐酸抑制水的电离,由于盐酸是强酸,完全电离,氢离子浓度大,对水的电离的抑制程度大,B 项正确;常温下,将相同体积的pH =3的硫酸和pH =11的一元强碱BOH 溶液混合,所得溶液呈中性,常温下,将相同体积的pH =3的硫酸和pH =11的一元弱碱BOH 溶液混合,碱过量,所得溶液呈碱性,C 项错误;(NH 4)2SO 4和NH 4Cl 水解,使溶液呈酸性,(NH 4)2SO 4中H +较多,pH 较小,NH 4HCO 3溶液呈碱性,D项正确。
6.常温下,将pH=3的盐酸和pH=11的氨水等体积混合,完全反应后,溶液中离子浓度关系正确的是()A.c(NH+4)>c(Cl-)>c(OH-)>c(H+)B.c(NH+4)>c(Cl-)>c(H+)>c(OH-)C.c(Cl-)>c(NH+4)>c(H+)>c(OH-)D.c(Cl-)>c(NH+4)>c(OH-)>c(H+)解析:选A pH=3的盐酸c(HCl)=0.001 mol·L-1,NH3·H2O为弱电解质,常温下pH =11的氨水中c(OH-)=0.001 mol·L-1,氨水的浓度一定大于0.001 mol·L-1,两溶液等体积混合后,氨水过量,溶液呈碱性,c(OH-)>c(H+),由电荷守恒c(NH+4)+c(H+)=c(Cl-)+c(OH-)可知,c(NH+4)>c(Cl-),溶液中各离子浓度大小为c(NH+4)>c(Cl-)>c(OH-)>c(H +)。
7.已知K sp(AgCl)=1.56×10-10,K sp(AgBr)=7.7×10-13,K sp(Ag2CrO4)=9.0×10-12。
某溶液中含有Cl-、Br-和CrO2-4,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L -1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()A.Cl-、Br-、CrO2-4B.CrO2-4、Br-、Cl-C.Br-、Cl-、CrO2-4D.Br-、CrO2-4、Cl-解析:选C设加入一定体积的AgNO3溶液时,溶液中Cl-、Br-和CrO2-4的浓度均为c mol·L-1,则形成AgCl、AgBr、Ag2CrO4沉淀所需Ag+浓度分别是K sp(AgCl)c mol·L-1、K sp(AgBr)c mol·L -1、K sp(Ag2CrO4)c mol·L-1,比较Ksp数值可知,Br-形成沉淀时所需Ag+浓度最小,即最先产生沉淀;CrO2-4形成沉淀时所需Ag+浓度最大,即最后产生沉淀。
8.室温下,向a点(pH=a)的20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。
下列有关说法错误的是()A.将此氨水稀释,溶液的导电能力减弱B.b点溶液中离子浓度大小可能存在:c(NH+4)>c(Cl-)>c(OH-)>c(H+)C.c点时消耗盐酸体积V(HCl)<20.00 mLD.a、d两点的溶液,水的离子积K W(a)>K W(d)解析:选D A项,稀释氨水,虽然促进一水合氨的电离,但溶液中离子浓度减小,导电能力降低,正确;B项,b点pH>7,c(OH-)>c(H+),溶液中电荷守恒为c(NH+4)+c(H +)=c(Cl-)+c(OH-),则c(NH+)>c(Cl-),即c(NH+4)>c(Cl-)>c(OH-)>c(H+),正确;C4项,溶液显中性时,HCl的物质的量小于一水合氨,所以c点消耗盐酸体积V(HCl)<20.00 mL,正确;D项,d点温度高于a点,水的离子积K W(a)<K W(d),错误。
二、不定项选择题9.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是()A.三种酸的电离常数关系:K HA>K HB>K HDB.滴定至P点时,溶液中:c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)解析:选BC根据起点pH:HA<HB<HD知酸性:HA>HB>HD,根据酸性越强,酸的电离常数越大,则K HA>K HB>K HD,故A项正确;P点时根据横坐标中和百分数为50%知c(HB)∶c(NaB)=1∶1,根据纵坐标pH<7知酸的电离程度大于盐的水解程度,故B项错误;根据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)和pH=7知c(Na+)=c(A-),同理c(Na +)=c(B-)、c(Na+)=c(D-),根据中和原理知溶液显中性时需要的NaOH的量不同,故c(Na +)不相同,则c(A-)、c(B-)、c(D-)三者不相同,C项错误;当中和百分数都达到100%时,溶液为NaA、NaB、NaD的混合物,则c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),即c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D项正确。
10.25 ℃时,将0.1 mol·L-1 NaOH溶液加入20 mL 0.1 mol·L-1 CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH的关系曲线如图所示。
下列结论正确的是()A.①点时,c(CH3COO-)+c(CH3COOH)=c(Na+)B.对曲线上①、②、③任何一点,溶液中都有:c(Na+)+c(H+)=c(OH-)+c(CH3COO -)C.③点时,醋酸恰好反应完,溶液中有:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)D.滴定过程中可能出现:c(H+)>c(Na+)>c(CH3COO-)>c(OH-)解析:选B A 项,在曲线上①点时混合溶液为等物质的量浓度的CH 3COONa 和CH 3COOH 溶液,根据物料守恒:c (CH 3COO -)+c (CH 3COOH)=2c (Na +),错误;B 项,曲线上①、②、③点溶液中均存在电荷守恒:c (Na +)+c (H +)=c (OH -)+c (CH 3COO -),正确;C 项,③点时,NaOH 与CH 3COOH 恰好完全反应,溶液呈碱性,则存在:c (Na +)>c (CH 3COO -)>c (OH -)>c (H +),错误;D 项,滴定过程中,溶液中均存在离子:CH 3COO -、Na +、H +、OH -,根据溶液电中性原则知,错误。