高考化学二轮复习 第1部分 专题突破篇 专题2 化学基本理论 第8讲 水溶液中的离子平衡课件
- 格式:ppt
- 大小:2.23 MB
- 文档页数:83


专题八电解质溶液A组基础巩固练1.(2022广东广州一模)溴甲基蓝(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。
下列叙述正确的是( )A.0.01 mol·L-1 HBb溶液的pH=2B.HBb溶液的pH随温度升高而减小C.向NaOH溶液中滴加HBb指示剂,溶液显黄色D.0.01 mol·L-1 NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb)2.(2022河北张家口一模)联氨(N2H4)溶于水后是一种二元弱碱,在水中的电离方式与氨相似。
25 ℃时,K b1(N2H4)=8.5×10-7,K b2(N2H4)=8.9×10-16。
下列说法错误的是 ( )A.0.10 mol·L-1的N2H5Cl溶液呈酸性B.N2H4的第二步电离方程式为N2+H2O N2+OH-C.N2H4与稀硫酸中和生成的酸式盐的化学式为N2H5HSO4D.N2H4的稀溶液中存在c(OH-)=c(N2)+2c(N2)+c(H+)3.(2022广东梅州一模)甲胺(CH3NH2)为一元弱碱,可与盐酸反应生成盐酸盐(用CH3NH3Cl表示)。
将10 mL 0.1 mol·L-1 CH3NH2溶液与10 mL 0.1 mol·L-1盐酸混合。
下列叙述不正确是( )A.混合溶液呈酸性,加水稀释,n(H+)增加B.甲胺在水中的电离方程式为CH3NH2+H2O CH3N+OH-C.混合溶液中:c(CH3N)+c(Cl-)<0.1 mol·L-1D.往混合液中滴加少量NaOH溶液,可促进CH3N的水解,水解常数K h增大4.(2022内蒙古包头第二次模拟)25 ℃时,在0.10 mol·L-1的H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液的pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。


专题八 水溶液中的离子平衡研析最新考纲洞悉命题热点1.了解电解质的概念。
了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.了解水的电离、离子积常数。
4.了解溶液pH 的含义及其测定方法,能进行pH 的简单计算。
5.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
7.了解离子反应的概念、离子反应发生的条件。
掌握常见离子的检验方法。
8.了解难溶电解质的沉淀溶解平衡。
理解溶度积(K sp )的含义,能进行相关的计算。
1.弱电解质的电离平衡、盐类的水解平衡、沉淀溶解平衡的本质、影响因素及应用2.电离平衡常数、电离度、水的离子积、溶度积有关应用及计算3.中和滴定及仪器的使用、指示剂的选择及pH 的简单计算[全国卷]1.(2019·全国卷Ⅰ)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10-3,K a2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。
下列叙述错误的是( )A .混合溶液的导电能力与离子浓度和种类有关B .Na +与A 2-的导电能力之和大于HA -的C .b 点的混合溶液pH =7D .c 点的混合溶液中,c (Na +)>c (K +)>c (OH -)[解析] 滴定至终点时发生反应:2NaOH +2KHA===K 2A +Na 2A +2H 2O 。
溶液导电能力与溶液中离子浓度、离子种类有关,离子浓度越大、所带电荷越多,其导电能力越强,A 项正确;图像中纵轴表示“相对导电能力”,随着NaOH 溶液的滴加,溶液中c (K +)、c (HA -)逐渐减小,而Na +、A 2-的物质的量逐渐增大,由题图可知,溶液的相对导电能力逐渐增强,说明Na +与A 2-的导电能力之和大于HA -的,B 项正确;本实验默认在常温下进行,滴定终点时,溶液中的溶质为邻苯二甲酸钠和邻苯二甲酸钾,由于邻苯二甲酸是弱酸,所以溶液呈碱性,pH>7,C 项错误;滴定终点时,c (K +)=c (Na +),a 点到b 点加入NaOH 溶液的体积大于b 点到c 点的,故c 点时c (K +)>c (OH -),所以c (Na +)>c (K +)>c (OH -),D 项正确。


高三化学二轮复习题案 专题二 主备人:李慧 审核人:张广路 时间:A 、CH 3COOH 溶液加水稀释后,溶液中)(33-COO CH c 的值增大B 、对于110.0-⋅L mol 的氨水,其溶液的pH=13 C 、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 D 、中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等2、已知HF 的酸性强于CH COOH ,常温下有下列三种溶液。
有关叙述不正确的是( )A 3B .①②等体积混合后:c (CH 3COO -)>c (Na +)>c (H +)>c (OH -) C .中和相同体积的②③,需消耗相同体积的①D .向②中加入NaF 固体,CH 3COOH 电离平衡正向移动3、在一定温度下,有a 盐酸,b 硫酸,c 醋酸,三种酸:(1)当三种酸物质的量浓度相等时,c(H +)由大到小的顺序是 (2)若三者c(H +)相同,物质的量浓度由大到小的顺序是(3)将c(H +)相同的三种酸均加水稀释至原来的100倍,c(H +)由大到小的顺序是【考点二:水的电离平衡及PH 】4.常温下,下列叙述错误的是( )A .向0.1 mol·L -1的醋酸溶液中加水或通入HCl 气体都能使c H +c C H 3COOH的值增大B .某溶液中水电离出的[OH -]=1×10-13mol •L -1,溶液一定显碱性 C .pH =4的醋酸与pH =10的氢氧化钠溶液等体积混合,所得溶液pH <7D .0.1 mol·L -1某一元酸HA 溶液中c OH -c H +=1×10-8,则该溶液中由水电离出的c (H +)=1×10-11mol·L -1 5、下列说法正确的是( ) A 、向蒸馏水中加浓H 2SO 4,K W 不变 B 、NaCl 溶液和CH 3COONH 4溶液均显中性,两溶液中水的电离程度相同 C 、25℃与60℃时,水的pH 相等 D 、水的离子积常数K W 随着温度的升高而增大,说明水的电离是放热反应【考点三:盐类的水解及离子浓度比较】6.用黄色的FeCl 溶液分别进行下列实验,解释或结论不正确的是( ) 3得1L 溶液,若此溶液中c(CH 3COO —)>c(Cl —),则下列判断不正确的是( ) A 、该溶液的pH 小于7 B 、c(CH 3COOH)+c(CH 3COO —)=0.20 mol·L -1 C 、c(CH 3COOH)<c(CH 3COO —) D 、c(CH 3COO —)+c(OH —)=0.10 mol·L -18、已知NaHSO 4在水中的电离方程式为 NaHSO 4===Na ++ H + + SO 2-4。


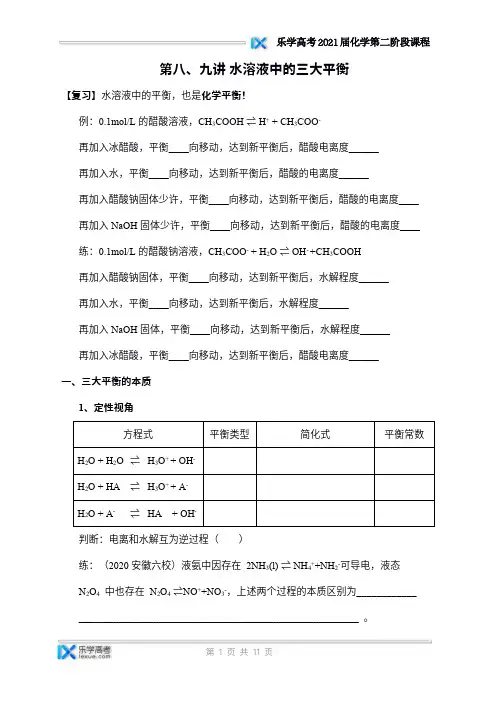
第八、九讲水溶液中的三大平衡【复习】水溶液中的平衡,也是化学平衡!例:0.1mol/L的醋酸溶液,CH3COOH⇌H++CH3COO-再加入冰醋酸,平衡____向移动,达到新平衡后,醋酸电离度______再加入水,平衡____向移动,达到新平衡后,醋酸的电离度______再加入醋酸钠固体少许,平衡____向移动,达到新平衡后,醋酸的电离度____再加入NaOH固体少许,平衡____向移动,达到新平衡后,醋酸的电离度____练:0.1mol/L的醋酸钠溶液,CH3COO-+H2O⇌OH-+CH3COOH再加入醋酸钠固体,平衡____向移动,达到新平衡后,水解程度______再加入水,平衡____向移动,达到新平衡后,水解程度______再加入NaOH固体,平衡____向移动,达到新平衡后,水解程度______再加入冰醋酸,平衡____向移动,达到新平衡后,醋酸电离度______一、三大平衡的本质1、定性视角方程式平衡类型简化式平衡常数H2O+H2O⇌H3O++OH-H2O+HA⇌H3O++A-H2O+A-⇌HA+OH-判断:电离和水解互为逆过程()练:(2020安徽六校)液氨中因存在2NH3(l)⇌NH4++NH2-可导电,液态N2O4中也存在N2O4⇌NO++NO3-,上述两个过程的本质区别为____________ ________________________________________________________。
2、广义酸碱理论:能够提供质子或接受OH-的为_____反之为______H2S()、S2-()、HS-()、H2O()Mg2+、Al3+()、Al(OH)3()N2H4:例:NH4Cl溶液显酸性的原因是______________________________________练:(2019国一)根据H3BO3的解离反应:H3BO3+H2O⇌H++B(OH)−4,K a=5.81×10−10,可判断H3BO3是________酸;3、定量视角问题(1)三大平衡K的关系(图示法)一元酸碱及其盐体系多元酸碱及其盐体系例:25℃时,H2SO3⇌HSO3﹣+H+的电离常数K a=1×10﹣2mol/L,则该温度下NaHSO3的水解平衡常数K h=mol/L.练:(2016国二)联氨为二元弱碱,在水中的电离方式与氨相似.25℃联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+⇌N2H5+的K=8.7×107).联氨与硫酸形成的酸式盐的化学式为___________________.练:已知H3AsO4的p K a1、p K a2、p K a3依次为2.25、6.77、11.40,25℃NaH2AsO4显_______性,计算说明_____________________________________________ ______________________________________________________________________二、酸碱盐溶液的pHpH=_________,pOH=____________25℃下,pH+pOH=_________1、pH定量计算例:已知CH3COOH的K a值为1.8×10-5(10-4.75),求0.1mol/L醋酸的pH例:已知0.1mol/L的HA的pH为2,求K a方法一:方法二:【技巧】高中pH速算大法(适用范围:c0/Ki>____,且c0=_______________)一元酸:一元盐:一元碱:二元酸:二元酸正盐:练:已知25℃0.1mol/L Na2CO3溶液的pH=11.6,求H2CO3的K a2【注意】(1)酸式盐pH速算,2pH=____________,仅在一定浓度范围内成立(2)较强的酸、碱公式不适用(不能进行_______计算)2、温度对pH影响【推导】升高温度溶液pH如何变化?(不考虑挥发性)若溶液为强酸(H2SO4等),则T↑,pH_________若溶液为其他,则T↑,pH___________(1)HAc、NH4Cl:(2)NaOH:(3)NaAc:(4)NH3·H2O:例:(2014江苏)加热0.1mol/L的Na2CO3溶液,CO32-的水解程度____,溶液的碱性____,溶液的pH______练:(2019北京)实验测得0.5mol·L−1CH3COONa溶液、0.5mol·L−1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。

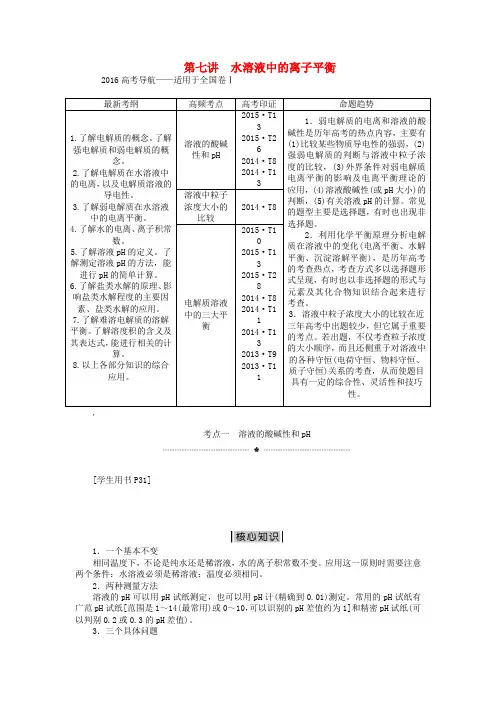
第七讲 水溶液中的离子平衡2016高考导航——适用于全国卷Ⅰ考点一 溶液的酸碱性和pH[学生用书P31]1.一个基本不变相同温度下,不论是纯水还是稀溶液,水的离子积常数不变。
应用这一原则时需要注意两个条件:水溶液必须是稀溶液;温度必须相同。
2.两种测量方法溶液的pH 可以用pH 试纸测定,也可以用pH 计(精确到0.01)测定。
常用的pH 试纸有广范pH 试纸[范围是1~14(最常用)或0~10,可以识别的pH 差值约为1]和精密pH 试纸(可以判别0.2或0.3的pH 差值)。
3.三个具体问题(1)溶液中的c (H +)和水电离出来的c (H +)的区别①室温下水电离出的c (H +)=1×10-7 mol·L -1,若某溶液中水电离出的c (H +)<1×10-7 mol·L -1,则可判断该溶液呈酸性或碱性;若某溶液中水电离出的c (H +)>1×10-7mol·L -1,则可判断出该溶液中存在能水解的盐,从而促进了水的电离。
②室温下,溶液中的c (H +)>1×10-7 mol·L -1,说明该溶液是酸溶液或水解呈酸性的盐溶液等;溶液中的c (H +)<1×10-7 mol·L -1,说明该溶液是碱溶液或水解呈碱性的盐溶液等。
(2)计算溶液pH 的原则(3)常温下,强酸与强碱溶液pH 之和分析pH(酸)+pH(碱)⎩⎪⎨⎪⎧=14时,c 酸+=c 碱->14时,c 酸+c 碱-<14时,c 酸+c 碱-弱电解质的电离平衡1.(性质判断类)(2015·高考全国卷Ⅰ,T13,6分)浓度均为 0.10 mol·L -1、体积均为V 0的MOH 和ROH 溶液,分别加水稀释至体积V ,pH 随lg VV 0的变化如图所示。
下列叙述错误的是( )A .MOH 的碱性强于ROH 的碱性B .ROH 的电离程度:b 点大于a 点C .若两溶液无限稀释,则它们的c (OH -)相等D .当lg V V 0=2时,若两溶液同时升高温度,则c+c+增大[破题关键] 等浓度的两种一元碱,强碱的pH 大于弱碱的pH ;加水稀释,弱电解质的电离程度增大;无限稀释,溶液的pH 接近于纯水的pH 。
热点强化23 有关水溶液中平衡常数关系计算1.水解常数与电离常数、水的离子积之间的关系常温下,H 2S 的电离常数为K a1、K a2,推导Na 2S 溶液中S 2-水解常数K h1、K h2与K a1、K a2的关系。
答案 S 2-+H 2OHS -+OH -K h1=c (HS -)·c (OH -)c (S 2-)=c (HS -)·c (H +)·c (OH -)c (S 2-)·c (H +)=K wK a2。
HS -+H 2OH 2S +OH -K h2=c (H 2S )·c (OH -)c (HS -)=c (H 2S )·c (OH -)·c (H +)c (HS -)·c (H +)=K wK a1。
2.水解常数与溶度积、水的离子积之间的关系常温下推导Cu 2+的水解常数与溶度积、水的离子积之间的关系。
答案 Cu 2++2H 2OCu(OH)2+2H +K h =c 2(H +)c (Cu 2+)=c 2(H +)·c 2(OH -)c (Cu 2+)·c 2(OH -)=K 2wK sp [Cu (OH )2]。
3.平衡常数与电离常数、溶度积之间的关系 (1)以反应CuS(s)+2Ag +(aq)Cu 2+(aq)+Ag 2S(s)为例,推导沉淀转化的平衡常数K 。
答案 K =c (Cu 2+)c 2(Ag +)=c (Cu 2+)·c (S 2-)c 2(Ag +)·c (S 2-)=K sp (CuS )K sp (Ag 2S )。
(2)以反应ZnS(s)+2H +(aq)Zn 2+(aq)+H 2S(aq)为例,推导该沉淀溶解的平衡常数K 。
答案 K =c (H 2S )·c (Zn 2+)c 2(H +)=c (H 2S )·c (Zn 2+)·c (S 2-)c 2(H +)·c (S 2-)=K sp (ZnS )K a1·K a2。