高三化学二轮复习 第1部分 专题2 化学基本理论 突破点9 水溶液中的离子平衡课件
- 格式:ppt
- 大小:2.27 MB
- 文档页数:10




高考化学复习考点知识突破解析水溶液中的离子平衡1.(2022届·湖南高三月考)Al 3+与F -具有很强的亲和性,当F -的浓度过大时,还会形成AlF 63-。
AlF 3在一定溶剂中也存在分步电离(溶液中存在AlF 3、AlF 2+、AlF 2+、Al 3+等含铝的粒子),常温下,实验测定某浓度的AlF 3中各种含铝的粒子百分含量随p[p= - lg c(F -)]的变化如图所示,下列说法不正确的是( )A .常温下,电离方程式:AlF3 AlF 2++F -的K(AlF 3)的数量级为10-4B .曲线c 表示AlF 2+C .p=6时,溶液中c(AlF 2+)>c(Al 3+)>c(AlF 2+)D .常温下,向AlF 3溶液中加入氟化钠固体,()()22c AlF c AlF ++变小【答案】B【解析】根据图像得到,p[p= - lg c(F -)]越小,则c(F -)越大,从左到右c(F -)越来越大,当c(F -)很小时,浓度最大的是Al 3+,随着c(F -)逐渐增大,Al 3+与一个F -结合得到AlF 2+,然后AlF 2+再与一个F -结合得到AlF 2+,然后AlF 2+再与一个F -结合得到AlF 3,最后AlF 3与三个F -结合得到AlF 63-,因此a 、b 、c 、d 四条曲线分别代表Al 3+、AlF 2+、AlF 2+、AlF 3。
A 项,根据题中信息,p[p= - lg c(F -)]越小,则c(F -)越大,因此p =3.7时AlF 3与AlF 2+浓度相等,因此在常温下,电离方程式:AlF 3AlF 2++F -的2 3.73AlF F F Al ()()==()110()F c c K c c +---⋅=⨯,因此K(AlF 3)的数量级为10-4,故A 正确;B 项,根据前面分析得出曲线c 表示AlF 2+,故B 错误;C 项,根据图中信息,当p=6时,从p=6的点作一条与y 轴相平的平行线,根据a 、b 、c 曲线分别代表Al 3+、AlF 2+、AlF 2+,因此从图中曲线得到溶液中c(AlF 2+)>c Al 3+)>c(AlF 2+),故C 正确;D 项,常温下,向AlF 3溶液中加入氟化钠固体,c(F -)增大,222()()()AlF AlF AlF F ()c K c c +++-=变小,故D 正确。

高考化学二轮复习专题考点剖析—水溶液中的离子平衡必备知识解读一、弱电解质的电离(弱电解质:包括弱酸、弱碱、极少数盐(如醋酸铅)、两性氢氧化物、水等。
)1.电离度(1)概念在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质总分子数的分数。
(2)表示方法α=已电离的弱电解质分子数溶液中原有弱电解质的总分子数×100%也可表示为α=弱电解质的离子浓度弱电解质的浓度×100%(3)影响因素温度的影响升高温度,电离平衡向右移动,电离度增大;降低温度,电离平衡向左移动,电离度减小浓度的影响当弱电解质溶液浓度增大时,电离度减小;当弱电解质溶液浓度减小时,电离度增大2.电离常数(1)概念:电离平衡的常数叫做电离常数。
(2)表达式①对于一元弱酸HA :HAH ++A -,电离常数K a =c(H +)·c (A -)c(HA)。
②对于一元弱碱BOH :BOH B ++OH -,电离常数K b =c(B +)·c(OH -)c(BOH -)。
(3)特点多元弱酸各级电离常数的大小关系是K 1≫K 2≫K 3,故其酸性取决于第一步电离。
(4)影响因素内因:弱电解质本身的性质外因:电离常数只与温度有关,升高温度,K值增大。
(5)意义K越大―→越易电离―→酸碱性越强如相同条件下常见弱酸的酸性强弱:H2C2O4>H2SO3>H3PO4>HF>HCOOH>CH3COOH>H2CO3>H2S>HClO。
3.电离常数的四大应用①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
②判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。
③判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
④计算弱酸、弱碱溶液中的c(H+)、c(OH-)。
有关电离平衡常数的计算(以弱酸HX为例)已知c(HX)和电离平衡常数,求c(H+)。
HX H++X-起始:c(HX)00平衡:c(HX)-c(H+)c(H+)c(X-)则:K=c(H+)·c(X-)c(HX)-c(H+)=c2(H+)c(HX)-c(H+)由于c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则c(H+)=K·c(HX),代入数值求解即可。
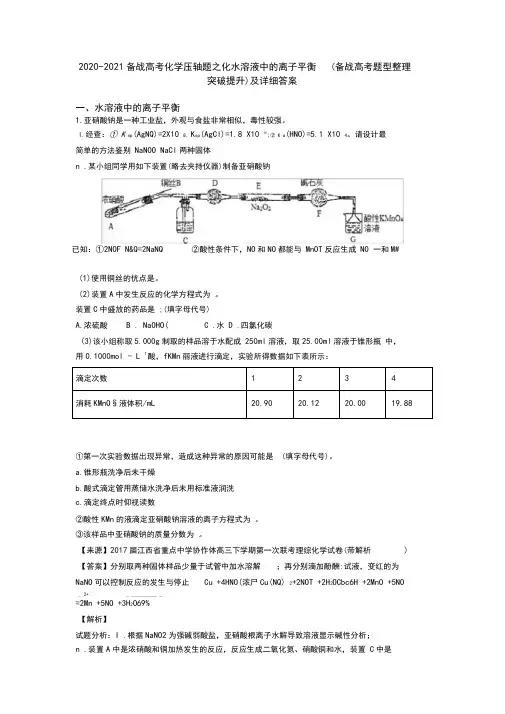
2020-2021备战高考化学压轴题之化水溶液中的离子平衡(备战高考题型整理突破提升)及详细答案一、水溶液中的离子平衡1.亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
I.经查:① K sp(AgNQ)=2X10 8, K sp(AgCl)=1.8 X10 10;② K a(HNO)=5.1 X10 4。
请设计最简单的方法鉴别NaNOO NaCl两种固体n .某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠已知:①2NOF N&Q=2NaNQ ②酸性条件下,NO和NO都能与MnOT反应生成NO 一和M#(1)使用铜丝的优点是。
(2)装置A中发生反应的化学方程式为。
装置C中盛放的药品是 ;(填字母代号)A.浓硫酸 B . NaOHO( C .水D .四氯化碳(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,用0.1000mol - L 1酸,fKMn丽液进行滴定,实验所得数据如下表所示:①第一次实验数据出现异常,造成这种异常的原因可能是 (填字母代号)。
a.锥形瓶洗净后未干燥b.酸式滴定管用蒸储水洗净后未用标准液润洗c.滴定终点时仰视读数②酸性KMn的液滴定亚硝酸钠溶液的离子方程式为。
③该样品中亚硝酸钠的质量分数为。
【来源】2017届江西省重点中学协作体高三下学期第一次联考理综化学试卷(带解析) 【答案】分别取两种固体样品少量于试管中加水溶解;再分别滴加酚酬:试液,变红的为NaNO可以控制反应的发生与停止Cu +4HNO(浓尸Cu(NQ) 2+2NOT +2H2OCbc6H +2MnO +5NO_ 2+ _ __________ _=2Mn +5NO +3H2O69%【解析】试题分析:I .根据NaNO2为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性分析;n .装置A中是浓硝酸和铜加热发生的反应,反应生成二氧化氮、硝酸铜和水,装置C中是A 装置生成的二氧化氮和水反应生成硝酸和一氧化氮;通过装置 D 中的干燥剂吸收水蒸气,通过装置 F 中的干燥剂防止水蒸气进入,通过装置 E 中的过氧化钠与一氧化氮反应,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,据此分析解答。

2020-2021高考化学综合题专题复习【化水溶液中的离子平衡】专题解析含详细答案一、水溶液中的离子平衡1.水合肼(N2H4·H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。
利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
实验1:制备NaClO溶液。
(已知:3NaClO Δ2NaCl+NaClO3)(1)如图装置Ⅰ中烧瓶内发生反应的化学方程式为___________。
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
a.烧杯b.容量瓶c.玻璃棒d.烧瓶(3)图中装置Ⅱ中用冰水浴控制温度的目的是__________ 。
实验2:制取水合肼。
(4)图中充分反应后,____________(填操作名称)A中溶液即可得到水合肼的粗产品。
若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。
写出该过程反应生成氮气的化学方程式 ________。
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250 mL溶液,移出25.00 mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15 mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在 ________(填“酸式”或“碱式”)滴定管中。
②下列能导致馏分中水合肼的含量测定结果偏高的是 _________(填字母)。
a.锥形瓶清洗干净后未干燥b.滴定前,滴定管内无气泡,滴定后有气泡c.读数时,滴定前平视,滴定后俯视d.盛标准液的滴定管水洗后,直接装标准液③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_________。

水溶液中的离子平衡1.数形结合思想应用——分布系数曲线真题研究1.(2017·全国卷Ⅱ,12)常温下,改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=c(X)c(H2A)+c(HA-)+c(A2-)]。
下列叙述错误的是()A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-4.2C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)D.pH=4.2时,c(HA-)>c(A2-)>c(H+)2.(2022·辽宁,15)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。
在25 ℃时,NH+3CH2COOH、NH+3CH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]与溶液pH关系如图。
下列说法错误的是()A.甘氨酸具有两性B.曲线c代表NH2CH2COO-C.NH+3CH2COO-+H2O NH+3CH2COOH+OH-的平衡常数K=10-11.65D.c2(NH+3CH2COO-)<c(NH+3CH2COOH)·c(NH2CH2COO-)3.(2020·全国卷Ⅰ,13)以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如下图所示。
[比如A2-的分布系数:δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]下列叙述正确的是()A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.200 0 mol·L-1C.HA-的电离常数K a=1.0×10-2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)模拟演练1.(2022·福建漳州一模)边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液,水溶液中H2SO3、HSO-3、SO2-3的分布系数δ随pH的变化关系如图所示。

高三化学二轮复习题案 专题二 主备人:李慧 审核人:张广路 时间:A 、CH 3COOH 溶液加水稀释后,溶液中)(33-COO CH c 的值增大B 、对于110.0-⋅L mol 的氨水,其溶液的pH=13 C 、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 D 、中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等2、已知HF 的酸性强于CH COOH ,常温下有下列三种溶液。
有关叙述不正确的是( )A 3B .①②等体积混合后:c (CH 3COO -)>c (Na +)>c (H +)>c (OH -) C .中和相同体积的②③,需消耗相同体积的①D .向②中加入NaF 固体,CH 3COOH 电离平衡正向移动3、在一定温度下,有a 盐酸,b 硫酸,c 醋酸,三种酸:(1)当三种酸物质的量浓度相等时,c(H +)由大到小的顺序是 (2)若三者c(H +)相同,物质的量浓度由大到小的顺序是(3)将c(H +)相同的三种酸均加水稀释至原来的100倍,c(H +)由大到小的顺序是【考点二:水的电离平衡及PH 】4.常温下,下列叙述错误的是( )A .向0.1 mol·L -1的醋酸溶液中加水或通入HCl 气体都能使c H +c C H 3COOH的值增大B .某溶液中水电离出的[OH -]=1×10-13mol •L -1,溶液一定显碱性 C .pH =4的醋酸与pH =10的氢氧化钠溶液等体积混合,所得溶液pH <7D .0.1 mol·L -1某一元酸HA 溶液中c OH -c H +=1×10-8,则该溶液中由水电离出的c (H +)=1×10-11mol·L -1 5、下列说法正确的是( ) A 、向蒸馏水中加浓H 2SO 4,K W 不变 B 、NaCl 溶液和CH 3COONH 4溶液均显中性,两溶液中水的电离程度相同 C 、25℃与60℃时,水的pH 相等 D 、水的离子积常数K W 随着温度的升高而增大,说明水的电离是放热反应【考点三:盐类的水解及离子浓度比较】6.用黄色的FeCl 溶液分别进行下列实验,解释或结论不正确的是( ) 3得1L 溶液,若此溶液中c(CH 3COO —)>c(Cl —),则下列判断不正确的是( ) A 、该溶液的pH 小于7 B 、c(CH 3COOH)+c(CH 3COO —)=0.20 mol·L -1 C 、c(CH 3COOH)<c(CH 3COO —) D 、c(CH 3COO —)+c(OH —)=0.10 mol·L -18、已知NaHSO 4在水中的电离方程式为 NaHSO 4===Na ++ H + + SO 2-4。

2017高考化学大二轮复习第1部分知识整合专题2 基本理论第9讲水溶液中的离子平衡编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017高考化学大二轮复习第1部分知识整合专题2 基本理论第9讲水溶液中的离子平衡)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017高考化学大二轮复习第1部分知识整合专题2 基本理论第9讲水溶液中的离子平衡的全部内容。
第9讲水溶液中的离子平衡[限时50分钟,满分70分]一、选择题(包括7个小题,每小题5分,共35分)1.(2016·上海高考)能证明乙酸是弱酸的实验事实是A.CH3COOH溶液与Zn反应放出H2B.0.1 mol·L-1 CH3COONa溶液的pH大于7C.CH3COOH溶液与Na2CO3反应生成CO2D.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红解析A.只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B.该盐水溶液显碱性,由于NaOH是强碱,故可以证明乙酸是弱酸,正确;C。
可以证明乙酸的酸性比碳酸强,但是不能证明其酸性强弱,错误;D.可以证明乙酸具有酸性,但是不能证明其酸性强弱,错误。
答案B2.(2015·广东高考)一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是A.升高温度,可能引起有c向b的变化B.该温度下,水的离子积常数为1。
0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化解析A.c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小。

水溶液中的离子平衡知识点一、电解质1.强、弱电解质与物质分类的关系2.强、弱电解质与化学键的关系一般电解质的键型不同,电离程度就不同,已知典型的离子化合物,如强碱(NaOH、KOH等)、大部分盐类(如NaCl、CaCl2)以及强极性共价化合物(如HCl、H2SO4),在水分子作用下能够全部电离,我们称这种在水溶液中能够完全电离的物质为强电解质。
而含弱极性键的共价化合物如CH3COOH、NH3·H2O、H2O等,在水中仅部分电离,为弱电解质。
但是,仅从键型来区分强、弱电解质是不全面的,即使强极性共价化合物也有属于弱电解质的情况,如HF。
3.弱电解质的判断在中学化学电解质溶液这一知识点的学习中,常常需要根据一些性质对强弱电解质进行有关判断和分析,属于高考的热点。
现以弱酸为例进行分析,常见的判断方法有:(1)测定已知物质的量浓度的弱酸的pH。
如已知酸HB,物质的量浓度为0.01 mol·L-1,若为强酸,则完全电离,c(H+)=0.01 mol·L-1,pH=2;若为弱酸,则部分电离,c(H+)<0.01 mol·L-1,pH>2。
(2)取一定体积的酸HB溶液(设取1体积),测定其pH,稀释至体积扩大100倍,再测定其pH。
若pH 增大2个单位,则为强酸;若pH增大小于2个单位,则为弱酸。
(3)取酸HB对应的钠盐溶液,测定其pH。
若pH=7,则为强酸;若pH>7,则为弱酸。
(4)取体积和pH相同的酸HB溶液和盐酸,分别加入足量的锌粒,若HB产生H2的速率大且量多,说明是弱酸。
(5)分别取等体积等pH的酸HB和盐酸进行中和滴定,若达到终点时酸HB消耗的同浓度的NaOH溶液体积大,说明HB为弱酸。
(6)分别取相同物质的量浓度的酸HB溶液和盐酸,测其导电性,若酸HB溶液的导电能力弱,说明HB为弱酸。
(7)分别取相同pH的酸HB溶液和盐酸,向其中加入NaCl晶体和NaB晶体,振荡,待晶体溶解后,盐酸的pH几乎不变,若酸HB溶液的pH增大,说明HB为弱酸。
突破点9 水溶液中离子平衡提炼1 电离平衡及应用微弱电离,发生电离弱电解质及产生离子都是少量,同时注意考虑水电离如0.1 mol/L氨水中,由于存在电离平衡:NH 3·H2O NH+4+OH -、H2O H++OH-,所以溶液中微粒浓度关系为c(NH3·H2O)>c(OH-)>c(NH+4)>c(H+)。
2.多元弱酸电离分步进展,主要以第一步电离为主如H2S溶液中,由于存在电离平衡:H2S HS-+H+、HS-S2-+H+、H2O H++OH-,所以溶液中微粒浓度关系为c(H2S)>c(H+)>c(HS-)>c(S2-)。
3.电离平衡常见影响因素分析(以CH3COOH CH3COO-+H+为例)改变条件平衡移动方向c(H+)K a升高温度正向移动增大增大加水稀释正向移动减小不变加冰醋酸正向移动增大不变加浓盐逆向移动增大不变4.一样比拟溶液中c(H+)与c(OH-)相对大小,而pH=7或c(H+)=1×10-7mol·L-1,仅仅是在室温下特例,因此在使用pH判断溶液酸碱性时,要特别注意温度条件。
提炼2 水解平衡及应用1.水解是微弱如浓度为0.1 mol/L、pH=5.5(NH4)2SO4溶液中,由于c(H+)=c(OH-)水,而水电离产生一局部OH-与很少量NH+4结合产生水NH3·H2O,所以溶液中微粒浓度关系为c(NH+4)>c(SO2-4)>c(H+)>c(NH3·H2O)>c(OH-)。
2.盐溶液酸碱性(1)正盐:谁弱谁水解,谁强显谁性。
强碱弱酸盐(如CH3COONa)―→弱酸根离子水解→结果:c(OH-)>c(H+)。
强酸弱碱盐(如NH4Cl)―→弱碱阳离子水解→结果:c(H+)>c(OH-)。
(2)酸式盐溶液3.盐类水解离子方程式(1)多元弱酸盐水解分步进展,以第一步为主,一般只写第一步水解离子方程式,如Na2CO3水解离子方程式:CO2-3+H2O HCO-3+OH-。
高考必考水溶液中的离子平衡要点和答案解析§1 知识要点一、弱电解质的电离1、定义:电解质、非电解质 ;强电解质 、弱电解质下列说法中正确的是( BC )A 、能溶于水的盐是强电解质,不溶于水的盐是非电解质;B 、强电解质溶液中不存在溶质分子;弱电解质溶液中必存在溶质分子;C 、在熔融状态下能导电的化合物一定是离子化合物,也一定是强电解质;D 、Na 2O 2和SO 2溶液于水后所得溶液均能导电,故两者均是电解质。
2、电解质与非电解质本质区别:在一定条件下(溶于水或熔化)能否电离(以能否导电来证明是否电离)电解质——离子化合物或共价化合物 非电解质——共价化合物离子化合物与共价化合物鉴别方法:熔融状态下能否导电下列说法中错误的是( B )A 、非电解质一定是共价化合物;离子化合物一定是强电解质;B 、强电解质的水溶液一定能导电;非电解质的水溶液一定不导电;C 、浓度相同时,强电解质的水溶液的导电性一定比弱电解质强;D 、相同条件下,pH 相同的盐酸和醋酸的导电性相同。
3、强电解质与弱电质的本质区别:在水溶液中是否完全电离(或是否存在电离平衡)注意:①电解质、非电解质都是化合物 ②SO 2、NH 3、CO 2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质)4、强弱电解质通过实验进行判定的方法(以HAc 为例):(1)溶液导电性对比实验; (2)测0.01mol/LHAc 溶液的pH>2;(3)测NaAc 溶液的pH 值; (4)测pH= a 的HAc 稀释100倍后所得溶液pH<a +2(5)将物质的量浓度相同的HAc 溶液和NaOH 溶液等体积混合后溶液呈碱性(6)中和10mLpH=1的HAc 溶液消耗pH=13的NaOH 溶液的体积大于10mL;(7)将pH=1的HAc 溶液与pH=13的NaOH 溶液等体积混合后溶液呈酸性(8)比较物质的量浓度相同的HAc 溶液与盐酸分别与同样的锌粒反应产生气体的速率最佳的方法是 和 ;最难以实现的是 ,说明理由 。