马来酸氯苯那敏片工艺流程图
- 格式:doc
- 大小:31.00 KB
- 文档页数:1

马来酸氯苯那敏片的质量标准内容下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!马来酸氯苯那敏片的质量标准内容引言马来酸氯苯那敏片是一种常见的药物,广泛应用于治疗过敏症状,如流行性感冒、过敏性鼻炎和荨麻疹等。
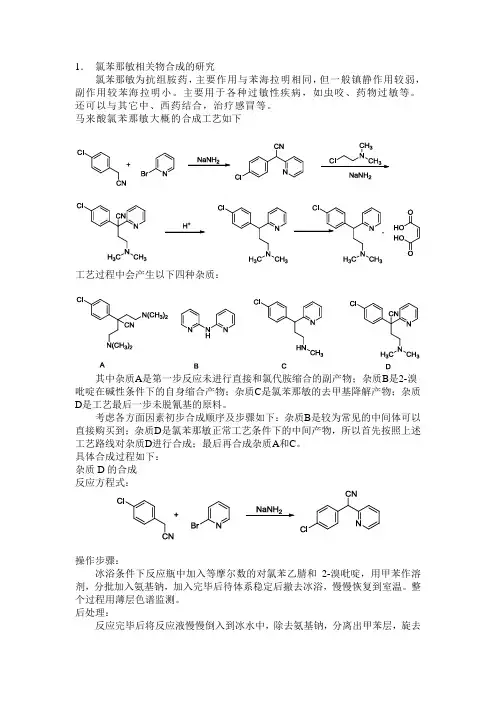
1.氯苯那敏相关物合成的研究氯苯那敏为抗组胺药,主要作用与苯海拉明相同,但一般镇静作用较弱,副作用较苯海拉明小。
主要用于各种过敏性疾病,如虫咬、药物过敏等。
还可以与其它中、西药结合,治疗感冒等。
马来酸氯苯那敏大概的合成工艺如下工艺过程中会产生以下四种杂质:其中杂质A是第一步反应未进行直接和氯代胺缩合的副产物;杂质B是2-溴吡啶在碱性条件下的自身缩合产物;杂质C是氯苯那敏的去甲基降解产物;杂质D是工艺最后一步未脱氰基的原料。
考虑各方面因素初步合成顺序及步骤如下:杂质B是较为常见的中间体可以直接购买到;杂质D是氯苯那敏正常工艺条件下的中间产物,所以首先按照上述工艺路线对杂质D进行合成;最后再合成杂质A和C。
具体合成过程如下:杂质D的合成反应方程式:操作步骤:冰浴条件下反应瓶中加入等摩尔数的对氯苯乙腈和2-溴吡啶,用甲苯作溶剂,分批加入氨基钠,加入完毕后待体系稳定后撤去冰浴,慢慢恢复到室温。
整个过程用薄层色谱监测。
后处理:反应完毕后将反应液慢慢倒入到冰水中,除去氨基钠,分离出甲苯层,旋去甲苯,用水和乙酸乙酯提取,对乙酸乙酯层干燥,然后柱层析得到目标产物。
反应方程式:操作步骤:向反应瓶中加入等摩尔的上步产物和氯代胺盐酸盐,用甲苯作溶剂,室温下加入两倍量的氨基钠,逐步升温至80℃,整个过程用薄层色谱监测。
后处理:反应完毕后反应液慢慢冷却至室温。
处理过程同上步。
杂质C的合成最初设计的合成路线如下:第一步同杂质D一样反应较单一,但从第二步开始反应就较复杂,薄层检测,杂点较多。
接着又考虑到了第二条路线但是此路线较长我们又从原料药出发提出了第三条路线:最后我们按第三条路线先将原料药马来酸氯苯那敏用浓氢氧化钠溶液碱化后,用乙醚萃取,然后用氯甲酸乙酯和甲基氯化镁作为去甲基化试剂最终合成了目标产物。
杂质A的合成合成路线如下:起初操作过程如下:冰浴条件下反应瓶中加入等摩尔数的对氯苯乙腈和氯代胺盐酸盐,用甲苯作溶剂,分批加入两倍量的氨基钠,加入完毕后待体系稳定后,再加入等倍量的氯代胺盐酸盐和分批加入两倍量的氨基钠撤去冰浴,慢慢恢复到室温。

各制剂工艺流程图
清晰简洁
1.选料:原料的选择根据药物特性决定,以确保最终胶囊的质量符
合要求。
2.配料:胶囊的配料一般有:填料、润料、增粘剂,等等,根据不
同的药物要求选取合适的原料并进行混合配料。
3.过滤:将混合好的末上在筛网上过滤,以确保末的质量符合要求。
4.压药:将上述末投料到压片机机器腔内,按操作规程进行压制,
以形成胶囊壳片。
5.检验:检查压出的胶囊壳片的大小、质量和外观是否符合要求。
6.润湿:把经过检验合格的胶囊壳片放入润湿机中进行润湿,以使
得胶囊壳片的外表质量更佳。
7.自动充填:将润湿的胶囊壳片放入自动充填机中,按照操作规程
进行操作,使得胶囊壳片内表面均匀质量更佳。
8.检验:检查充填后的胶囊壳片的质量是否符合要求。
9.成型:将充填后的胶囊壳片放入成型机中进行成型,以确保最终
胶囊的质量。
10.检验:检查成型后的胶囊的质量是否符合要求。
11.包装:将验证合格的胶囊放入包装袋中进行包装、封口、称重和
中性化处理。
12.检验:确保最终的产品中无未检出污染物,同时检查包装袋的外观是否符合要求。

编号:P-TS-T-043-3马来酸氯苯那敏片生产工艺规程药业有限公司1、品名、代码、剂型、规格2、批准文号3、处方与依据4、产品概述及历史沿革5、生产工艺流程及环境区域划分示意图6、本品在生产与贮藏期间的要求7、生产用物料质量标准;半成品、成品内控质量标准;成品法定质量标准8、操作过程及工艺条件9、物料平衡的计算及其平衡限度10、产品质量控制要点、项目、检查频次11、包装材料名称、代码、质量标准及编号12、原辅料、包装材料消耗定额13、设备一览表14、劳动组织、岗位定员与生产周期15、技术安全与劳动保护16、工艺卫生17、动力消耗定额、综合利用与三废处理18、附页药业有限公司GMP 管理文件工艺规程目的:建立马来酸氯苯那敏片生产工艺规程,明确马来酸氯苯那敏片生产过程的要求和内容,规范马来酸氯苯那敏片生产和质量管理,保证马来酸氯苯那敏片产品的质量。
范围:马来酸氯苯那敏片生产的工艺过程。
责任人:公司生产和质量管理人员,车间管理人员。
1、品名、代码、剂型、规格1.1品名:马来酸氯苯那敏片代码:CG068 剂型:片剂规格:4mg2、批准文号国药准字H3、处方与依据处方处方依据中国药典2010 年版二部4、产品概述及历史沿革产品概述本品每片含马来酸氯苯那敏4 毫克。
辅料为:淀粉、糊精、羧甲淀粉钠、硬脂酸镁4.1.1性状:本品为白色片。
4.1.2适应症:本品适用于皮肤过敏症;荨麻疹、湿疹、皮炎,药疹,皮肤瘙痒症、神经性皮炎、虫咬症、日光性皮炎。
也可用于过敏性鼻炎,药物及食物过敏。
4.1.3用法用量:口服。
成人一次1 片,一日3 次。
4.1.4包装:口服固体药用高密度聚乙烯瓶装,100 片/瓶,1000 片/瓶;聚氯乙烯固体药用硬片、药品包装用铝箔,24片×1 板/盒。
4.1.5贮藏:遮光,密封保存。
4.1.6有效期:24 个月。
历史沿革我公司马来酸氯苯那敏片于1982 年4 月12 日经河南省卫生厅批准生产,批准文号为豫卫药准字(1982)32016号,执行标准为中国药典1977 年版;1996年批准文号变更为豫卫药准字(1996)032016号;执行标准为中国药典1995年版;2003年7月1 日经国家药品监督管理局重新注册为国药准字H;执行标准为中国药典2000 年版,2005 年7月1日执行中国药典2005年版。

编号:P-TS-T-043-3马来酸氯苯那敏片生产工艺规程-------药业有限公司目录1、品名、代码、剂型、规格2、批准文号3、处方与依据4、产品概述及历史沿革5、生产工艺流程及环境区域划分示意图6、本品在生产与贮藏期间的要求7、生产用物料质量标准;半成品、成品内控质量标准;成品法定质量标准8、操作过程及工艺条件9、物料平衡的计算及其平衡限度10、产品质量控制要点、项目、检查频次11、包装材料名称、代码、质量标准及编号12、原辅料、包装材料消耗定额13、设备一览表14、劳动组织、岗位定员与生产周期15、技术安全与劳动保护16、工艺卫生17、动力消耗定额、综合利用与三废处理18、附页药业有限公司GMP管理文件工艺规程目的:建立马来酸氯苯那敏片生产工艺规程,明确马来酸氯苯那敏片生产过程的要求和内容,规范马来酸氯苯那敏片生产和质量管理,保证马来酸氯苯那敏片产品的质量。
范围:马来酸氯苯那敏片生产的工艺过程。
责任人:公司生产和质量管理人员,车间管理人员。
1、品名、代码、剂型、规格1.1品名:马来酸氯苯那敏片代码:CG068剂型:片剂规格:4mg2、批准文号国药准字H3、处方与依据处方处方依据中国药典2010年版二部4、产品概述及历史沿革产品概述本品每片含马来酸氯苯那敏4毫克。
辅料为:淀粉、糊精、羧甲淀粉钠、硬脂酸镁。
4.1.1 性状:本品为白色片。
4.1.2 适应症:本品适用于皮肤过敏症;荨麻疹、湿疹、皮炎,药疹,皮肤瘙痒症、神经性皮炎、虫咬症、日光性皮炎。
也可用于过敏性鼻炎,药物及食物过敏。
4.1.3 用法用量:口服。
成人一次1片,一日3次。
4.1.4 包装:口服固体药用高密度聚乙烯瓶装,100片/瓶,1000片/瓶;聚氯乙烯固体药用硬片、药品包装用铝箔,24片×1板/盒。
4.1.5 贮藏:遮光,密封保存。
4.1.6 有效期:24个月。
历史沿革我公司马来酸氯苯那敏片于1982年4月12日经河南省卫生厅批准生产,批准文号为豫卫药准字(1982)32016号,执行标准为中国药典1977年版;1996年批准文号变更为豫卫药准字(1996)032016号;执行标准为中国药典1995年版;2003年7月1日经国家药品监督管理局重新注册为国药准字H;执行标准为中国药典2000年版,2005年7月1日执行中国药典2005年版。




目的:为检验马来酸氯苯那敏规定一个标准的程序,以便获得准确的实验数据。
范围:适用于马来酸氯苯那敏的检验。
职责:检验室主任、检验员。
规程:1.性状:本品为白色结晶性粉末;无臭;味苦。
本品在水、乙醇或氯仿中易溶,在乙醚中微溶。
1.1 熔点:本品按熔点测定法(SOP-QC-307-00)测定,熔点在131~135℃范围内为符合规定。
1.2 吸收系数:精密称取本品约0.1g,置50ml容量瓶中,加盐酸溶液(稀盐酸1ml加水至100ml)溶解并稀释至刻度,摇匀;精密量取1ml,至100ml容量瓶中,加盐酸溶液至刻度,摇匀。
照分光光度法(SOP-QC-301-00)测定,在264nm的波长处测定吸收度,吸收系数()%1E为212~222为符合规定。
1cm2.鉴别2.1 试剂与仪器2.1.1 枸椽酸醋酐试液 2.1.2 稀硫酸溶液2.1.3 高锰酸钾试液 2.1.4 试管2.1.5 电子天平(万分之一克) 2.1.6 小型三用水浴箱2.1.7 IR470型红外光谱仪2.2 项目与步骤2.2.1 显色法:称取本品约10mg,加枸椽酸醋酐试液1ml,置水浴上加热,即显红紫色为符合规定。
2.2.2 红外吸收光谱的鉴别:称取本品约1.5mg,照红外分光光度法(SOP-QC-302-00)的压片法测定,本品的红外光吸收图谱应与对照的图谱(光谱集61图)一致为符合规定。
3.检查3.1 试剂与仪器3.1.1 氯仿 3.1.2 硅胶GF254薄层板3.1.3 醋酸乙酯-甲醇-稀醋酸(5:3:2) 3.1.4 PSHS-3C精密PH计3.1.5 黄色1号标准比色液 3.1.6 直热式电热恒温干燥箱3.1.7 茂福式电阻炉 3.1.8 烧杯(100ml)3.1.9 微量进样器(10μl) 3.1.10 2F-I型三用紫外光分析仪(254nm) 3.1.11 称量瓶 3.1.12 层析缸3.1.13 坩埚3.2 项目与步骤3.2.1 酸度:取本品1g,加水100ml至烧杯中溶解后,按PH值测定法(SOP-QC-312-00)测定,PH值应为4.0~5.0为符合规定。

实验六马来酸氯苯那敏片含量均匀度检查一、实验目的:通过均匀度检查,评价马来酸氯苯那敏片的生产工艺的稳定性和精确性,同时判断产品合格率。
二、实验原理:药物生产过程中,必须保证生产的每一批次产品符合规定的质量标准,并且不同批次之间的含量变化不应太大。
均匀度检查是一种对制药生产工艺稳定性和精确性的有效检验方法。
通常采用的方法是对同一批次的产品取数个样本,对样品进行有代表性的取样和分析。
检查结果可以提供产品的含量分布情况,以及批次变异的程度,并且可以解决不同批次产品之间的含量变化问题。
三、实验仪器和试剂1. 电子天平2. 萤光分光光度计3. 马来酸氯苯那敏片4. 水5. 乙醇四、实验步骤1. 取出马来酸氯苯那敏片一个批次的样品,将其混合均匀。
2. 从中随机取出10片马来酸氯苯那敏片,称重并记录质量。
3. 将这10片马来酸氯苯那敏片放入同一研钵中,加入10 mL 乙醇,用超声波处理5分钟,使药物充分溶解。
4. 转移一部分所得溶液到25 mL 体积瓶中,并以水稀释至刻度点,均匀混合。
5. 在萤光分光光度计中,以所得稀释液为测试样品,按照马来酸氯苯那敏片在254 nm光波长处的吸光度进行测量。
每个样品进行三次测量,取平均值。
6. 计算测试结果量值的均值及标准偏差,确保制药厂通过均匀度检查的标准。
五、实验注意事项:1. 实验过程中要严格遵守操作规程,不得将实验仪器、试剂污染或损坏。
2. 实验室操作人员必须身穿实验室制服,并按照实验室规定佩戴防护用品。
3. 在取样过程中,需要随机取数,以最大限度地减少误差。
四、实验结果与分析:通过分析实验数据,得出均值为8.30(mg),标准偏差值为0.05(mg),相对标准偏差率为0.60%。
通过与规范对比,可以得出该批次马来酸氯苯那敏片的生产工艺稳定性和精确性良好,产品合格率高。
六、结论:本次均匀度检查结果证实,这个批次马来酸氯苯那敏片的生产工艺非常稳定且精确,这样的结果证明我们的制药生产工艺与规范要求很好的相符。

马来酸氯苯那敏的新用途的制作方法专利名称:马来酸氯苯那敏的新用途的制作方法技术领域:本发明属于一种药物马来酸氯苯那敏的新用途,具体而言是马来酸氯苯那敏在治疗肝炎药物中的用途。
背景技术:马来酸氯苯那敏又名扑尔敏,为组胺拮抗剂,通过与组胺竞争组胺H1受体而对抗组胺的过敏作用;但不影响组胺的代谢,也不阻止组胺的释放;扑尔敏还有抗胆碱M受体作用,作用于胆碱毒蕈样受体,使得鼻黏膜干燥。
临床主要用于治疗过敏性鼻炎、皮肤黏膜的过敏。
发明内容本发明的内容是发现了马来酸氯苯那敏在治疗肝炎方面的用途。
马来酸氯苯那敏的新用途,是用于治疗肝炎。
马来酸氯苯那敏的新用途在于用于降低丙氨酸转氨酶ALT、天门冬氨酸氨基转移酶AST。
本发明提供一种治疗肝炎的药物,在于其中含用治疗有效量的马来酸氯苯那敏及药用载体或赋形剂。
马来酸氯苯那敏临床用于治疗肝炎,具有保肝降酶作用,主要作用在于降低转氨酶ALT(丙氨酸转氨酶)、AST(天门冬氨酸氨基转移酶)等。
可以与其他治疗肝炎的药物、保肝的药物及维生素类药物等配合制成新的剂型,方便应用。
治疗肝炎时,马来酸氯苯那敏可以单独给药,也可以作为组合药物中的一种组分给药,其剂型可以是口服剂、针剂等,给药方式可以是口服、或注射。
其治疗剂量需要根据患者的年龄、体能、疾病严重程度及给药途径来确定。
具体实施例方式以下的实施例是对本发明的进一步祥细说明并不意味着对本发明有任何限制。
对CCl4所致急性肝损伤小鼠,下表为实验结果。
扑尔敏对CCl4所致急性肝损伤小鼠血清转氨酶的影响试验数据表明扑尔敏用药组9mg/kg可明显降低ALT活力;扑尔敏用药组27mg/kg对AST有明显抑制作。
两者相比对ALT降低作用更强。
结论扑尔敏对肝损伤小鼠血清转氨酶ALT、AST升高有明显降低作用。
权利要求1.马来酸氯苯那敏的新用途,其特征在于用于治疗肝炎。
2.根据权利要求1所述的马来酸氯苯那敏的新用途,其特征在于用于降低丙氨酸转氨酶ALT、天门冬氨酸氨基转移酶AST。
(完整版)各制剂工艺流程图各制剂工艺流程图1 、片剂生产工艺流程图2、颗粒剂生产工艺流程图3、胶囊剂生产工艺流程图4、合剂生产工艺流程图2 、工艺流程说明2 . 1 、前处理工艺流程说明外购的药材经过挑、选、检、去杂质及非药用部位后,川选药机或不绣钢洗药池,将药材上的泥土、灰尘洗净,根据不同品种的要求湿润,以达到提取、榨油、细粉的标准。
用J 六提取的药材,采取切割的方法切片,后经多层带式}气燥机干燥,中药粉碎机粉碎,筛分得到合格粒度的药材,送到净药库。
用J 屯榨油的药材,经多层带式干燥机干燥后,直接送去榨汕。
榨油前,按配方要求混合,用中药粉碎机粗碎,经蒸汽湿润后进入螺旋榨油机榨油,榨出的油经过过滤,再送到综合伟lJ 剂车间。
用一于细粉的药材切片,经多层带式十燥机十燥后,送到双扇灭菌柜灭菌,再用高效粉碎机组和震荡筛粉碎,筛分合格后包装,转入综合制剂车间。
2 . 2 、热回流提取工艺流程说明来自净药库的药材,按配方配料,加入乙醇,用热回流抽提机组进行第·次醉提,过滤后剩余的药渣,加上辅料,再进行次水提,使有效成分尽量提出。
醇体液静置后过滤,除去杂质,减压浓缩,回收乙醉,并得到醇提浸膏。
水提液静置后过滤,除去杂质,减压浓缩,并得到水提浸膏。
将醇提浸膏与水提浸膏混合,采用可倾式反应锅浓缩,得到稠浸膏,用周转桶送到综合制剂车间。
2 .3 、片剂工艺流程说明原料和辅料经过粉碎过筛,达到要求细度后,按配方称取配料。
配制好的物料,根据需要混合制粒、干燥、整粒、总棍后,再压片、包衣、抛光,经检验合格,按规定包装,送入成品库房。
2 . 4 、合剂工艺流程说明原料和辅料按处方称量后,加入纯化水配制成药液,经力热煮沸、冷却、过滤后,再灌装和轧盖,经过蒸汽检漏、晾瓶、灯检、贴签,检验合格后,装箱送入成品库房。
2 . 5 、糖浆剂工艺流程说明将原料和辅料按处方称量后,加入纯化水配制成药液,经力热煮沸、冷却、过滤、调整浓度后,再灌装和轧盖,经过幻检、贴签,检验合格后,装箱送入成品库房。
标准管理规程1、产品概述2、批准文号及物料使用情况3、工艺流程图4、原药材的整理与炮制5、制剂操作过程及工艺条件6、原辅料规格(等级)质量标准和检查方法7、中间产品质量标准和检查8、成品质量标准和检查方法9、包装材料和包装的规格、质量标准10、说明书、产品文字说明和标示11、工艺卫生要求12、设备一览表及主要生产能力13、技术安全及劳动保护14、劳动组织、岗位定员、工时定额与生产周期15、技术经济指标16、原辅料消耗定额17、包装材料消耗定额18、动力消耗定额19、综合利用和环境保护1.产品概述:1.1 药品名称:通用名称:马来酸氯苯那敏片汉语拼音:Malaisuan Lübennamin Pian1.2 性状:本品为白色片。
1.3 药物组成:本品每片含主要成分马来酸氯苯那敏4mg。
辅料为糊精、淀粉、硬脂酸镁。
1.4作用类别:本品为抗过敏类非处方药药品。
1.5贮藏:避光、密闭保存。
1.5包装:药用PVC硬片和药品包装用PTP铝箔。
1.6有效期:暂定36个月生产处方:2产品名称:马来酸氯苯那敏片2.1产品成品代码:405产品中间品代码:马来酸氯苯那敏片颗粒305-1马来酸氯苯那敏片裸片305-2马来酸氯苯那敏片裸铝塑板305-32.2剂型:片剂2.3规格:4mg2.4批量:生产批量60万片/批、批准文号:国药准字H41023587。
标准演变:起始标准:中国药典1985年版二部。
现行标准:中国药典2010年版(二部)所用原料清单:原辅料的折算:原料马来酸氯苯那敏应折算。
折算方法:原料马来酸氯苯那敏实际用量=理论用量÷原料含量(%)原料马来酸氯苯那敏实际用量=理论用量÷(1-水分%)÷原料含量(%)标准管理规程3.工艺流程:3.1生产工艺流程图:标准管理规程生产操作要求:基本要求各工序应依据SOP08-001-00进行开工前准备与自检。
所需设备、容器、用具必须按清洁规程进行清洁,达到清洁的要求,并在48小时使用。
基本药物处方—马来酸氯苯那敏片(扑尔敏片)【制剂规格】每片4毫克【适应症】本品适用于皮肤过敏症:荨麻疹、湿疹、皮炎、药疹、皮肤瘙痒症、神经性皮炎、虫咬症、日光性皮炎。
也可用于过敏性鼻炎,药物及食物过敏。
【不良反应】主要不良反应为嗜睡、口渴、多尿、咽喉痛、困倦、虚弱感、心悸、皮肤瘀斑、出血倾向。
【用法用量】口服:成人每次1片,一日13次;儿童剂量请向医师或药师咨询。
【药物相互作用】1.本品不应与含抗组胺药(如马来酸氯苯那敏、苯海拉明等)的复方抗感冒药同服。
2.本品不应与含抗胆碱药(如颠茄制剂、阿托品等)的药品同服。
3.与解热镇痛药物配伍,可增强其镇痛和缓解感冒症状的作用。
4.与中枢镇静药、催眠药、安定药或乙醇并用,可增加对中枢神经的抑制作用。
5.本品可增强抗抑郁药的作用,不宜同用。
6.如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
【注意事项】1.老年患者应在医师指导下使用。
2.服药期间不得驾驶机、车、船、从事高空作业、机械作业及操作精密仪器。
3.儿童剂量请向医师或药师咨询。
4.新生儿、早产儿不宜使用。
5.孕妇及哺乳期妇女慎用。
6.膀胱颈梗阻、幽门十二指肠梗阻、甲状腺功能亢进、青光眼、消化性溃疡、高血压和前列腺肥大者慎用。
7.如服用过量或出现严重不良反应,应立即就医。
8.对本品过敏者禁用,过敏体质者慎用。
9.本品性状发生改变时禁止使用。
10.请将本品放在儿童不能接触的地方。
11.儿童必须在成人监护下使用。
12.如正在使用其他药品,使用本品前请咨询医师或药师。