乙醇_醇类-苯酚,酚类
- 格式:doc
- 大小:432.00 KB
- 文档页数:10

《海水养殖动物病害学》第五章教学基本内容与要求“常用药物及其作用机理简介”第五章常用药物及其作用机理简介1.本章教学时间:3学时2.本章教学目的与要求:了解常见水产药物的作用机理,掌握水产病害防治中常用药物的种类、使用方法以及水产养殖中选择合适水产药物的基本原则,学会在确定病因后采取使用合适的病害防治药物。
3.本章教学重点:水产病害防治中常用药物的种类和使用方法、水产无公害养殖的药物使用原则与要求、水产养殖常用的给药方法。
4.本章教学难点:不同水产病害防治药物的使用范围极其作用机理,不同给药方法的优点与缺点。
5.本章教学方法:教师讲授,通过图表比较分析不同药物的特点及其使用范围,通过讨论加深学生对水产无公害养殖的认识。
6.本章教学手段:多媒体教学。
ar7.本章课程引入方法:海水养殖动物发生了疾病该怎么办?(用药物进行治疗);在病害防治中是否存在万能药物?8.本章参考文献(1)Ashida M. Purification and characterization of prophenoloxi-dase from hemolymph of the silk worn Bombyx Mori. Archs Biochem Biophys, 1971,144:749 ~ 762.(2)姜卫国,谢玉坎,司徒竞. 合浦珠母贝的多毛虫寄生病继发性脓疡(俗称“黑心肝病”)的研究:II. 饱和盐水的杀虫防治. 见:中国科学院南海海洋研究所编,珍珠贝论文集. 北京:科学出版社,1984,69-74(3)王雷、李光友、毛远兴. 口服免疫型药物对养殖中国对虾病害防治作用的研究. 海洋与湖沼, 1994, (5):486~492(4)夏冬. 特种水产养殖常用消毒剂。
科学养鱼,2001(11):3~4。
(5)周永灿,等.几种常见水体消毒剂的消毒效果. 王清印主编:海水健康养殖的理论与实践,海洋出版社,2003, p442-226.(6)谢玉坎,林碧萍,许志坚。

一、名词解释。
(1)疾病:疾病是机体在一定的条件下,受病因损害作用后,因自稳调节紊乱而发生的异常生命活动过程。
(2)拮抗作用当两种或两种以上药物共同使用时,其作用因相互抵消或减弱,称拮抗作用。
:(3)组织损伤:是组织的物质代谢障碍所致的形态结构、功能和代谢三方面的变化。
(4)贫血:贫血是指机体外周血红细胞容量臧少,低于正常范围下限的一种常见的临床症状。
(5)最小有效量:指药物作用于机体,使机体出现有效作用或出现药理效应的剂量,(6)半数致死量:表示在规定时间内,通过指定感染途径,使一定体重或年龄的某种动物半数死亡所需最小细菌数或毒素量。
(7)保虫寄主:某些蠕虫成虫或原虫某一发育阶段既可寄生于人体,也可寄生于某些脊椎动物,在一定条件下可传播给人。
(8)再生:机体内死亡的细胞和组织可由邻近健康的细胞分裂新生而修复,这种细胞的分裂新生称为再生。
(9)原发性感染:指病原体直接浸入健康鱼体而引起的鱼病。
(10)萎缩:发育成熟的器官、组织或细胞发生体积缩小的过程。
(11)再感染:同一传染病在完全痊愈后,经过长短不等的间隙再度感染(12)最大耐受量:指药物在除急性毒性动物实验外的实验中不引起实验动物死亡的最大剂量或浓度。
(13)病原菌:是指能入侵宿主引起感染的微生物。
(14)专性寄生:寄生物一旦离开宿主生物就不能继续生存的现象。
(15)渔药:用以预防、控制和治疗水产动植物的病虫害,促进养殖品种健康生长,增强机体抗病能力,改善养殖水体质量,以及提高增养殖渔业产量所使用的物质。
”(16)积水:积水是指体液在体腔内积聚的现象。
(17)代偿:在致病因素的作用下,体内出现代谢、功能障碍或组织结构破坏时,机体通过相应器官的代谢改变、功能加强或形态结构变化来补偿的过程。
(18)炎症:机体遭受有害刺激(如微生物、寄生虫、理化因子等)后所产生的防卫性反应,其作用为清除入侵体内的有害刺激物。
二、填空题1、引起病理性萎缩常见的原因有:营养不良萎缩、压迫性萎缩、缺血性萎缩、神经性萎缩和废用性萎缩等。

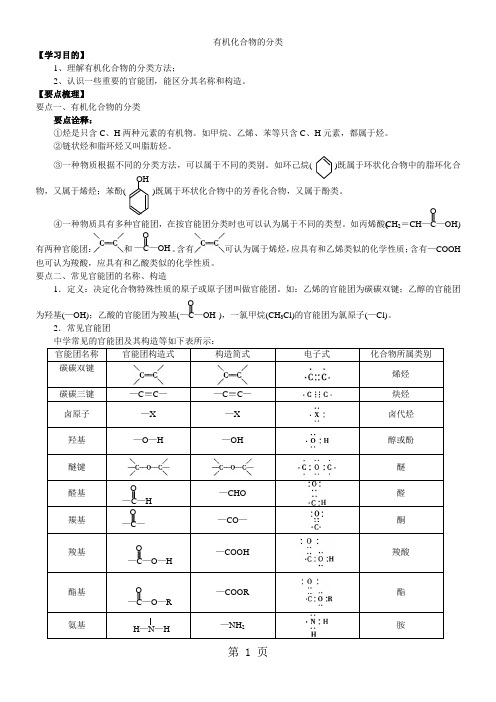
有机化合物的分类【学习目的】1、理解有机化合物的分类方法;2、认识一些重要的官能团,能区分其名称和构造。
【要点梳理】要点一、有机化合物的分类要点诠释:①烃是只含C 、H 两种元素的有机物。
如甲烷、乙烯、苯等只含C 、H 元素,都属于烃。
②链状烃和脂环烃又叫脂肪烃。
③一种物质根据不同的分类方法,可以属于不同的类别。
如环己烷 )既属于环状化合物中的脂环化合物,又属于烯烃;苯酚 )既属于环状化合物中的芳香化合物,又属于酚类。
④一种物质具有多种官能团,在按官能团分类时也可以认为属于不同的类型。
如丙烯酸( )有两种官能团:和 。
含有可认为属于烯烃,应具有和乙烯类似的化学性质;含有—COOH 也可认为羧酸,应具有和乙酸类似的化学性质。
要点二、常见官能团的名称、构造1.定义:决定化合物特殊性质的原子或原子团叫做官能团。
如:乙烯的官能团为碳碳双键;乙醇的官能团 为羟基(—OH);乙酸的官能团为羧基( ),一氯甲烷(CH 3Cl)的官能团为氯原子(—Cl)。
2.常见官能团中学常见的官能团及其构造等如下表所示:官能团名称 官能团构造式构造简式电子式化合物所属类别碳碳双键烯烃 碳碳三键 —C ≡C — —C ≡C —炔烃 卤原子 —X —X 卤代烃 羟基 —O —H—OH醇或酚 醚键醚 醛基 —CHO醛羰基—CO —酮羧基 —COOH羧酸酯基—COOR酯氨基—NH 2胺OHCH 2=CH —C —OHO—C —OH O —C —OH O—C —H O —C — O—C —O —HO—C —O —R OH —N —H要点诠释:①官能团是中性基团,不带电荷。
②官能团决定有机物的主要化学性质,但一样的官能团连接的方式和位置不同,化学性质也有所不同。
③分子中含有两种或两种以上的官能团时,该分子可能具有多方面的性质,假设多种官能团之间互相影响,又可能表现出特殊性质,如羟基与链烃相连时形成的是醇,而直接与苯环相连时形成的是酚。

高中有机化学知识点总结7篇篇1一、引言有机化学是高中化学的重要组成部分,主要研究含碳化合物的结构与性质。
本文旨在对高中有机化学的核心知识点进行全面梳理和总结,包括有机化合物的结构特征、性质变化规律、反应类型和常见物质的应用等方面,以帮助学生们更好地理解和掌握有机化学。
二、有机化合物的结构与性质1. 有机物的定义与分类有机化合物是指含有碳元素的化合物,通常包括烃类、烃的衍生物等。
根据其结构特点,有机化合物可分为脂肪烃、芳香烃、醇、酮、羧酸等。
2. 有机分子的结构特征有机分子中的碳原子通常采用sp³杂化,形成四个共价键。
碳原子间可以形成碳链或碳环,构成有机物的骨架。
此外,有机物中的官能团,如羟基(-OH)、羧基(-COOH)等,对化合物的性质起到决定性作用。
3. 同分异构现象有机化合物具有同分异构现象,即化学式相同但结构不同的化合物。
常见的同分异构体包括结构异构、立体异构等。
三、有机反应类型1. 取代反应取代反应是指有机化合物中的某个原子或原子团被其他原子或原子团替代的反应。
如卤代烃的制备、醇的酯化等。
2. 加成反应加成反应是指不饱和键的化合物通过打开双键或三键,与其他试剂结合生成新化合物的反应。
如烯烃与卤素、水的加成反应等。
3. 消去反应消去反应是加成反应的逆反应,通过消除分子中的共价键生成不饱和键。
如醇的脱水反应等。
四、常见有机物的性质与应用1. 烃类烃类是组成最简单的有机物,根据其碳原子间的连接方式可分为脂肪烃和芳香烃。
脂肪烃具有碳链结构,易于发生化学反应;芳香烃则具有特殊的芳香性,广泛应用于香料、塑料等领域。
2. 醇类醇类化合物在自然界中广泛存在,是重要的有机溶剂和反应中间体。
其在医药、化工等领域有广泛应用。
3. 酮类与羧酸类酮类是具有酮羰基的化合物,具有良好的脂溶性,常用作溶剂和合成中间产物;羧酸类化合物则广泛应用于医药、农药、塑料等领域。
五、实验技术与方法有机化学实验中,常用的技术与方法包括有机物的分离与提纯、官能团的鉴定、有机合成实验等。
常见毒物急性中毒临床表现毒物种类繁多,急性中毒来势凶猛,进展迅速,表现复杂,首先应熟悉具有诊断意义的临床表现,抓住其临床特征,并以此作为建立诊断的关键线索。
物理检查可以在询问病史前或同时碱性。
毒物中毒常有其特殊的临床表现,在紧急情况下,根据中毒患者的临床表现和简单中毒病史,即可做出初步判断,迅速采取相应的救治措施,现将急性中毒的临床表现特点,产生这些临床表现的常见毒物叙述如下。
1. 呼气、呕吐物及体表气味蒜臭味:多数有机磷农药,有机磷、砷、铊及其化合物;酒味:酒精(乙醇)、甲醇、异丙醇及其他醇类化合物;酚类:石炭酸(苯酚),来苏尔(甲酚皂溶液);醚味:乙醚及其醚类;刺鼻甜味(酮味):丙酮,氯仿;苦杏仁味:氰化物及含氰苷果核仁(如苦杏仁);梨味:水合氯醛;鞋油味:硝基苯;冬青油味:水杨酸甲酯;水果香味:硝酸异戊酯,硝酸乙酯;尿(氨)味:氨,硝酸铵;其他特殊气味:汽油,煤油,松节油,苯,甲苯,二甲苯等。
2.皮肤黏膜2.1 颜色:紫绀:亚硝酸盐、腌渍不好的青菜(含亚硝酸盐)、苯的氨基和硝基化合物(如苯胺、硝基苯类)、磺胺、伯氨喹啉、非那西丁、铝酸盐、硼酸(有时)、各种抑制呼吸及引起肺水肿的毒物;潮红:抗胆碱药(如阿托品、洋金花等)、抗组胺药、乙醇;樱桃红:一氧化碳、氰化物;黄色:阿的平、中毒性肝损害所致黄疸(磷、四氯化碳、对乙酰氨基酚、蛇毒、毒磨)、溶血所致黄疸(苯胺、蚕豆黄、硝基苯、磺胺、蛇毒)、药物性肝内胆汁淤积(氯丙嗪、甲级睾丸素、喹诺酮类)2.2 湿度:多汗:胆碱酯酶抑制剂(有机磷毒物、毒扁豆碱、新斯的明等)、拟胆碱药(如毛果芸香碱)、毒蕈;无汗:抗胆碱药(如阿托品、洋金花等)、抗组胺药、三环类抗抑郁药。
2.3 皮炎表现:接触性皮炎:多种工业毒物、染料、油漆、塑料、有机汞、苯酚、斑蝥、巴豆、有机磷农药;光敏性皮炎:沥青、灰菜、荞麦叶和花。
2.4 脱发:铊、砷、维生素A、硫氰化物。
3. 体温体温升高:锌、铜、镉、镍、锑、钴等金属;聚氟四乙烯引起的聚合物烟尘热;五氟酚钠、麻黄碱、苯丙胺、三环类抗抑郁药、抗组胺药、二硝基苯酚类、体温降低:吩噻嗪类、麻醉镇痛药、镇静催眠药、醇类(重度中毒)等。
乙醇醇类
一、乙醇的结构
(1)乙醇是极性分子,易溶于极性溶剂,与水以任意比例混溶.
(2)离子化合物,大部分有机物都能溶于乙醇,乙醇是常见的有机溶剂.
(3)极性键①②③④在一定条件下都易断裂,碳碳键只有在燃烧或爆炸时才断裂.
(4)羟基与氢氧根的区别
①电子式不同
②电性不同
—OH呈电中性,OH-呈负电性.
③存在方式不同
OH —OH不能独立存在,只能与别的“基”结合在一起,OH-能够独立存在,如溶液中的-和晶体中的OH-.
④稳定性不同
—OH不稳定,能与Na等发生反应,相比而言,OH-较稳定,即使与Fe3+等发生反应,也是整体参与的,OH-并未遭破坏.
二、乙醇的化学性质
1.乙醇的取代反应
(1)乙醇与活泼金属的反应
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
①本反应是取代反应,也是置换反应.
②其他活泼金属也能与CH3CH2OH反应,如
2CH3CH2OH+Mg→Mg(CH3CH2O)2+H2↑
③Na与乙醇的反应比与水的反应缓和的多:
2HO—H+2Na2NaOH+H2↑
说明乙醇中羟基上的H原子不如水分子中羟基上的H原子活泼
④CH3CH2ONa(aq)水解显碱性.
CH3CH2ONa+H—OH CH3CH2OH+NaOH
(2)乙醇与HBr的反应
CH3—CH2—OH+HBr CH3CH2Br+H2O
①该反应与卤代烃的水解反应方向相反:
但反应条件不同,不是可逆反应.
②反应中浓H2SO4是催化剂和脱水剂.
③反应物HBr是由浓H2SO4和NaBr提供的:
2NaBr+H2SO4Na2SO4+2HBr
④反应过程中,同时发生系列副反应,如:
2Br-+H2SO4(浓)Br2+SO2↑+2H2O+SO 24
(3)分子间脱水
①该反应是实验室制乙烯过程中的主要副反应.实验室制乙烯要求“迅速升温170℃”就是为减少该反应的发生.
②该反应属取代反应,而不是消去反应,因为脱水在分子间而非分子内进行.
③浓H2SO4是催化剂和脱水剂,是参加反应的催化剂.
乙醚生成时,H2SO4又被释出.
(4)硝化反应
(5)磺化反应
2.乙醇的氧化反应 (1)燃烧氧化
C 2H 6O +3O 2−−→−点燃
2CO 2+3H 2O ①CH 3CH 2OH 燃烧,火焰淡蓝色 ②烃的含氧衍生物燃烧通式为:
C x H y O z +(x +4y
-2z
)O 2−−→−点燃
x CO 2+2y
H 2O
(2)催化氧化
①乙醇去氢被氧化
②催化过程为:
CH 3CHO 生成时,Cu 又被释出,Cu 也是参加反应的催化剂.
三、脱水反应和消去反应的关系
脱水反应有两种,一是分子内脱水,如:
这类脱水反应是消去反应,但不属于取代反应.二是分子间脱水,如:
这类脱水反应不是消去反应,而是取代反应.
消去反应有多种,有的消去小分子H2O分子,这样的反应又叫脱水反应,如①反应;有的消去其他小分子HX等,如:
这样的反应不叫脱水反应.
总的说来,消去、脱水、取代三反应间有如图6-4所示关系:
四、乙醇的结构和化学性质的关系
物质的性质是由物质的结构决定的,乙醇的结构决定了乙醇的性质,特别是化学性质.根据分子中极性键易断裂的原理,把握了乙醇的结构,也就掌握了乙醇的性质.
五、醇的概念
醇是分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物.这一概念,可从以下几个层面理解:
(1)醇分子中含有羟基,且羟基个数不限,但不存在1个C原子上连有2个羟基的醇,因为这样的醇不稳定:
(2)羟基连接在链烃基上的是醇,如CH3OH、等,但不存在羟基连在烯键(或炔键)C原子上的醇,因为这样的醇也不稳定.
(3)羟基连在苯环上的不是醇,如,羟基连在苯环的侧链上的是醇,如
(4)此外还有定义中不包括的一点,羟基连在环烷基(或环烯基)的C原子上的也是醇,如等.
六、常见醇的种类和组成
说明:所有烃的含氧衍生物都可用通式3表示.
七、醇的溶解性
醇分子中因为含有羟基而有极性,分子越大,羟基越少,极性越弱,在水中越难溶解;分子越小,羟基越多,极性越强,在水中越易溶解.所以:
(1)C1~C3的饱和一元醇与水以任意比混溶;C4~C11的饱和一元醇部分溶于水;C12以上的饱和一元醇不溶于水.
(2)乙二醇、丙三醇与水以任意比混溶.
(3)易溶于水.
八、甲醇、乙二醇和丙三醇
九、醇的化学通性
醇类的化学性质与乙醇相似:能发生氧化反应和取代反应.如丙三醇的硝化反应为:
硝化甘油是一种烈性炸药.
十、醇的氧化规律
醇分子能否氧化,取决于醇的结构.如果醇分子中含有—CH2OH基团,则该醇可被氧化成醛:
十一、有关生成醇的反应
已经学过的生成醇的反应,有以下三种:
此外,还有乙醛还原法、乙酸乙酯水解法、葡萄糖发酵法等都可生成乙醇,这些知识,将逐渐学到.
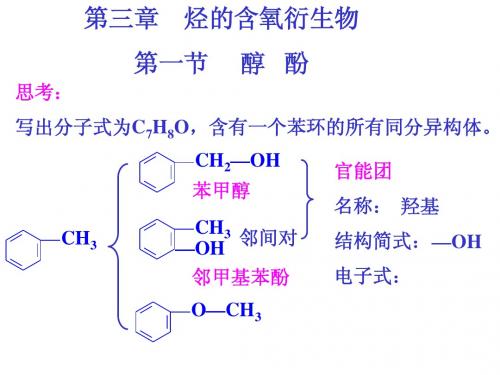
苯酚
一、乙苯酚分子结构与物理性质:注意强调羟基与苯环直接相连
物理性质:无色晶体(因被部分氧化而呈粉红色)、有特殊气味、
常温下在水中溶解度小,高于650C时与水混溶。
但易溶于有机溶剂。
苯酚的官能团是羟基—OH,且与苯环直接相连,二者相互影响,因此苯酚的性质比乙醇活泼。
二、化学性质:苯酚的官能团是羟基—OH,与苯环直接相连
1·弱酸性——比H
2
CO
3
弱,不能使指示剂变色,又名石炭酸。
C6H5OH C6H5O—+H+
C6H5OH +NaOH →C6H5ONa +H2O
C6H5ONa+CO2+H2O →C6H5OH+NaHCO3(强调不能生成Na2CO3)
2
·
取代反应—常于苯酚的定性检验和定量测定
※3
·显色反应——苯酚溶液遇FeCl
3
显紫色
三、苯酚的用途:
1·苯酚苯环对羟基的影响:—OH更活泼,与活泼金属、碱等反应
的性质羟基对苯环的影响:苯环易与溴发生取代反应
2·苯酚的鉴别方法。
一、苯酚分子结构与物理性质:注意强调羟基与苯环直接相连
物理性质:无色晶体(因被部分氧化而呈粉红色)、有特殊气味、
常温下在水中溶解度小,高于650C时与水混溶。
但易溶于有机溶剂。
二、化学性质:苯酚的官能团是羟基—OH,与苯环直接相连
1·弱酸性——比H2CO3弱
2·取代反应
3·显色反应——苯酚溶液遇FeCl3显紫色
四.苯环上的取代定位规则
大量实验事实表明,当一些基团处于苯环上时,苯环的亲电取代反应会变得容易进行,同时使再进入的基团将连接在它的邻位或对位。
例如,当苯环上已存在一个甲基时(即甲苯),它的卤化、硝化和磺化等反应,反应温度均远低于苯,且新基团的导入均进入苯环上甲基的邻或对位:
甲基的这种作用称为定位效应。
在这里甲基是一个邻、对位指向基,具有活化苯环的作用,称为活化基。
类似的活化基团还有许多,它们也被称为第一类取代基,并按活化能力由大到小的顺序排列如下:
-NH 2,-NHR ,-NR 2,-OH>-NHCOR ,-OR ,>-R ,-Ph>-X
处于这一顺序最末的卤素是个特例。
它一方面是邻、对位指向基,另一方面又是使苯环致钝的基团,这是由于卤素的电负性远大于碳,因此其吸电子效应已超过了本身的供电子能力,这就使环上的电子云密度比卤素进入前有所降低,因而使亲电试剂的进攻显得不力。
此称为钝化作用。
还有许多比卤素致钝力更强,而且使再进基团进入间位的取代基,它们被称为间位指示基或第二类取代基,按其致钝能力由大到小的顺序排列如下:
-NR 3+
,-NO 2,-CF 3,-CCl 3>-CN ,-SO 3H ,-CH =O ,-COR ,-COOH ,-COOR 常见的取代基的定位作用见表
事先作全面考虑。
如:欲合成下列化合物时,显然b-路线是合理的。
如果以苯为原料,欲合成对-硝基苯甲酸(此物质在后面章节将学到)时,则应该先对苯进行甲基化后再进行硝化,最后将甲基氧化:。