201X乙醇(公开课)
- 格式:ppt
- 大小:380.50 KB
- 文档页数:16




乙醇公开课课件一、教学内容本节课的教学内容选自人教版《科学》教材第五单元“物质的性质与变化”中的第一课时“乙醇”。
本节课的主要内容包括:乙醇的物理性质、化学性质以及乙醇的制备方法和应用。
1. 乙醇的物理性质:乙醇是一种透明、无色、具有刺激性气味的液体,沸点为78.3℃,密度为0.789g/cm³。
2. 乙醇的化学性质:乙醇具有羟基,能与水分子形成氢键,易溶于水;乙醇具有还原性,能被氧化成乙醛,进一步氧化成乙酸;乙醇能与酸、碱、盐发生酯化反应。
3. 乙醇的制备方法:实验室中常用乙烯与水在硫酸催化下反应乙醇;工业上常用粮食发酵法制备乙醇。
4. 乙醇的应用:乙醇是一种重要的化工原料,广泛应用于塑料、橡胶、纤维、制药、化妆品等行业;乙醇还可以作为燃料,具有较高的燃烧热值和较低的环境污染。
二、教学目标1. 了解乙醇的物理性质、化学性质及其制备方法和应用。
2. 掌握乙醇与水、酸、碱、盐的反应原理。
3. 培养学生的实验操作能力,提高学生的科学素养。
三、教学难点与重点1. 教学难点:乙醇的化学性质及酯化反应的原理。
2. 教学重点:乙醇的制备方法及其应用。
四、教具与学具准备1. 教具:多媒体课件、黑板、粉笔、试管、酒精灯、烧杯、滴定管等。
2. 学具:教材、实验报告册、实验试剂、实验仪器等。
五、教学过程1. 实践情景引入:以日常生活中常见的酒精为切入点,引导学生思考酒精的化学性质及其在生活中的应用。
2. 知识讲解:介绍乙醇的物理性质、化学性质、制备方法和应用。
3. 例题讲解:分析乙醇与水、酸、碱、盐的反应原理,并通过实验演示酯化反应过程。
4. 随堂练习:学生分组讨论,回答乙醇的制备方法及其应用。
5. 实验操作:学生分组进行实验,观察乙醇的燃烧现象,测定乙醇的沸点。
六、板书设计1. 乙醇的物理性质:颜色、气味、沸点、密度。
2. 乙醇的化学性质:羟基、水溶性、还原性、酯化反应。
3. 乙醇的制备方法:乙烯水合、粮食发酵。

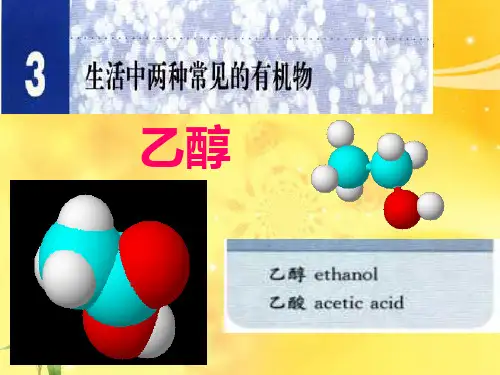

乙醇课件(公开课)教案内容一、教学内容本节课的教材内容选自人教版科学六年级下册第五单元第三节“生活中的化学——乙醇”。
本节课主要介绍乙醇的性质、制法和用途,通过实验和探究活动,使学生了解乙醇的化学性质,掌握乙醇的制法,以及了解乙醇在日常生活中的应用。
二、教学目标1. 了解乙醇的化学性质、制法和用途。
2. 能够通过实验和探究活动,观察和分析乙醇的性质变化。
3. 培养学生的实验操作能力和观察能力,提高学生的科学思维能力。
三、教学难点与重点1. 教学难点:乙醇的化学性质和制法。
2. 教学重点:乙醇的用途和在日常生活中的应用。
四、教具与学具准备1. 教具:多媒体课件、实验器材(试管、酒精灯、镊子、滴管等)。
2. 学具:笔记本、实验记录表。
五、教学过程1. 引入:通过多媒体课件展示乙醇的图片,引导学生思考乙醇在日常生活中的应用。
2. 探究乙醇的性质:学生分组进行实验,观察乙醇的燃烧性质,记录实验结果。
3. 讲解乙醇的制法:教师通过多媒体课件讲解乙醇的制法,引导学生理解乙醇的制备过程。
4. 探究乙醇的用途:学生分组进行实验,观察乙醇在不同条件下的性质变化,记录实验结果。
6. 课堂练习:教师出题,学生回答,巩固所学内容。
六、板书设计1. 乙醇的性质可燃性溶解性2. 乙醇的制法发酵法化学合成法3. 乙醇的用途燃料溶剂医疗用途七、作业设计乙醇为什么可以燃烧?乙醇的溶解性如何?乙醇在日常生活中的应用有哪些?2. 答案:乙醇可以燃烧,因为它具有可燃性。
乙醇的溶解性较好,可以溶解许多有机物。
乙醇在日常生活中的应用包括燃料、溶剂和医疗用途等。
八、课后反思及拓展延伸1. 课后反思:本节课通过实验和探究活动,学生对乙醇的性质、制法和用途有了更深入的了解。
在教学过程中,要注意引导学生观察和分析实验现象,培养学生的实验操作能力和观察能力。
2. 拓展延伸:引导学生进一步研究乙醇在其他领域的应用,如乙醇汽油、乙醇燃料电池等,激发学生的学习兴趣和创新思维。

第三节生活中两种常见的有机物第一课时一一乙醇一、 教学目标 1. 知识与技能:(1) 了解乙醇的物理性质和在生产生活中的应用; (2) 了解烃的衍生物与官能团的概念(3) 掌握乙醇的分子结构和化学性质一一与钠的反应、氧化反应。
2. 过程与方法:通过揭示问题,讨论释疑,动手实验,学习对比,推断等科学探究方法。
3. 情感态度价值观:(1) 让学生体会科学探究的艰辛与乐趣,认识化学与人类生活的密切联系,激 发学生学习化学的积极性。
(2) 学会由事物的表象分析事物的本质、变化,进一步培养综合运用知识、解 决问题的能力;通过人人动手实验,规范操作,全面培养、提高实验能力、观察 能力和对实验现象的分析能力。
(3) 通过新旧知识的联系,培养知识迁移、扩展的能力,进一步激发学习的兴 趣和求知欲望;通过实验,培养求实、严谨的优良品质。
二、 重点难点重点:乙醇的结构和化学性质。
难点:乙醇的化学性质。
三、 教学方法引导学生去思考、发现隐藏的问题,具体分析,达到一种师生和谐、共同学习的 良好气氛。
采用边讲边实验探究,充分发挥实验的作用,提高学生主动解决问题 的兴趣 四、 教学手段学生探究实验,多媒体教学等多方面结合。
五、 教学过程 【引入新课】上一节课我们已经学过了乙烯的化学性质,乙烯的氧化反应和加成反应的原理以 及在日常生活中的应用。
今天我们再来认识一下生活中常见的一种有机物。
老师肯定在同学们当中有不少人或多或少都去过医院几次,那么你们一走进医院第一 次会闻到什么味儿呢?那么我们就来跟乙醇认识一下。
【板书】第三节生活中两种常见的有机物一一乙醇【设问】大家知道我们常见的食醋和酒的有效成分是什么吗? 【学生回答】乙醇(酒精)。
【讲述】酒精在我们的日常生活中有着非常重要的作用 【展示】无水乙醇。
请学生观察乙醇的颜色、状态, P73, 了解一下乙醇都有那些物理性质。
【板书】【PPT 展示】一、乙醇的物理性质 乙醇是一种无色有特殊香味、易挥发的液体;沸点 解多种有机物和无机物,能与水任意比例互溶。


鲁科版高中化学必修第二册《乙醇》优质课公开课课件、教案乙醇教学设计{教学目标}1、记住乙醇的主要物理性质。
2、明确乙醇的分子结构。
3、学会乙醇的化学性质。
4、了解乙醇的应用。
{教学重点}乙醇的组成,乙醇的氧化反应.{教学难点}使学生建立乙醇的立体结构模型,并能从结构角度初步认识乙醇的氧化这个重要反应.{教学过程}一. 导入新课(多媒体)清明时节雨纷纷,路上行人欲断魂。
借问酒家何处有, 牧童遥指杏花村。
二. 推进新课〔师〕中国的酒文化源远流长,古往今来传颂看许多与酒有关的诗歌和故事.那么你知道酒的主要成分是什么?它具有怎样的结构和性质?〔资料〕乙醇的用途。
学习某一物质的物理性质时,要观察其颜色,状态,闻其气味,测其熔沸点,溶解性,密度,硬度.〈展示〉用一试管盛少量的乙醇让学生观察其状态,并闻其气味.(多媒体)1.乙醇的物理性质.颜色:无色透明气味:特殊香味状态:液体挥发性:易挥发密度:比水小溶解性:跟水以任意比互溶能够溶解多种无机物和有机物2、乙醇的分子结构问题:乙醇分子式为C2H6O ,结构可能有两种,到底是哪种呢?两者互为同分异构体,究竞哪一个是乙醇的分子结构式?要由实验确定。
[学生实验]将两块金属钠分别投入盛有冷水和乙醇的小烧杯中,观察钠与水、与乙醇反应的现象有何异、同?哪一个更剧烈?填写下表:钠与水钠与乙醇钠是否浮在液面上浮在水面先沉后浮有无气泡发放出气泡放出气泡能否使酚酞试液变红变红变红反应方程式2Na+2H2O=2 NaOH +H2↑?现象的本质原因:钠浮在水面上,而沉于乙醇中。
水的密度>钠的密度>乙醇的密度产生的气体燃烧产物使干燥的小烧杯变朦胧,不使澄清石灰水变浑浊。
生成的气体是氢气定量实验:实验测定,4.6克(0.1mol )无水酒精可与足量金属钠反应,收集到标况下1.12升(0.05mol)氢气:n C2H6O∶n H2=2∶1由此证明乙醇的结构式应为__A_____而B则为甲醚的分子结构, 甲醚不能与钠反应2、乙醇的分子结构结构简式:CH3CH2OH或C2H5OH乙醇分子中含的-OH基团,称为羟基.由于羟基的存在使乙醇的性质不同于乙烷。
乙醇教学设计一、教材分析“乙醇”是《新课标》中必修课程本节教材从化学史实和生活实例引入乙醇,学生容易就此根据经验总结出乙醇的物理性质。
然后再通过分析分子结构引入取代基和烃的衍生物概念,指出衍生物的分子中含有官能团,与母体化合物烃的结构不同,因此性质也有所区别,深化学生对“结构决定性质”这一化学基本观念的理解。
教材编入乙醇与钠反应的实验,并分析乙醇与乙烷具有不同化学性质的原因,由此引入官能团的概念。
这样既介绍了代表性物质的化学性质,又让学生认识到官能团对有机物化学性质的决定作用。
教材中乙醇的氧化反应重点在于催化氧化,其中包含了生物体内酶催化的氧化反应,以及乙醇与高锤酸钾等氧化剂的反应,由此打通了从乙烯到乙醇、乙醛、乙酸的物质转化链。
教材在本节和本章最后编入相关习题和“整理与提升”,帮助学生分析这一转化过程中的官能团和物质类别变化,深化其对有机物性质与转化关系的认识。
二、学情分析学生在初中的学习中已了解了乙醇的用途,乙醇是学生比较熟悉的生活用品。
教材在第二节介绍了乙烯,反应产物中涉及卤代烃,学生已经初步接触了含有官能团的有机物,此外,通过对烷烃、乙烯性质的学习,学生初步认识到有机物的性质是由其特殊结构决定的,而性质又决定了其用途,这与无机物的学习有一定的相似性。
在能力方面,学生已具备一定的实验探究能力和分析归纳能力,微观思维能力还有所欠缺,因此需要引导学生从微观角度解释实验现象,深化结构决定性质的学科思想。
三、素养目标【教学目标】1.知道乙醇的组成、结构、官能团、物理性质及用途。
2.了解烃的衍生物的概念及官能团与性质的关系,认识羟基与其性质的关系,会运用乙醇的结构分析其化学性质。
3.根据乙醇的性质和反应规律,认识醇类物质的性质和反应规律,实现有机物的转化。
【评价目标】1.微观探析:从官能团的角度认识乙醇的组成、结构、性质和变化,形成“结构决定性质”的观念。
2.科学探究:设计实验探究乙醇的结构与性质。