第2讲 分离过程热力学
- 格式:ppt
- 大小:805.00 KB
- 文档页数:48

《热力学第二定律》讲义一、热力学第二定律的引入在我们生活的这个世界中,热现象无处不在。
从烧开水时的水汽蒸腾,到冬天取暖时的热量传递,热的变化和流动贯穿于我们的日常生活。
而热力学第二定律,则是用来描述热现象中能量转换和传递的重要规律。
想象一下,一个热的物体和一个冷的物体相互接触,热量会自发地从热的物体流向冷的物体,直到它们的温度相等。
但是,你有没有想过,为什么热量不会自发地从冷的物体流向热的物体呢?这就是热力学第二定律所要探讨的核心问题之一。
二、热力学第二定律的表述热力学第二定律有多种表述方式,其中最常见的有克劳修斯表述和开尔文表述。
克劳修斯表述:热量不能自发地从低温物体传递到高温物体而不引起其他变化。
开尔文表述:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
为了更好地理解这两种表述,我们来举几个例子。
假如在一个封闭的房间里,有一台没有外接电源的冰箱。
如果热量能够自发地从冰箱内部的低温区传递到外部的高温环境,那么冰箱内部就会越来越冷,而房间却不会因为接收了这些热量而有任何其他变化。
但在现实中,这是不可能发生的。
再比如,有一个热机,它从高温热源吸收了一定的热量,并将其中一部分转化为有用功。
如果能够从单一热源吸收热量并完全转化为有用功,而不向低温热源排放任何热量,那么这样的热机就是“永动机”,但根据热力学第二定律,这种情况是不可能实现的。
三、热力学第二定律的实质热力学第二定律的实质是揭示了自然界中一切与热现象有关的实际过程都是不可逆的。
什么是不可逆过程呢?比如说,一滴墨水滴入一杯清水中,墨水会逐渐扩散,最终使整杯水都变得有颜色。
但是,我们不可能让这杯已经混合均匀的水自动地恢复到墨水和清水分离的状态。
再比如,一块光滑的冰块在常温下会逐渐融化成水,而这些水不会自动地再重新凝结成原来形状规则的冰块。
这些过程一旦发生,就无法自发地逆向进行,这就是不可逆过程。
而热力学第二定律正是说明了这类不可逆过程的方向性。




【1】1、生物分离(bioseparation)的定义:生物加工过程(bioprocess)中目标产物的分离纯化过程包括目标产物的提取、浓缩、纯化及成品化等过程。
2、生物分离的机理物质分离的本质是识别混合物中不同溶质间物理、化学和生物性质的差别,利用能识别这些差别的分离介质和扩大这些差别的分离设备实行溶质间的分离或目标组分的纯化。
性质不同的溶质在分离操作中具有不同的传质速率和(或)平衡状态,从而实行分离。
3、从操作的角度可以将分离技术分为两类(填空)平衡分离法和差速分离法4、离心分离法的两种形式:差速离心分级,区带离心(密度梯度离心)5、介绍各种细胞壁的结构动物细胞:没有细胞壁植物细胞:细胞壁主要为纤维素和果胶质构成革兰氏阳性菌:细胞壁外面主要有肽聚糖革兰氏阴性菌:肽聚糖的外侧还有脂蛋白、脂多糖酵母菌等:葡聚糖、甘露聚糖和蛋白质构成。
6、工业上常用离心机有管式和碟片式两大类,实验室常用的是离心管式离心机7、超声波破碎(是验室最常用的细胞破碎方法)【2】1、沉淀(precipitation)是利用某种沉淀剂或改变环境条件,使所需提取的物质或杂质在溶液中溶解度降低而形成无定形固体沉淀的过程,具有浓缩和分离双重作用。
(构成成分复杂)2、沉淀法可以分为(1)盐析法;(2)等电点沉淀法;(3)有机溶剂沉淀法;(4)成盐沉淀法(5)高分子聚合物沉淀(6)表面活性剂沉淀3、蛋白质溶液的稳定因素①溶质点在1-100 nm 范围这样的在热力学上是稳定的与溶剂分子碰撞势能不等于零,在介质中作布朗运动。
②带同种电荷不易聚集③分散的溶质可与溶剂形成溶剂化层,有了溶剂化层相互不易靠拢。
4、盐溶与盐析及它们的原理定义:(1)向蛋白质水溶液中逐渐加入电解质时,开始阶段蛋白质的活度系数降低,并且蛋白质吸附盐离子后,带电表层使蛋白质分子间相互排斥,而蛋白质与水分子间的作用加强因而蛋白质的溶解度增大这种现象称为盐溶(salting-in)(2)随着盐离子浓度的增大,蛋白质表面的双电层厚度降低,静电排斥作用减弱,同时,由于盐离子的水化作用使蛋白质表面疏水区附近的水化层脱离蛋白质,使得疏水区暴露,增大了蛋白质之间的疏水相互作用,发生聚集而沉淀称为盐析(salting-out)原理:(1)“盐溶”现象(salt-in)—低盐浓度下,增加蛋白质分子间静电斥力,蛋白质溶解度增大。

知识点睛热力学第一定律是能量守恒在热学中的体现,是解决所有涉及动力学过程的热力学题目 的基础。
“活塞”是连接两个互相分离的腔体的一种装置。
由于活塞通常可以自由移动,因此问 题会变得十分复杂。
然而,活塞题通常的特点是烦而不难,希望同学们能够耐心求解。
本讲 将向您介绍热力学第一定律以及一些活塞过程。
学完之后能给你的同学讲明白这几个问题,就算成功了:1) 为什么内能之和状态有关,做功和吸热与过程有关,为什么比热是与过程有关的,而不只是材料的属性。
2) 当活塞两边压强不一样的时候,算体积功,应当怎样选择用哪一边计算。
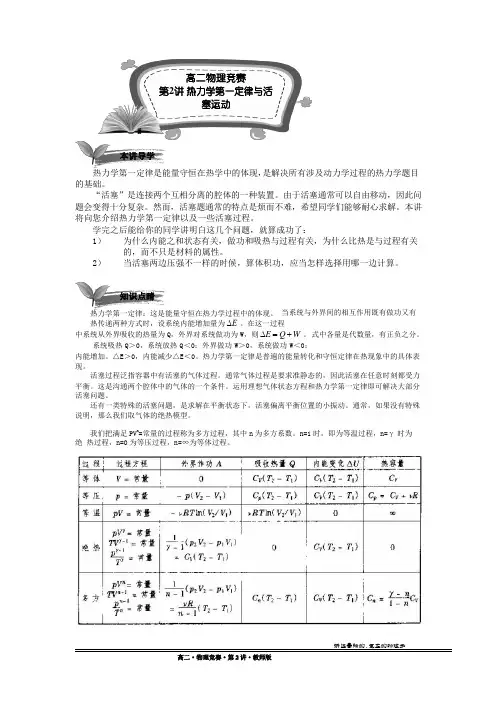
热力学第一定律:这是能量守恒在热力学过程中的体现。
当系统与外界间的相互作用既有做功又有热传递两种方式时,设系统内能增加量为 ∆E 。
在这一过程中系统从外界吸收的热量为 Q ,外界对系统做功为 W ,则 ∆E = Q + W 。
式中各量是代数量,有正负之分。
系统吸热 Q >0,系统放热 Q <0;外界做功 W >0,系统做功 W <0;内能增加。
△E>0,内能减少△E<0。
热力学第一定律是普遍的能量转化和守恒定律在热现象中的具体表 现。
活塞过程泛指容器中有活塞的气体过程。
通常气体过程是要求准静态的,因此活塞在任意时刻都受力 平衡。
这是沟通两个腔体中的气体的一个条件。
运用理想气体状态方程和热力学第一定律即可解决大部分 活塞问题。
还有一类特殊的活塞问题,是求解在平衡状态下,活塞偏离平衡位置的小振动。
通常,如果没有特殊 说明,那么我们取气体的绝热模型。
我们把满足 PV n=常量的过程称为多方过程,其中 n为多方系数。
n=1 时,即为等温过程,n=γ时为绝 热过程,n=0 为等压过程,n=∞为等体过程。
高二物理竞赛 第 2 讲 热力学第一定律与活塞运动本讲导学2通常,我们可以运用热学和力学来计算我们的大气层高度。
一个模型是等温模型,它假设各个高度的 大气是等温的,进而求解。
另一个模型是绝热模型,它假设气体的热交换是不充分的,不同高度的大气满足绝热关系:PV γ=C 。

分离过程实质简介摘要简要介绍了分离技术的分类和特征结合实例从热力学角度讨论分离过程的本质。
关键词分离过程实质热力学1 绪言分离技术广泛地应用于物理和化学的基础研究还有环境、医学、药学、材料、化工、食品和石油工程的应用研究。
可以说物质的分离是科学研究的重要步骤分离科学是一门涉及多学科知识反过来又推动其他学科发展的重要科学。
2 分离技术分类分离是利用混合物中各组分在物理性质或化学性质上的差异通过适当的方法或装置使各组分分配至不同的空间区域或在不同的时间依次分配至同一空间区域的过程。
通常用于分离的物质的性质列于表1.1。
表2.1 通常用于分离的物质性质类别物质性质物理性质力学性质密度、摩擦因数、表面张力、尺寸、质量热力学性质熔点、沸点、临界点、蒸气压、溶解度、分配系数、吸附电磁性质电导率、介电常数、签约率、电荷、淌度、磁化率输送性质扩散系数、分子飞行速度化学性质热力学性质反应平衡常数、化学吸附平衡常数、离解常数、电离点位反应速率反应速度常数生物学性质生物亲和力、生物吸附平衡、生物学反应速度常数分离方法的种类很多分类方法也很多从不同角度可将分离方法分成若干各有特色的类型。
2.1 按被分离物质的性质分类 1 物理分离法按被分离组分物理性质的差异采用适当的物理手段进行分离。
如离心分离和电磁分离。
2 化学分离法按被分离组分化学性质的差异通过适当的化学过程使其分离。
如沉淀分离、萃取分离、色谱分离和选择性溶解。
3 物理化学分离法按被分离组分物理化学性质的差异进行分离。
如蒸馏、挥发、电泳、区带熔融和膜分离。
2.2 按分离过程的本质分类1 平衡分离过程平衡分离过程是一种利用外加能量或分离剂使原混合物形成新的相界面利用互不相容的量相界面上的平衡关系使均相混合物得以分离的方法。
表2.2给出了常见的平衡分离方法。
表2.2 常见平衡分离方法第二相第一相气相液相固相超临界流体相气相—汽提、蒸发、蒸馏升华、脱附—液相吸收、蒸馏液-液萃取区带熔融、固相萃取超临界流体吸收固相吸附、逆升华结晶、吸附—超临界流体吸收超临界流体相—超临界流体萃取超临界流体萃取— 2 速度差分离过程速度差分离过程是一种外加能量强化特殊梯度场重力梯度、压力梯度、温度梯度、浓度梯度和电位梯度等用于非均匀相混合物分离的方法。


化工热力学知识在吸附分离过程中的应用一、基本概念(1)化工热力学“化工热力学”是热力学与化学相结合的学科,它在热力学内容中补充化合物众多及化学变化的特点,又增加了气液溶液及化学反应的内容。
又是热力学与化学工程相结合,除增加化学热力学内容外,又强调了组成变化的规律,要确定反应物与产物的化学平衡组成规律,更要解决各种相平问题,即各相组成分布的规律。
化工热力学是在基本热力学关系基础上,重点讨论能量关系和组成关系。
能量关系要比物理化学中简单的能量守恒大大扩展,在组成计算中包括化学平衡体系组成及相平衡组成计算及预测,对于各种不同种类相平衡,在各相组元化学位相同的基础上提出了使用的关系式,并在各种不对称体系情况下,可以适应或做出修正。
(2)吸附分离过程吸附分离是利用流体相中某一或多种组分积累在多孔固体吸附剂上,使流体各组分浓度改变而得以实现分离的单元操作。
吸附分离过程的性能依赖于流体在多孔固体吸附剂上的吸附性能(吸附容量和选择性)以及在多孔固体吸附剂内的扩散传质行为,其中吸附容量和选择性主要是由流体在吸附剂上的吸附平衡特性所决定的,因而流体的吸附平衡是吸附分离过程应用的基础。
二、吸附分离过程中相关现象及概念与热力学知识的联系(1)吸附的过程是放热的过程由吉布斯函数G的定义,G = H - TS等温下有公式:△G = △H - T△S而吸附作用是典型的熵减小过程(吸附质由自由运动状态到在吸附剂表面定向排列,其混乱度减小),即T△S < 0.要想等温等压下的吸附过程能够自发进行,必有△G ≤0,即△H - T△S ≤0,于是△H ≤T△S < 0 .可以看出吸附作用的△H 恒为负,也就是放热过程.(2)吸附等温线从热力学意义上说,固体的可吸附层是一独特的相,它和周围流体的平衡符合热力学定律,可以用吸附等温线方程来描述,因此对吸附热力学性能的研究可以通过研究吸附等温线来进行。
通过吸附等温线数据可以得到相关吸附热力学特性,如吸附热、吸附能分布函数,同时可得到吸附剂的孔容、比表面、孔径分布等数据,通过不同组分的等温线还可以计算分离系数。
化工分离过程重点1、相平衡:指混合物或溶液形成若干相,这些相保持着物理平衡而共存的状态,从热力学上看,整个物系的自由焓处于最小的状态;从动力学看,相间表观传递速率为零。
2、区域熔炼:是根据液体混合物在冷凝结晶过程中组分重新分布的原理,通过多次熔融和凝固,制备高纯度的金属、半导体材料和有机化合物的一种提纯方法。
3、独立变量数:一个量改变不会引起除因变量以外的其他量改变的量。
4、反渗透:是利用反渗透膜选择性地只透过溶剂(通常是水)的性质,对溶液施加压力克服溶液的渗透压,使溶剂从溶液中透过反渗透膜而分离出来的过程。
5、相对挥发度:溶液中的易挥发组分的挥发度与难挥发组分的挥发度之比。
6、理论板:是一个气、液两相皆充分混合而且传质与传热过程的阻力皆为零的理想化塔板。
7、清晰分割:若馏出液中除了重关键组分外没有其他的重组分,而釜液中除了轻关键组分外没有其他轻组分,这种情况为清晰分割。
8、全塔效率:完成给定任务所需要的的理论塔板数与实际塔板数之比。
默弗里板效率:实际板上的浓度变化与平衡时应达到的浓度变化之比。
9、泡点:在一定压力下,混合液体开始沸腾,即开始有气泡产生时的温度。
露点:在一定压力下,混合气体开始冷凝,即开始出现第一个液滴时的温度。
10、设计变量:设计分离装置中需要确定的各个物理量的数值,如进料流率,浓度、压力、温度、热负荷、机械工的输入(或输出)量、传热面大小以及理论塔板数等。
这些物理量都是互相关联、互相制约的,因此,设计者只能规定其中若干个变量的数值,这些变量称设计变量。
简答题:1、分离操作的重要意义答:分离操作一方面为化学反应提供符合质量要求的原料,清除对反应或者催化剂有害的杂质,减少副反应和提高收率;另一方面对反应产物起着分离提纯的作用,已得到合格的产品,并使未反应的反应物得以循环利用。
此外,分离操作在环境保护和充分利用资源方面起着特别重要的作用。
2、精馏塔的分离顺序答:确定分离顺序的经验法:1)按相对挥发度递减的顺序逐个从塔顶分离出各组分;2)最困难的分离应放在塔序的最后;3)应使各个塔的溜出液的摩尔数与釜液的摩尔数尽量接近;4)分离很高回收率的组分的塔应放在塔序的最后;5)进料中含量高的组分尽量提前分出。