2分离讲义过程热力学
- 格式:ppt
- 大小:2.86 MB
- 文档页数:51

《热力学第二定律》讲义一、热力学第二定律的引入在我们生活的这个世界中,热现象无处不在。
从烧开水时的水汽蒸腾,到冬天取暖时的热量传递,热的变化和流动贯穿于我们的日常生活。
而热力学第二定律,则是用来描述热现象中能量转换和传递的重要规律。
想象一下,一个热的物体和一个冷的物体相互接触,热量会自发地从热的物体流向冷的物体,直到它们的温度相等。
但是,你有没有想过,为什么热量不会自发地从冷的物体流向热的物体呢?这就是热力学第二定律所要探讨的核心问题之一。
二、热力学第二定律的表述热力学第二定律有多种表述方式,其中最常见的有克劳修斯表述和开尔文表述。
克劳修斯表述:热量不能自发地从低温物体传递到高温物体而不引起其他变化。
开尔文表述:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
为了更好地理解这两种表述,我们来举几个例子。
假如在一个封闭的房间里,有一台没有外接电源的冰箱。
如果热量能够自发地从冰箱内部的低温区传递到外部的高温环境,那么冰箱内部就会越来越冷,而房间却不会因为接收了这些热量而有任何其他变化。
但在现实中,这是不可能发生的。
再比如,有一个热机,它从高温热源吸收了一定的热量,并将其中一部分转化为有用功。
如果能够从单一热源吸收热量并完全转化为有用功,而不向低温热源排放任何热量,那么这样的热机就是“永动机”,但根据热力学第二定律,这种情况是不可能实现的。
三、热力学第二定律的实质热力学第二定律的实质是揭示了自然界中一切与热现象有关的实际过程都是不可逆的。
什么是不可逆过程呢?比如说,一滴墨水滴入一杯清水中,墨水会逐渐扩散,最终使整杯水都变得有颜色。
但是,我们不可能让这杯已经混合均匀的水自动地恢复到墨水和清水分离的状态。
再比如,一块光滑的冰块在常温下会逐渐融化成水,而这些水不会自动地再重新凝结成原来形状规则的冰块。
这些过程一旦发生,就无法自发地逆向进行,这就是不可逆过程。
而热力学第二定律正是说明了这类不可逆过程的方向性。

第二章 热力学第一定律一.基本要求1.掌握热力学的一些基本概念,如:各种系统、环境、热力学状态、系统性质、功、热、状态函数、可逆过程、过程和途径等。
2.能熟练运用热力学第一定律,掌握功与热的取号,会计算常见过程中的和的值。
3.了解为什么要定义焓,记住公式的适用条件。
4.掌握理想气体的热力学能和焓仅是温度的函数,能熟练地运用热力学第一定律计算理想气体在可逆或不可逆的等温、等压和绝热等过程中,的计算。
5.掌握等压热与等容热之间的关系,掌握使用标准摩尔生成焓和标准摩尔燃烧焓计算化学反应的摩尔焓变,掌握与之间的关系。
6.了解Hess定律的含义和应用,学会用Kirchhoff定律计算不同温度下的反应摩尔焓变。
二.把握学习要点的建议学好热力学第一定律是学好化学热力学的基础。
热力学第一定律解决了在恒定组成的封闭系统中,能量守恒与转换的问题,所以一开始就要掌握热力学的一些基本概念。
这不是一蹴而就的事,要通过听老师讲解、看例题、做选择题和做习题等反反复复地加深印象,才能建立热力学的概念,并能准确运用这些概念。
例如,功和热,它们都是系统与环境之间被传递的能量,要强调“传递”这个概念,还要强调是系统与环境之间发生的传递过程。
功和热的计算一定要与变化的过程联系在一起。
譬如,什么叫雨?雨就是从天而降的水,水在天上称为云,降到地上称为雨水,水只有在从天上降落到地面的过程中才被称为雨,也就是说,“雨”是一个与过程联系的名词。
在自然界中,还可以列举出其他与过程有关的名词,如风、瀑布等。
功和热都只是能量的一种形式,但是,它们一定要与传递的过程相联系。
在系统与环境之间因温度不同而被传递的能量称为热,除热以外,其余在系统与环境之间被传递的能量称为功。
传递过程必须发生在系统与环境之间,系统内部传递的能量既不能称为功,也不能称为热,仅仅是热力学能从一种形式变为另一种形式。
同样,在环境内部传递的能量,也是不能称为功(或热)的。
例如在不考虑非膨胀功的前提下,在一个绝热、刚性容器中发生化学反应、燃烧甚至爆炸等剧烈变化,由于与环境之间没有热的交换,也没有功的交换,所以。


《热力学第二定律》讲义在我们探索自然界的奥秘时,热力学定律无疑是至关重要的基石。
其中,热力学第二定律更是具有深刻的内涵和广泛的应用。
接下来,让我们一同深入了解这一定律。
热力学第二定律有多种表述方式,其中最为常见的是克劳修斯表述和开尔文表述。
克劳修斯表述指出:热量不能自发地从低温物体传到高温物体。
想象一下,在寒冷的冬天,如果没有外界的干预,房间里的冷空气不会自动地将热量传递给室外更冷的空气,从而使房间变暖。
这是因为热量的传递具有方向性,总是从高温处流向低温处。
开尔文表述则说:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
通俗地讲,就是不存在一种热机,它能够在只从一个热源吸收热量的情况下,持续不断地做功并且不产生任何其他变化。
为什么热力学第二定律如此重要呢?它实际上揭示了自然界中能量转化的方向性和不可逆性。
在实际生活中,我们能看到很多与热力学第二定律相关的现象。
比如,汽车发动机在工作时,燃料燃烧产生的能量并不能完全转化为推动汽车前进的有用功,而是有很大一部分以热能的形式散失到环境中。
这是因为要将热能完全转化为机械能是违反热力学第二定律的。
再比如,当我们把一杯热水放在桌子上,它会逐渐冷却,最终与周围环境达到相同的温度。
但相反的过程,即这杯已经冷却的水自动重新变热,而周围环境不变,是不会发生的。
热力学第二定律还对宇宙的演化有着深远的影响。
根据这一定律,宇宙中的熵(用来描述系统的混乱程度)总是趋向于增加。
这意味着宇宙从有序走向无序是一个不可逆转的过程。
从微观角度来看,热力学第二定律也有其解释。
在微观世界中,分子的运动是无序的。
当发生能量交换或物质转化时,无序度往往会增加。
然而,需要注意的是,热力学第二定律并不意味着我们在能量利用方面毫无办法。
虽然无法违背这一定律,但我们可以通过改进技术和优化系统,来提高能量的利用效率,减少熵的增加。
例如,现代的热机技术在不断发展,通过采用更先进的材料和设计,能够使热机的效率有所提高。

《热力学第二定律的微观解释》讲义在我们深入探讨热力学第二定律的微观解释之前,让我们先简要回顾一下热力学第二定律本身。
热力学第二定律有多种表述方式,其中最常见的是克劳修斯表述和开尔文表述。
克劳修斯表述指出:热量不能自发地从低温物体传到高温物体。
开尔文表述则说:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
那么,为什么会有这样的定律存在呢?要理解这背后的原因,我们需要从微观的角度来探究。
首先,我们来了解一下微观世界中的分子运动。
在任何物质中,分子都在不停地做无规则运动。
这种无规则运动的剧烈程度与温度密切相关,温度越高,分子运动就越剧烈。
在一个封闭系统中,分子的运动状态是极其多样的。
假设我们有一个容器,里面被隔板分成了两部分,左边是高温区域,右边是低温区域。
当隔板被抽掉后,高温区域的分子会与低温区域的分子相互碰撞和交换能量。
从概率的角度来看,高温区域分子的平均动能较大,低温区域分子的平均动能较小。
在碰撞过程中,更有可能出现高温区域的分子将能量传递给低温区域的分子,而不是相反。
这就导致了热量从高温区域向低温区域传递,最终使整个系统达到热平衡,温度趋于均匀。
如果要让热量自发地从低温区域传回到高温区域,就相当于要求在大量的分子碰撞中,低温区域分子持续地将更多的能量传递给高温区域分子。
从概率上来说,这种情况几乎是不可能发生的,这也就解释了克劳修斯表述。
再来看开尔文表述。
假设我们有一个单一热源,要从这个热源吸取全部热量并将其完全转化为有用功,不产生其他影响。
从微观角度来看,这意味着要让所有参与能量转化的分子都朝着一个完全有序的方向运动,从而完成有用的功。
然而,由于分子的运动是无规则的,要让它们全部协同一致地朝着一个方向运动,实现完全的有序,几乎是不可能的。
在实际情况中,总会有一些分子的运动方向与期望的方向不一致,导致能量的散失和浪费。
为了更深入地理解,我们引入“熵”这个概念。
熵可以用来描述一个系统的混乱程度或无序程度。

第1、2节功和内能热和内能1.绝热过程:系统只由于外界对它做功而与外界交换能量,它不从外界吸热,也不向外界放热的过程。
2.绝热过程中系统内能的增加量等于外界对系统所做的功,即ΔU=W。
3.热传递:热量从物体的高温部分传递到低温部分,或从高温物体传递给低温物体的过程。
4.系统在单纯的传热过程中,内能的增量ΔU等于外界向系统传递的热量Q,即ΔU=Q。
5.做功和热传递是改变内能的两种方式且具有等效性,但二者实质不同。
一、焦耳的实验1.绝热过程系统只通过对外界做功或外界对它做功而与外界交换能量,它不从外界吸热,也不向外界放热。
2.代表实验(1)重物下落带动叶片搅拌容器中的水,引起水温度上升。
(2)通过电流的热效应给水加热。
3.实验结论要使系统状态通过绝热过程发生变化,做功的数量只由过程始末两个状态决定,而与做功的方式无关。
二、功和内能1.内能的概念(1)内能是描述热力学系统自身状态的物理量。
(2)在绝热过程中做功可以改变热力学系统所处的状态。
2.绝热过程中内能的变化(1)表达式:ΔU=W。
(2)外界对系统做功,W为正;系统对外界做功,W为负。
三、热和内能1.热传递(1)条件:物体的温度不同。
(2)过程:温度不同的物体发生热传递,温度高的物体要降温,温度低的物体要升温,热量从高温物体传到低温物体。
(3)热传递的三种方式:热传导、热对流、热辐射。
2.热和内能(1)单纯地对系统传热也能改变系统的热力学状态,即热传递能改变物体的内能。
(2)热量:在单纯的传热过程中系统内能变化的量度。
(3)单纯的传热过程中内能的变化。
①公式:ΔU=Q。
②物体吸热,Q为正;物体放热,Q为负。
1.自主思考——判一判(1)温度高的物体含有的热量多。
(×)(2)内能大的物体含有的热量多。
(×)(3)热量一定从内能多的物体传递给内能少的物体。
(×)(4)做功和热传递都可改变物体的内能,从效果上是等效的。
(√)(5)在绝热过程中,外界对系统做的功小于系统内能的增加量。
知识点睛热力学第一定律是能量守恒在热学中的体现,是解决所有涉及动力学过程的热力学题目 的基础。
“活塞”是连接两个互相分离的腔体的一种装置。
由于活塞通常可以自由移动,因此问 题会变得十分复杂。
然而,活塞题通常的特点是烦而不难,希望同学们能够耐心求解。
本讲 将向您介绍热力学第一定律以及一些活塞过程。
学完之后能给你的同学讲明白这几个问题,就算成功了:1) 为什么内能之和状态有关,做功和吸热与过程有关,为什么比热是与过程有关的,而不只是材料的属性。
2) 当活塞两边压强不一样的时候,算体积功,应当怎样选择用哪一边计算。
热力学第一定律:这是能量守恒在热力学过程中的体现。
当系统与外界间的相互作用既有做功又有热传递两种方式时,设系统内能增加量为 ∆E 。
在这一过程中系统从外界吸收的热量为 Q ,外界对系统做功为 W ,则 ∆E = Q + W 。
式中各量是代数量,有正负之分。
系统吸热 Q >0,系统放热 Q <0;外界做功 W >0,系统做功 W <0;内能增加。
△E>0,内能减少△E<0。
热力学第一定律是普遍的能量转化和守恒定律在热现象中的具体表 现。
活塞过程泛指容器中有活塞的气体过程。
通常气体过程是要求准静态的,因此活塞在任意时刻都受力 平衡。
这是沟通两个腔体中的气体的一个条件。
运用理想气体状态方程和热力学第一定律即可解决大部分 活塞问题。
还有一类特殊的活塞问题,是求解在平衡状态下,活塞偏离平衡位置的小振动。
通常,如果没有特殊 说明,那么我们取气体的绝热模型。
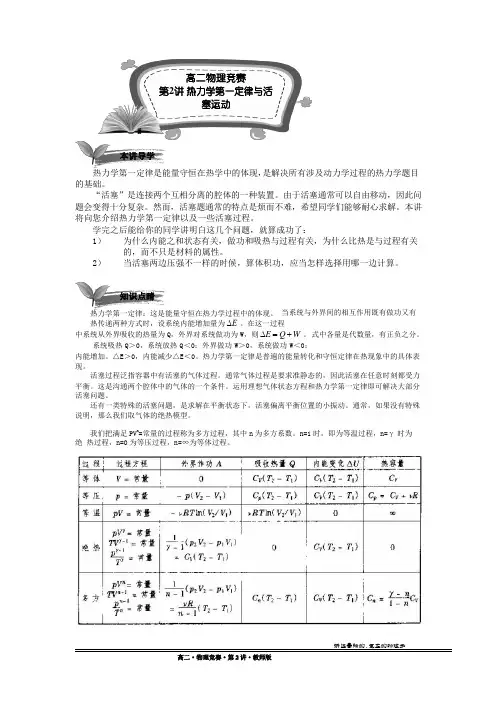
我们把满足 PV n=常量的过程称为多方过程,其中 n为多方系数。
n=1 时,即为等温过程,n=γ时为绝 热过程,n=0 为等压过程,n=∞为等体过程。
高二物理竞赛 第 2 讲 热力学第一定律与活塞运动本讲导学2通常,我们可以运用热学和力学来计算我们的大气层高度。
一个模型是等温模型,它假设各个高度的 大气是等温的,进而求解。
另一个模型是绝热模型,它假设气体的热交换是不充分的,不同高度的大气满足绝热关系:PV γ=C 。


第二章精馏Chapter 2 Distillation主要内容及要求:1.相平衡常数计算:状态方程法,活度系数法2.泡点、露点计算(1)泡点计算:在一定P(或T)下,已知x i,确定T b(或P b)和y i(2)露点计算: 在一定P(或T)下,已知y i,确定T b(或P b)和x i3.等温闪蒸计算:给定物料的量与组成,计算在一定P和T下闪蒸得到的汽相量与组成,以及剩余的液相量与组成。
4.掌握多组分精馏过程的基本原理、流程以及简捷计算方法;5.掌握萃取精馏和共沸精馏的原理、流程及其简捷计算法。
授课主要内容:2.1 概述2.2 汽液相平衡2.3 精馏计算2.4 特殊精馏2.5 板效率2.1 概述精馏原理:精馏是分离液体混合物的单元操作,是利用混合物中各组分挥发度的差异及回流的工程手段,实现组分的分离。
不适宜用普通精馏进行分离的物系:1. 1→AB α2.1=AB α3. 热敏性物料4. 难挥发组分的稀溶液2.1.1 理论板、板效率以及填料的理论板当量高度(HETP )1. 理论板理论板= f(相平衡,分离要求,操作参数)⏹ 所谓理论塔板,如右图所示,即气、液两相在塔板上充分接触,混合进行传质、传热后,两相组成均匀且离开塔板的气、液两相呈相平衡关系。
显然,在相同条件下,理论板具有最大的分离能力,是塔分离的极限能力。
该状态可由热力学方法求解确定,离开塔板的气、液两相存在的相平衡关系由以下关系式表达: ⏹ 相平衡关系:y i =k i ·x i相平衡关系是传质过程趋向的目标,或所达到的热力学极限状态。
理论板是一个理想化了的两相间接触传质场所,也称为平衡级。
理论板符合以下三条假设:1)进入该板的不平衡物流在其间充分接触传质,使离开该板的汽液两相物流间达到了相平衡;2)在该板上发生接触的汽液两相各自完全均匀,板上各点汽相浓度和液相浓度各自都相同;3)该板上充分接触后的汽液两相实现了完全机械分离,不存在夹带、泄漏。

《热力学第二定律的微观解释》讲义一、热力学第二定律的表述在深入探讨热力学第二定律的微观解释之前,让我们先来回顾一下热力学第二定律的常见表述。
克劳修斯表述:热量不能自发地从低温物体传到高温物体。
开尔文表述:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
这两种表述虽然形式不同,但都揭示了自然界中热现象的方向性和不可逆性。
二、热力学系统与微观状态要理解热力学第二定律的微观解释,首先要了解热力学系统和微观状态的概念。
热力学系统是我们所研究的对象,它可以是一定量的气体、液体或固体。
而微观状态则是指系统中每个微观粒子的具体位置和动量。
例如,对于一定量的气体,微观状态就包括每个气体分子的位置和速度。
三、无序程度与熵熵是热力学中一个重要的概念,它可以用来描述系统的无序程度。
想象一个房间,起初物品摆放整齐有序,这是一种低熵的状态。
随着时间的推移,物品变得杂乱无章,这就是高熵的状态。
在热力学中,熵的增加意味着系统的无序程度增加。
从微观角度来看,熵与系统可能的微观状态数有关。
微观状态数越多,熵就越大。
四、热力学第二定律的微观本质为什么热现象具有方向性和不可逆性呢?从微观角度可以这样理解。
当一个系统处于非平衡态时,分子的分布是不均匀的,存在着一定的有序性。
随着时间的推移,分子之间不断发生碰撞和相互作用。
由于分子运动的随机性,系统会逐渐趋向于更加均匀的分布,也就是无序程度增加。
例如,将冷热水混合,冷水分子和热水分子会相互碰撞、交换能量,最终达到温度均匀的状态。
这个过程是自发的,而且不可逆。
从微观状态数的角度来看,均匀分布的微观状态数远远多于不均匀分布的微观状态数。
因此,系统自发地从微观状态数少的状态(有序)向微观状态数多的状态(无序)转变,这就导致了熵的增加。
五、概率与热力学第二定律在微观世界中,分子的运动是基于概率的。
比如,一个分子更有可能出现在空间中的多个位置,而不是局限于某一个特定的位置。
当系统中的分子数量众多时,基于概率的结果就表现为宏观上的确定性规律。

《热力学第二定律》讲义在我们探索自然界的奥秘时,热力学定律是至关重要的基石。
而其中的热力学第二定律,更是具有深远的意义和广泛的应用。
让我们先从一个简单的日常现象说起。
想象一下,一杯热咖啡放在桌子上,随着时间的推移,它会逐渐冷却,直到与周围环境达到相同的温度。
但你有没有想过,为什么这杯热咖啡不会自动变得更热,而周围环境却变得更冷呢?这就是热力学第二定律在起作用。
热力学第二定律有多种表述方式,其中最经典的是克劳修斯表述和开尔文表述。
克劳修斯表述指出:热量不能自发地从低温物体转移到高温物体。
这就好比热总是“喜欢”从高温处流向低温处,而不会自动反其道而行之。
如果要实现热量从低温物体转移到高温物体,就必须付出代价,比如通过消耗外部能量驱动热泵或制冷机来完成这个过程。
开尔文表述则说:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
简单来说,就是热机在工作时,总会有一部分能量以废热的形式散失掉,无法将从热源吸收的全部热量都转化为有用的功。
为了更深入地理解热力学第二定律,我们来探讨一下熵的概念。
熵是用来描述系统混乱程度或者无序程度的一个物理量。
在一个孤立系统中,熵总是倾向于增加。
这意味着系统会朝着更加混乱和无序的方向发展。
例如,一个整洁的房间如果没有人去整理,会随着时间变得越来越杂乱。
同样,在自然界中,许多自发的过程都是熵增加的过程。
那么,热力学第二定律对我们的生活和社会有着怎样的影响呢?在能源领域,热力学第二定律告诉我们,能源的利用是有极限的。
无论我们的技术多么先进,都无法实现能源的百分百利用。
这就促使我们不断努力提高能源的利用效率,发展更高效的能源转换技术。
在环境保护方面,熵增的概念提醒我们,自然界的自净能力是有限的。
如果我们过度排放污染物,超过了环境的承受能力,就会导致环境的恶化和生态平衡的破坏。
在工业生产中,了解热力学第二定律有助于优化工艺流程,减少能源浪费和提高生产效率。
总之,热力学第二定律虽然看似抽象,但却与我们的生活息息相关。
《热力学第二定律》讲义在我们探索自然界的奥秘时,热力学定律就像是指引我们前进的明灯。
而其中的热力学第二定律,更是具有极其重要的地位和深远的意义。
让我们先来了解一下热力学第二定律的基本表述。
它通常有两种常见的表述方式。
一种是克劳修斯表述:热量不能自发地从低温物体传递到高温物体。
想象一下,在寒冷的冬天,如果没有外界的干预,比如空调、暖气等,热量不会自动地从寒冷的室外传到温暖的室内。
另一种是开尔文表述:不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
这就好比一台热机,它在工作时,不可能将从热源吸收的热量全部转化为有用的机械功,总会有一部分热量散失掉。
为什么热力学第二定律如此重要呢?这是因为它揭示了自然界中能量转化和传递的方向性。
在我们的日常生活中,很多现象都可以用热力学第二定律来解释。
比如,一个混乱的房间,如果没有人去整理,它不会自动变得整齐有序;一杯热水放在桌子上,会逐渐冷却,而不会自己变得更热。
从微观角度来看,热力学第二定律与熵的概念紧密相连。
熵是用来描述系统混乱程度的一个物理量。
简单来说,一个系统越混乱,熵值就越大。
根据热力学第二定律,在一个孤立系统中,熵总是倾向于增加,或者保持不变,但永远不会减少。
这意味着,自然界的一切自发过程,都是朝着熵增加的方向进行的。
举个例子,把一堆不同颜色的小球随意地放在一个盒子里,这是一个相对混乱的状态,熵值较大。
如果要把它们按照颜色整齐地排列,就需要外界对这个系统做功,比如有人花费时间和精力去整理。
而如果没有人干预,这些小球只会越来越混乱,熵值不断增大。
再比如,燃烧燃料产生能量的过程。
燃料燃烧时,分子的有序结构被打破,转化为无序的热能和废气。
这个过程中熵增加了,如果想要将这些废气和热能重新转化为燃料的有序结构,是极其困难的,甚至在实际中几乎是不可能的。
热力学第二定律对于工程技术和实际应用也有着重要的指导意义。
在热机的设计和改进中,工程师们必须考虑到热力学第二定律的限制。
《热力学第二定律》讲义在我们探索自然世界的奥秘中,热力学定律无疑是极其重要的基石。
而其中的热力学第二定律,更是具有深远的意义和广泛的应用。
首先,让我们来理解一下什么是热力学第二定律。
简单地说,它表明了在一个孤立系统中,热量不可能自发地从低温物体传递到高温物体,或者说,任何自发的过程总是朝着熵增加的方向进行。
这里的熵,可以理解为系统的混乱程度。
为了更直观地感受这个定律,我们可以想象一个热的物体和一个冷的物体相互接触。
按照我们的直觉,热量似乎应该从热的物体均匀地流向冷的物体,直到两者温度相同达到平衡。
但热力学第二定律告诉我们,这个过程是不可逆的。
也就是说,一旦两者温度相同,热量不会自发地从冷的物体回到热的物体,使冷的物体更冷,热的物体更热。
那为什么会有这样的定律呢?这其实与自然界的宏观趋势有关。
从微观角度来看,分子和原子在不停地运动和碰撞,而这种运动和碰撞是随机的。
在一个封闭的系统中,随着时间的推移,这种随机性会导致系统的熵增加,也就是混乱程度增加。
比如,把一堆整齐摆放的积木弄乱是很容易的,但要让这堆乱掉的积木重新恢复整齐的摆放,就需要外界的干预和做功。
同样的道理,一个房间如果不打扫,会越来越乱;一个城市如果没有管理和规划,也会变得越来越无序。
热力学第二定律在很多实际的领域都有着重要的应用。
在能源领域,它告诉我们能源的转化和利用是有一定限度的。
例如,在热机中,燃料燃烧产生的热能不可能完全转化为机械能,总会有一部分能量以废热的形式散失掉。
这也就限制了热机的效率,促使我们不断寻找更高效的能源利用方式。
在化学领域,热力学第二定律可以帮助我们判断化学反应的方向和限度。
如果一个反应会导致系统的熵增加,那么这个反应在一定条件下就有可能自发进行;反之,如果一个反应会导致系统的熵减少,那么这个反应就需要外界提供能量才能进行。
在生物学中,生命的存在似乎与热力学第二定律有所矛盾。
生命系统是高度有序的,从简单的细胞到复杂的生物体,都展现出了精妙的结构和功能。
热学讲义2007年目录第1章热学导论 (1)§1.1 热学 (1)§1.2 热学的研究方法 (2)第2章平衡态和状态方程 (4)§2.1 平衡态状态参量 (4)§2.2 温度和温标热力学第零定律 (8)§2.3 状态方程 (11)§2.3.1 理想气体 (12)§2.3.2 实际气体---范德瓦耳斯气体 (14)§2.3.3 纯物质 (15)第3章气体分子动理论 (16)§3.1 物质的微观理论 (16)§3.2 理想气体的初步微观理论 (17)§3.2.1 微观模型 (17)§3.2.2 压强的统计解释 (17)§3.2.3 温度的统计解释 (19)§3.2.4 道尔顿分压定律 (20)§3.3 近独立子系的麦克斯韦—玻尔兹曼分布 (20)§3.3.1 微观模型与微观描述 (20)§3.3.2 最概然分布 (23)§3.3.3 平衡态的微观理解 (25)§3.3.4 玻尔兹曼熵 (26)§3.4 麦克斯韦速度分布律和速率分布律 (26)§3.4.1 速度分布律与速率分布律 (26)§3.4.2 速率分布律的实验验证 (28)§3.5 玻尔兹曼分布律 (29)§3.5.1 玻尔兹曼分布律 (29)§3.5.2 重力场中微粒按高度的分布 (30)§3.6 能均分定理 (31)§3.6.1 能量按自由度均分定理 (31)§3.6.2 理想气体的内能和定容热容量 (32)§3.6.3 经典理论的缺陷 (33)§3.7 气体分子碰撞和平均自由程 (34)§3.7.1 碰撞及其描述 (34)§3.7.2 分子随自由程的概率分布 (36)§3.8 气体中的输运过程 (36)§3.8.1 宏观规律 (36)§3.8.2 微观规律 (38)第4章热力学第一定律 (41)§4.1 热力学过程 (41)§4.2 热量功内能 (42)§4.2.1 热量 (42)§4.2.2 功 (42)§4.2.3 内能 (43)§4.3 热力学第一定律 (44)§4.4 热力学第一定律对理想气体的应用 (45)§4.4.1 理想气体做功 (45)§4.4.2 理想气体的内能和焓 (45)§4.4.3 理想气体的热容 (46)§4.4.4 热力学过程 (46)第5章热力学第二定律 (47)§5.1 卡诺循环及其效率 (47)§5.2 第二定律的两种表述及其等价性 (49)§5.3 卡诺定理 (50)§5.4 克劳修斯不等式和熵 (50)§5.5 热力学微分方程 (53)§5.5.1 热力学基本微分方程 (53)§5.5.2 热力学势与Maxwell关系 (54)§5.5.3 特性函数 (56)§5.6 热力学第二定律的再讨论 (57)§5.6.1 热力学第二定律的各种表述 (57)§5.6.2 平衡判据、平衡条件和稳定性条件 (58)第6章相变热力学 (62)§6.1 相图 (62)§6.2 克拉珀龙方程相变理论 (64)§6.3 范德瓦耳斯气体 (66)索引 (69)参考文献 (74)第1章热学导论物理研究的基本框架是在一定的背景知识下提出问题,分析问题,解决问题,解决问题之后得到的知识又成为新的背景知识。