- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2HNO3+NO),有 刺激性气味, 有毒气体。 (3)四氧化二氮性质: 无色气体,N2O4 2NO2。
特别提醒:
①氮气与氧气反应的条件为放电,而一氧化氮与氧气在 常温下就可反应且反应较快。
②N2O4 2NO2,正反应为吸热反应。
③二氧化氮气体中存在一定量的四氧化二氮。
★互动探究1 NO因污染空气而臭名昭著。近年来,发 现少量的NO在生物体内许多组织中存在,它有扩张血 管、免疫、增强记忆的功能,因而成为当前生命科学的 研究热点。NO亦被称为“明星分子”。NO的危害有 哪些?
易溶于水(1∶700),形成氨水。
3.化学性质
(1)与水反应:
NH3+H2O NH3·H2O
H
4
N +OH-
。
注:氨水中含大量NH3·H2O,但表示浓度时用NH3的量。 0.1 mol·L-1氨水的含义是 1 L溶液中含NH3为0.1 mol。
(2)与酸反应:NH3+HCl SO4
NH4Cl(白烟),2NH3+H2
(4)氮气的用途: 在工业上是合成氨、制硝酸的重要原 料;在焊接和粮食贮存中作保护气;在医学上液氮作冷 冻剂。
2.氮的氧化物
(1)一氧化氮性质:⑧无色,不溶于水,⑨有毒气体,能与血 液中的血红蛋白结合,易被空气中的氧气氧化:⑩2NO+
O2
2NO2。
(2)二氧化氮性质: 红棕色, 易溶于水(3NO2+H2O
H
4
(3) 与非金属反(N应H:44N)2HS3O+45,实O2质 是 NH3+H+ 4NO+6H2
NO ,2 NH。3+ 3Cl2
6HCl+N2, 8NH3+ 3Cl2
6
NH4Cl+N2。
4.NH3的制法: (1)工业制法:
N2+3H2
2NH3
H2的来源: C+H2O(g) CO+H2 (2)实验室制法: 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+
②与非金属反应一般是浓HNO3被还原为 NO2,稀
HNO3被还原为 NO,非金属常被氧化为最高价含氧酸
或高价氧化物:
C+4HNO3(浓)
CO2+4NO2 ↑+2H2O
S+6HNO3(浓)
H2SO4+6NO2↑+2H2O
3P+5HNO3(稀)+2H2O ③与还原性化合物反应:
3H3PO4+5NO↑
2H2O 注:NH3不能用CaCl2、浓H2SO4干燥,可用 碱石灰干燥, 向下排空气法收集,用棉花 防NH3与空气对流,便于
收集纯净的NH3。 (3)检验: 用湿润的红色石蕊试纸,现象是变蓝,或用
蘸有浓HCl的玻璃棒,接近有白烟。 四、铵盐
1.物理性质: 无色晶体, 易溶于水
2.化学性质:
况下的体积为11.2 L,则生成NO和NO2的体积分别是
、
。欲使反应生成的气体在NaOH溶
液中全部转化为NaNO3,至少需要30%的双氧水
g。
答案:5.824 L;5.376 L;57.8
三、氨气
1电.氮子的式氢: 化物 — —氨
H
N
H
H
2.物理性质
无色,有 刺激性气味, 易液化(与Cl2、CO2相同),极
用碱液与铵盐共热,放出氨气, NH 4 +OH- NH3 ↑+
H2O,然后用湿润的红色石蕊试纸检验该气体,试纸 变
H
4
蓝,证明有N 。
考点透析 考点1 氮的氧化物溶于水的计算
体的
典例1 装有50 mL NO2、NO混合气
量筒倒立于水槽中,反应后气体体积缩小为30 mL
A.5∶3
第4讲 氮及其重要化合物
一、氮气与氮的氧化物
1、氮气
(1)分子式:①N2;电子式: ②
N︙︙N ;结构式:③N≡N。
(2)化学性质 ①与H2反应:④N2+3H2 2NH3
②与O2反应:⑤N2+O2 2NO
③与某些金属反应:如3Mg+N2
Mg3N2
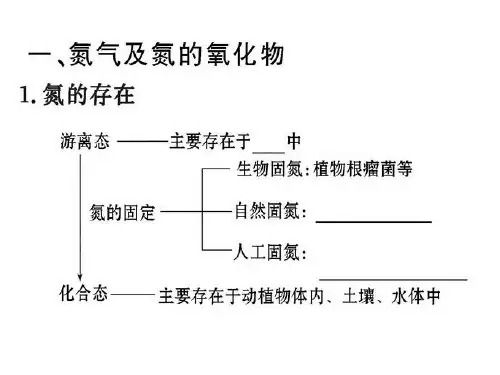
(3)氮的固定:将⑥游离态的氮转变为⑦化合态的氮的 过程。
HNO3还原为N2O、N2或NH3。
3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O
4Zn+10HNO3(较稀)
4Zn(NO3)2+N2O↑+5H2O
4Zn+10HNO3(极稀)
4Zn(NO3)2+NH4NO3+3H2O
色。 (1)不稳定性:4HNO3
4NO2↑+O2↑+2H2O,生成的
NO2溶于酸中可使酸呈黄色,所以HNO3应存放在 棕色
瓶(2)中强。氧化性:无论浓、稀HNO3都有氧化性,浓度越高, 氧化性越强。
①与金属反应:常温下,浓HNO3与 Fe、Al钝化。硝酸
与金属的反应复杂,一般浓硝酸被还原为 NO2;稀硝酸
3FeO+10HNO3
特别提醒:
3Fe(NO3)3+NO↑+5H2O
硝酸具有强氧化性。不仅是硝酸分子,只要是在强酸性 溶液中,硝酸根离子就具有强氧化性,可与还原性物质
或离子反应。在很多题目中经常隐含这一条件。
★互动探究2 将32.64 g铜与140 mL一定浓度的硝酸
反应,铜完全溶解产生的NO和NO2混合气体在标准状
B.3∶5
C.3∶2
O2和NO的体积比是 ( )
【解析】设混合气体中NO2的体积为x。
差量法:3NO2+H2O 2HNO3+NO
ΔV
3 mL
1 mL 2 mL
x
3 mx L
2m L
= 2 0 m L
答案:破坏臭氧层,造成酸雨,与人体血红蛋白结合。
二、硝酸 1.物理性质 纯HNO3为 无色液体,易 挥发,形成 白雾,有 刺 激
性气味。挥发性随浓度增大而增强,98%以上的称为
发烟硝酸,常用浓HNO3的质量分数约为 69%。 浓 2.化学特性 H由N于OH3与NO浓3盐 酸体积比O 3为1∶H+3+的N混 合,所物以叫具王有水酸,能的溶通解性,但与 金金和属铂反。
(1)受热易分解:
NH4HCO3
NH3↑+CO2 ↑+H2O
NH4Cl
NH3↑+HCl↑(在容器上部重新结合生成
NH4Cl) NH4NO3、(NH4)2SO4受热分解的产物复杂,NH4NO3不能 受撞击。
(2)与碱反应生成氨气:如果有加热,就写生成 氨气,如
果没有加热,就生成 NH3·H2O。 3.N H 4 的检验