高三化学一轮复习之《氮及其重要化合物》
- 格式:pptx
- 大小:1011.92 KB
- 文档页数:2


《氮及其重要化合物》讲义一、氮元素的存在与性质氮元素在自然界中广泛存在,是地球大气的主要成分之一。
大气中约 78%是氮气(N₂)。
氮气是一种无色、无味、无毒的气体,化学性质相对稳定。
氮原子的结构特点使得氮元素具有多样的化合价,常见的有-3、0、+1、+2、+3、+4、+5 等。
这种化合价的多样性决定了氮及其化合物丰富的化学性质。
二、氮气(N₂)氮气分子由两个氮原子通过三键结合而成,键能很大,因此氮气在常温常压下化学性质稳定。
但在高温、高压、放电等条件下,氮气能与氧气、氢气等发生反应。
1、氮气与氧气的反应在放电或高温条件下,氮气和氧气会发生反应生成一氧化氮(NO):N₂+ O₂= 2NO2、氮气与氢气的反应氮气和氢气在高温、高压、催化剂的条件下可以合成氨气(NH₃):N₂+ 3H₂⇌ 2NH₃三、氮的氧化物氮的氧化物种类较多,常见的有一氧化氮(NO)、二氧化氮(NO₂)等。
1、一氧化氮(NO)一氧化氮是一种无色、难溶于水的气体,在空气中极易被氧化为二氧化氮。
它在生物体内具有重要的生理作用,如调节血管舒张等。
2、二氧化氮(NO₂)二氧化氮是一种红棕色、有刺激性气味的气体,易溶于水并与水反应生成硝酸和一氧化氮:3NO₂+ H₂O = 2HNO₃+ NO二氧化氮是形成酸雨和光化学烟雾的重要污染物之一。
四、氨气(NH₃)氨气是一种无色、有刺激性气味的气体,极易溶于水,水溶液呈碱性。
1、氨气的化学性质(1)与水反应:NH₃+ H₂O ⇌ NH₃·H₂O ⇌ NH₄⁺+ OH⁻(2)与酸反应:NH₃+ HCl = NH₄Cl(3)催化氧化:4NH₃+5O₂=4NO +6H₂O(催化剂、高温)2、氨气的制备实验室常用氯化铵(NH₄Cl)和氢氧化钙Ca(OH)₂混合加热来制取氨气:2NH₄Cl + Ca(OH)₂= CaCl₂+ 2NH₃↑ + 2H₂O 工业上则是通过氮气和氢气的合成反应来大规模生产氨气。


高三第一轮复习第四章 非金属及其重要化合物 第四节 氮及其重要化合物考点一 氮及其重要化合物铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3酸氮气铵盐氧化物氢化物(1)自然界中氮的存在和氮的固定(2) N 2的性质铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3酸氮气铵盐氧化物氢化物(2) NH 3化学性质(1) NH 3物理性质 颜色 气味 密度 溶解性 用途 无色刺激比空气小溶于水(1∶700)制冷剂(易液化)酸氮气铵盐氧化物氢化物氨气的实验室制法①常规方法: 固+固 NH 3△②其他方法铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5 N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3NH 3·H 2O氮气铵盐氧化物 酸氢化物(1)物理性质(2)化学性质—“三解”都是无色或白色晶体,易溶于水铵盐单质氧化物酸N 2HNO 2HNO 3NaNO 3含氧酸盐NaNO 2-30+2+3+4+1+5N 2ONO N 2O 3 NO 2 N 2O 5 NH 4Cl氢化物NH 3NH 3·H 2O氮气铵盐氧化物酸氢化物(2)NO、NO2的比较(1)氮的氧化物氮气铵盐氧化物酸含氧酸盐氢化物(3)常见NOx 的尾气处理方法① 碱液吸收法2NO 2+2NaOH==NaNO 3+NaNO 2+H 2O NO 2+NO+2NaOH==2NaNO 2+H 2O② 催化转化:在催化剂、加热条件下,氨将氮氧化物转化为无毒气体(N 2)或NO x 与CO 在一定温度下催化转化为无毒气体(N 2和CO 2),一般适用汽车尾气的处理。


年级高三学科化学版本人教新课标版课程标题高考第一轮复习——氮及其化合物编稿老师刘学超一校张琦锋二校黄楠审核张美玲一、考纲要求1. 了解氮元素单质及其重要化合物的主要性质和应用2. 了解氮元素单质及其重要化合物对环境质量的影响二、考题规律:本专题内容,涉及化合物数量众多,且与其他知识联系密切,近几年在高考命题中常以氮、磷及其化合物知识为载体,与化学基本概念、基本理论、化学实验与化学计算有机结合,综合考查学生分析问题、解决问题的能力。
主要考查的知识点有:①N2、NH3的分子结构与性质,②NO、NO2的混合气体溶于水的有关计算,③HNO3的酸性、不稳定性、强氧化性及工业制法,④NH4+的检验,铵盐的性质,NH3的实验室和工业制法,NH3溶于水的有关计算。
⑤结合生活实际考查环境保护的相关知识。
三、考向预测:对本专题内容的考查形式多种多样,且与其他板块的知识联合考查,但仍以元素推断题和实验题为主,预计明年高考中对元素化合物知识的考查仍是重点。
以氮及其化合物为知识背景,考查化学基本概念、基本理论、实验操作及化学计算,将是近年高考的一大特色,注重硝酸工业与环境保护问题,培养学生爱护环境、保护环境的意识,也是近年高考命题的重要方向。
一、氮及其化合物转化关系:二、氨气及铵盐1. 氨气的制备(1)用铵盐制取①反应原理(化学方程式):Ca (OH )2+2NH4Cl=====△CaCl2+2NH3↑+2H2O ②实验装置(如图)③验满方法:a. 将湿润的红色石蕊试纸放在试管口,若试纸变蓝,说明氨气已收集满。
b. 将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生,说明氨气已收集满。
④干燥方法:通过以下任一装置。
注意不能用无水CaCl2干燥NH3,因为二者能发生反应。
⑤棉花的作用:减缓NH3与空气对流,收集纯净的NH3。
(2)用浓氨水来制取 ①加热浓氨水a. 反应原理:NH3·H2O=====△NH3↑+H2O b. 装置图:②利用浓氨水与固体强碱或生石灰来制取NH3。

课时规范练13氮及其重要化合物一、选择题:本题共7小题,每小题只有一个选项符合题目要求。
1.(2021广东广州二模)氮是生命活动不可缺少的重要元素。
下列叙述错误的是()A.氮气既可作氧化剂又可作还原剂B.氮气和氧气在放电条件下直接生成NO2C.氮气是工业合成氨的原料之一D.氮的固定是将大气中的氮气转化成氮的化合物2.(高考题组合)下列说法正确的是()A.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生B.向浓硝酸中插入红热的炭,产生红棕色气体,证明炭可与浓硝酸反应生成NO2C.浓硝酸和稀硝酸与Cu反应的还原产物分别为NO2和NO,故稀硝酸氧化性更强D.常温下,铝遇浓硝酸或浓硫酸时会发生钝化3.(2022江苏模拟)下列氮及其化合物的性质与用途具有对应关系的是()A.N2不溶于水,可用作保护气B.NH3极易溶于水,可用作制冷剂C.NO2具有强氧化性,可作火箭燃料推进剂D.HNO3易挥发,可用来制备硝酸纤维4.如图,试管中充满NO2,现向其中缓慢通入O2,用水吸收NO2(假设每次通入的O2能完全反应)。
下列说法正确的是()A.当试管内溶液的pH不再变化时,说明NO2全部转化为HNO3(假设试管内的溶质不向水槽中扩散)B.当试管内气体不是红棕色时,说明NO2全部转化为HNO3C.水槽内的水改为稀盐酸,有利于吸收NO2D.水槽内的水改为稀NaOH溶液,有利于吸收NO25.(2022重庆高三模拟)探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是()A.将集有氨的试管倒扣于水槽中,液体迅速充满试管,说明氨极易溶于水B.向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有N H4+C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性D.将红热的Pt丝伸入上图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨催化氧化的产物中有NO6.(2022河北衡水中学阶段检测)亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,会导致中毒事故,它的部分性质如图,下列说法错误的是()A.可用碘化钾淀粉试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)B.亚硝酸钠可以加到食品中,但添加量要符合规定C.NaNO2与N2H4反应生成NaN3的化学方程式为NaNO2+N2H4NaN3+2H2OD.上图所涉及的化学反应都是氧化还原反应7.(2021辽宁朝阳一模)氨催化氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示装置。
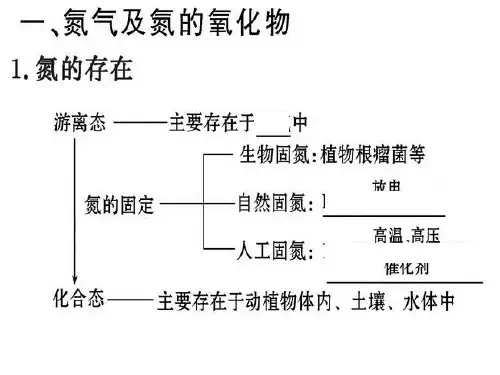

1高中化学必修一3.2氮及其重要化合物-知识点1、氮气是无色、无味的气体,液氮常用作冷冻剂。
氮气很难被植物吸收,植物通常从含氮化合物中获得氮元素。
将空气中的游离态氮转化为化合态氮的过程称为固氮,固氮对植物生长尤为重要。
2、天然固氮有两种方式。
①生物固氮,氮气在豆科植物的根瘤菌的固氮酶作用下还原为氨 ;②大气固氮,N +O −−→−放电2NO 。
一氧化氮难溶于水,容易与氧气化合,生成红棕色并有刺激性气味的NO 2。
2NO+O 2→2NO 2。
NO 2气体有毒,易溶于水,3NO 2+H 2O →2HNO 3+NO 。
硝酸与土壤中的矿物质反应生成硝酸盐(氮肥)。
以上过程就是“雷雨发庄稼”的原因。
3、人工固氮目前主要通过合成氨来实现。
N 2+3H 2−−−−−→−高温、高压、催化剂2NH 3 。
氨(NH 3)是无色、有刺激性气味的气体。
液氨常用作制冷剂。
氨极易溶于水,在常温常压下,1 体积水约可溶解700体积的氨。
氨水显碱性,能使酚酞试液变红色(此原理可用于氨气的检验 )。
氨溶于水中,大部分与水结合成一水合氨。
NH 3+H 2O ⇌NH 3·H 2O 。
一水合氨不稳定,受热后容易分解成氨和水。
NH 3·H 2O −→−∆NH 3↑+H 2O 。
一水合氨是弱电解质,可少部分电离出铵根离子(NH 4+)和氢氧根离子(OH -),使溶液显弱碱性。
NH 3·H 2O ⇌NH 4++ OH - 。
4、氨气极易溶于水,据此可以做“喷泉”实验,能形成喷泉的组合还有:①HCl 气体和水,②CO 2和氢氧化钠溶液。
氨气的尾气处理需要有防倒吸装置。
5、氨水可作氮肥,但不便运输和使用,所以,人们常将氨水制成铵盐[NH 4Cl ,(NH 4)2SO 4(硫铵),NH 4NO 3(硝铵)等]来获得铵态氮肥。
氨与氯化氢气体反应,生成白色氯化铵固体,NH 3+HCl →NH 4Cl 。
铵盐都是晶体,能溶于水,受热容易分解,放出氨。