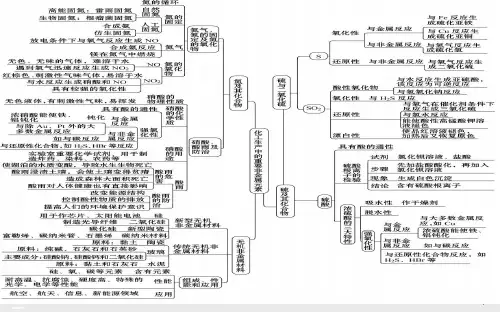
第四节 氮及其化合物
氮的循环过程
二.氨气
1.物理性质
无色,有刺激性气味的气体, 密度比空气小(用向下排空气 法收集),易液化(液态氨称为 液氨,可做制冷剂),极易溶于 水(1: 700)[其水溶液叫氨水]
氨气的喷泉实验
2.化学性质
(1)与H2O反应 NH3+H2O NH3·H2O
NH3 . H2O △= NH3 ↑+ H2O
※常用浓硝酸质量分数为69 %,98%以上的浓硝酸称 为“发烟硝酸”。
2. 化学性质:
(1)酸的通性:
HNO3 = H+ + NO3-
(2)不稳定性:
4HNO3 或=△光照O2↑+ 2H2O + 4NO2↑
(3)强氧化性: 氧化性:浓硝酸>稀硝酸
① 与金属单质反应:(Pt,Au除外)
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O 3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
三. 铵盐
1.物理性质:都是白色晶体, 都易溶于水。 2.化学性质
⑴不稳定性(受热易分解)
⑵与碱反应
NH4NO3+NaOH=△NaNO3+NH3↑+H2O
NH4++OH-=△NH3↑+H2O
3.NH4+的检验
四.氨气的实验室制法 1.反应原理:
2NH4Cl+Ca(OH)2△=CaCl2+2H2O+2NH3↑
②常温下,浓硝酸能使铁、铝 发生钝化。 ③与非金属单质反应:
C+4HNO3(浓)=CO2↑+4NO2↑+ 2H2O