2017医疗器械义齿类内审检查表
- 格式:doc
- 大小:372.50 KB
- 文档页数:26
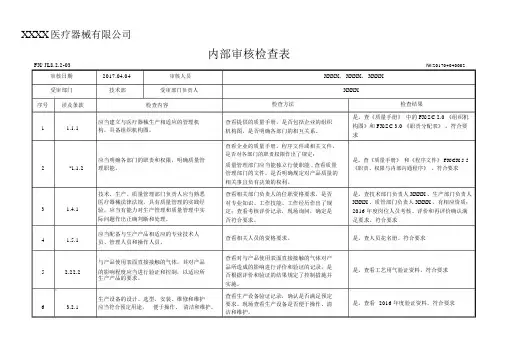
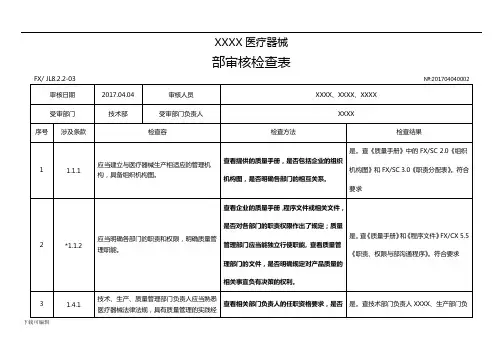
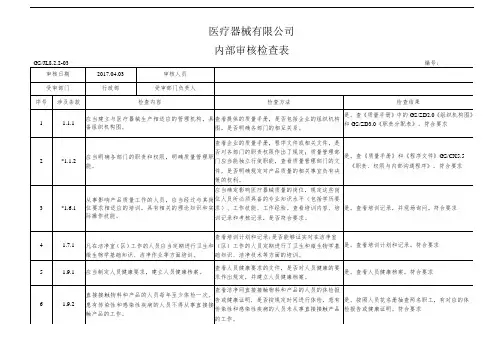
XXXX医疗器械有限公司内部审核检查表FX/ JL8.2.2-03审核日期2017.04.04审核人员受审部门技术部受审部门负责人№:201704040002 XXXX、 XXXX、 XXXXXXXX序号涉及条款检查内容1 1.1.1应当建立与医疗器械生产相适应的管理机构,具备组织机构图。
2*1.1.2应当明确各部门的职责和权限,明确质量管理职能。
技术、生产、质量管理部门负责人应当熟悉3 1.4.1医疗器械法律法规,具有质量管理的实践经验,应当有能力对生产管理和质量管理中实际问题作出正确判断和处理。
4 1.5.1应当配备与生产产品相适应的专业技术人员、管理人员和操作人员。
与产品使用表面直接接触的气体,其对产品5 2.22.2的影响程度应当进行验证和控制,以适应所生产产品的要求。
6 3.2.1生产设备的设计、选型、安装、维修和维护应当符合预定用途,便于操作、清洁和维护。
检查方法查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。
查看企业的质量手册,程序文件或相关文件,是否对各部门的职责权限作出了规定;质量管理部门应当能独立行使职能 , 查看质量管理部门的文件,是否明确规定对产品质量的相关事宜负有决策的权利。
查看相关部门负责人的任职资格要求,是否对专业知识、工作技能、工作经历作出了规定;查看考核评价记录,现场询问,确定是否符合要求。
查看相关人员的资格要求。
查看对与产品使用表面直接接触的气体对产品所造成的影响进行评价和验证的记录,是否根据评价和验证的结果规定了控制措施并实施。
查看生产设备验证记录,确认是否满足预定要求。
现场查看生产设备是否便于操作、清洁和维护。
检查结果是。
查《质量手册》中的 FX/SC 2.0 《组织机构图》和 FX/SC 3.0 《职责分配表》。
符合要求是。
查《质量手册》和《程序文件》 FX/CX 5.5《职责、权限与内部沟通程序》。
符合要求是。
查技术部门负责人 XXXX 、生产部门负责人XXXX 、质管部门负责人 XXXX ,有相应资质;2016 年度岗位人员考核、评价和再评价确认满足要求。
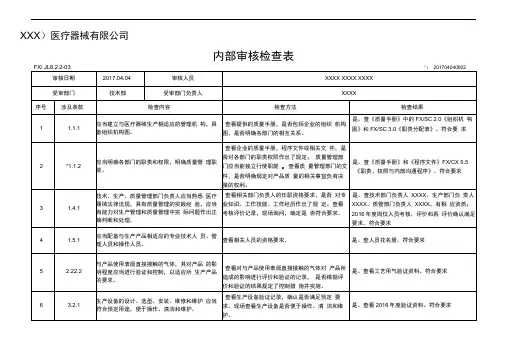

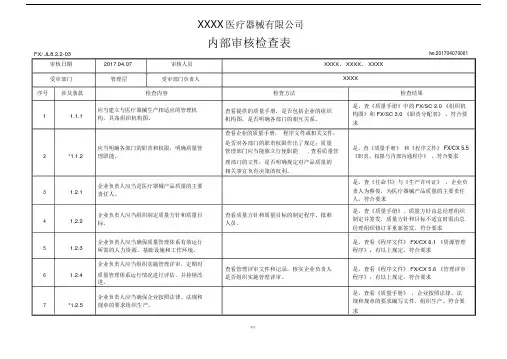
XXXX医疗器械有限公司内部审核检查表FX/ JL8.2.2-03审核日期2017.04.07审核人员受审部门管理层受审部门负责人№:201704070001 XXXX、 XXXX、 XXXXXXXX序号涉及条款检查内容1 1.1.1 应当建立与医疗器械生产相适应的管理机构,具备组织机构图。
2 *1.1.2 应当明确各部门的职责和权限,明确质量管理职能。
3 1.2.1 企业负责人应当是医疗器械产品质量的主要责任人。
4 1.2.2 企业负责人应当组织制定质量方针和质量目标。
5 1.2.3 企业负责人应当确保质量管理体系有效运行所需的人力资源、基础设施和工作环境。
企业负责人应当组织实施管理评审,定期对6 1.2.4 质量管理体系运行情况进行评估,并持续改进。
7 *1.2.5 企业负责人应当确保企业按照法律、法规和规章的要求组织生产。
检查方法查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。
查看企业的质量手册,程序文件或相关文件,是否对各部门的职责权限作出了规定;质量管理部门应当能独立行使职能, 查看质量管理部门的文件,是否明确规定对产品质量的相关事宜负有决策的权利。
查看质量方针和质量目标的制定程序、批准人员。
查看管理评审文件和记录,核实企业负责人是否组织实施管理评审。
检查结果是。
查《质量手册》中的 FX/SC 2.0 《组织机构图》和 FX/SC 3.0 《职责分配表》。
符合要求是。
查《质量手册》和《程序文件》 FX/CX 5.5《职责、权限与内部沟通程序》。
符合要求是。
查《任命书》与《生产许可证》,企业负责人为蔡俊,为医疗器械产品质量的主要责任人。
符合要求是。
查《质量手册》,质量方针由总经理组织制定并签发,质量方针和目标不适宜时需由总经理组织修订并重新签发。
符合要求是。
查看《程序文件》 FX/CX 6.1 《资源管理程序》,有以上规定。
符合要求是。
查看《程序文件》 FX/CX 5.6 《管理评审程序》,有以上规定。
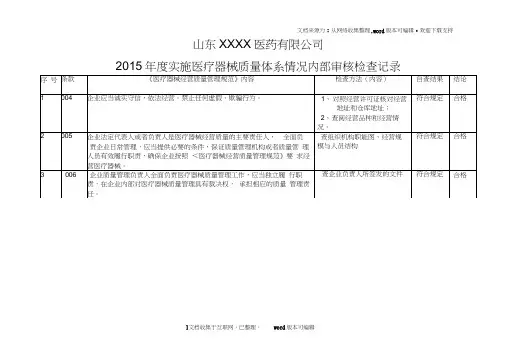
****医药有限公司2017 年度实施医疗器械质量体系情况内部审核检查记录序号条款《医疗器械经营质量管理规范》内容检查方法(内容)自查结结论果1004企业应当诚实守信,依法经营。
禁止任何虚假、欺骗行为。
1、对照经营许可证核对经符合规定合格营地址和仓库地址;2、查阅经营品种和经营情况。
2005企业法定代表人或者负责人是医疗器械经营质量的主要责任人,全查组织机构职能图、经营符合规合格面负责企业日常管理,应当提供必要的条件,保证质量管理机构或规模与人员结构定者质量管理人员有效履行职责,确保企业按照 <医疗器械经营质量管理规范》要求经营医疗器械。
3006企业质量管理负责人全面负责医疗器械质量管理工作,应当独立履查企业负责人所签发的符合规定合格行职责,在企业内部对医疗器械质量管理具有裁决权,承担相应的文件质量管理责任。
4007企业质量管理机构或者质量管理人员应当履行以下职责:查看质量管理部、质量管理符合规定合格(一)组织制订质量管理制度,指导、监督制度的执行,并对质量人的职责管理制度的执行情况进行检查、纠正和持续改进;(二)负责收集与医疗器械经营相关的法律、法规等有关规定,实施动态管理;(三)督促相关部门和岗位人员执行医疗器械的法规规章及本规范;(四)负责对医疗器械供货者、产品、购货者资质的审核;(五)负责不合格医疗器械的确认,对不合格医疗器械的处理过程实施监督;(六)负责医疗器械质量投诉和质量事故的调查、处理及报告;(七)组织验证、校准相关设施设备;(八)组织医疗器械不良事件的收集与报告;(九)负责医疗器械召回的管理;(十)组织对受托运输的承运方运输条件和质量保障能力的审核;(十一)组织或者协助开展质量管理培训;(十二)其他应当由质量管理机构或者质量管理人员履行的职责。
序号条款《医疗器械经营质量管理规范》内容检查方法(内容)自查结果结论5008企业应当依据本规范建立覆盖医疗器械经营全过程的质量管理制查制度文件目录及文件符合规定合格度,并保存相关记录或者档案,包括以下内容:(一)质量管理机构或者质量管理人员的职责;(二)质量管理的规定;(三)采购、收货、验收的规定(包括采购记录、验收记录、随货同行单等);(四)供货者资格审核的规定(包括供货者及产品合法性审核的相关证明文件等);(五)库房贮存、出入库管理的规定(包括温度记录、入库记录、定期检查记录、出库记录等);(六)销售和售后服务的规定(包括销售人员授权书、购货者档案、销售记录等);(七)不合格医疗器械管理的规定(包括销毁记录等);(八)医疗器械退、换货的规定;(九)医疗器械不良事件监测和报告规定(包括停止经营和通知记录等);(十)医疗器械召回规定(包括医疗器械召回记录等);(十一)设施设备维护及验证和校准的规定(包括设施设备相关记录和档案等);(十二)卫生和人员健康状况的规定(包括员工健康档案等);(十三)质量管理培训及考核的规定(包括培训记录等);(十四)医疗器械质量投诉、事故调查和处理报告的规定(包括质量投诉、事故调查和处理报告相应的记录及档案等)6009企业应当建立包括医疗器械采购、验收、储存、销售等质量管理记查看记录制度文件及日常经符合规定合格录制度;所有记录信息应当真实、准确、完整,符合可追溯要求。