勒夏特列原理及其应用PPT课件(上课用)
- 格式:ppt
- 大小:340.00 KB
- 文档页数:18

勒夏特列原理
勒夏特列原理(le chatelier's principle),又名化学平衡移动原理,由法国化学家勒夏特列于年发现。
是一个定性预测化学平衡点的原理,其具体内容为:如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。
概述
勒夏特列原理(又称均衡移动原理)就是一个定性预测化学平衡点的原理,主要内容为:在一个已经达至均衡的反应中,如果发生改变影响均衡的条件之一(例如温度、应力以及出席反应的化学物质的浓度),均衡将向着能弱化这种发生改变的方向移动。
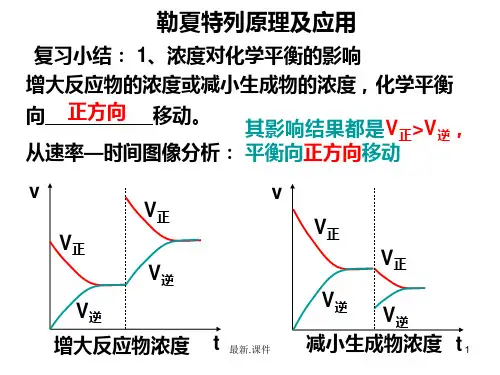
比如一个可逆反应中,当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少;但这种减弱不可能消除增加反应物浓度对这种反应物本身的影响,与旧的平衡体系中这种反应物的浓度相比而言,还是增加了。
勒夏特列原理的应用领域可以并使某些工业生产过程的转化率达至或吻合理论值,同时也可以防止一些并并无成效的方案(例如高炉提碳的方案),其应用领域非常广为。

勒夏特列原理相关应用勒夏特列原理是涉及平衡问题中最重要的一个原理。
几乎所有的平衡移动的问题都可以用勒夏特列原理来解释和判断。
正确应用的前提是熟练地掌握原理的本质和内涵,以及熟知各种情况。
一.原理:勒夏特列原理:如果改变影响平衡的一个条件(如浓度,压强或温度等),平衡就向能够减弱这种改变的方向移动。
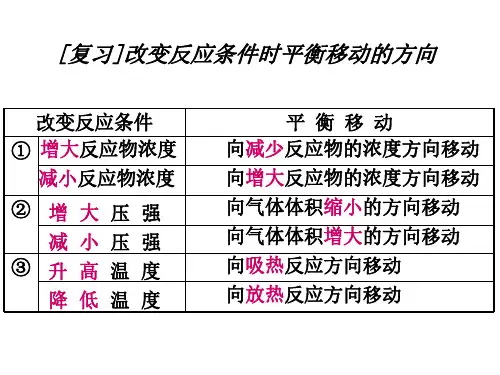
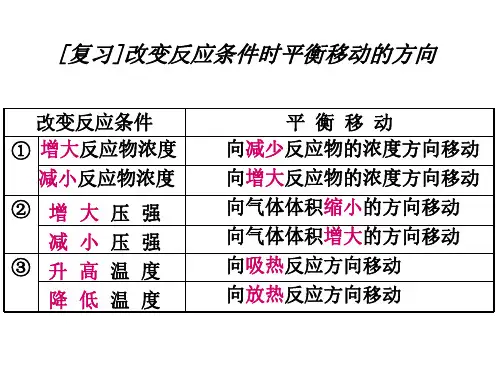
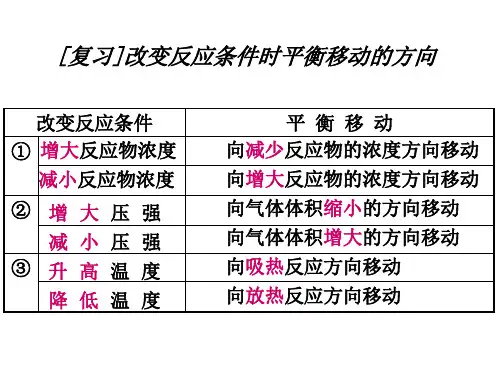
二.内涵:1)浓度:增加某一反应物的浓度,则反应向着减少此反应物浓度的方向进行,即反应向正方向进行。
减少某一生成物的浓度,则反应向着增加此生成物浓度的方向进行,即反应向正方向进行。
反之亦然。
2)压强:增加某一气态反应物的压强,则反应向着减少此反应物压强的方向进行,即反应向正方向进行。
减少某一气态生成物的压强,则反应向着增加此生成物压强的方向进行,即反应向逆方向进行。
反之亦然。
3)温度:升高反应温度,则反应向着减少热量的方向进行,即放热反应逆向进行,吸热反应正向进行;降低温度,则反应向着生成热量的方向的进行,即放热反应正向进行,吸热反应逆向进行。
4)催化剂:仅改变反应进行的速度,不影响平衡的改变,即对正逆反应的影响程度是一样的。
从以上的分析可知:通常出现的一些情形都在勒夏特列原理的范围之内。
因此,当我们遇到涉及平衡移动的问题时,只要正确运用勒夏特列原理来分析,都可以得出合适的答案的。
三.补充:勒夏特列原理的英文表述:Every system in stable chemical equilibrium submitted to the influence of an exterior force which tends to cause variation either in it s temperature or condensation ( pressure , concent ration , number of molecules in the unit of volume) ,in it s totality or only in some of it s part s , can undergo only those interior modifications change of temperature ,or of condensation ,of a sign cont rary to that resulting f rom the exterior force.此表述可翻译如下:任何稳定化学平衡系统承受外力的影响,无论整体地还是仅仅部分地导致其温度或压缩度(压强、浓度、单位体积的分子数) 发生改变,若它们单独发生的话,系统将只做内在的纠正,使温度或压缩度发生变化,该变化与外力引起的改变是相反的。