《勒夏特列原理及其应用》课件
- 格式:ppt
- 大小:420.50 KB
- 文档页数:18



勒夏特列原理相关应用勒夏特列原理是涉及平衡问题中最重要的一个原理。
几乎所有的平衡移动的问题都可以用勒夏特列原理来解释和判断。
正确应用的前提是熟练地掌握原理的本质和内涵,以及熟知各种情况。
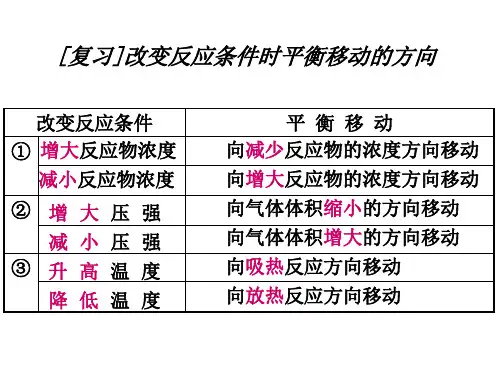
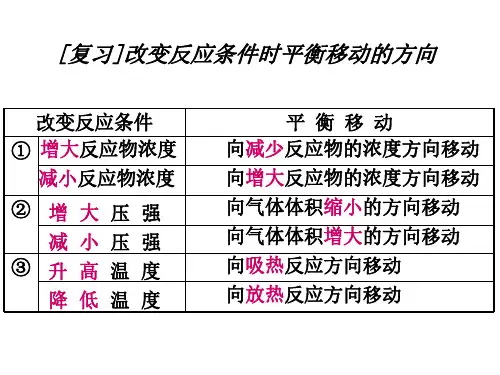
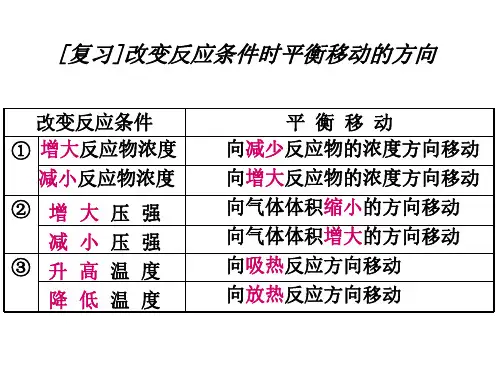
一.原理:勒夏特列原理:如果改变影响平衡的一个条件(如浓度,压强或温度等),平衡就向能够减弱这种改变的方向移动。
二.内涵:1)浓度:增加某一反应物的浓度,则反应向着减少此反应物浓度的方向进行,即反应向正方向进行。
减少某一生成物的浓度,则反应向着增加此生成物浓度的方向进行,即反应向正方向进行。
反之亦然。
2)压强:增加某一气态反应物的压强,则反应向着减少此反应物压强的方向进行,即反应向正方向进行。
减少某一气态生成物的压强,则反应向着增加此生成物压强的方向进行,即反应向逆方向进行。
反之亦然。
3)温度:升高反应温度,则反应向着减少热量的方向进行,即放热反应逆向进行,吸热反应正向进行;降低温度,则反应向着生成热量的方向的进行,即放热反应正向进行,吸热反应逆向进行。
4)催化剂:仅改变反应进行的速度,不影响平衡的改变,即对正逆反应的影响程度是一样的。
从以上的分析可知:通常出现的一些情形都在勒夏特列原理的范围之内。
因此,当我们遇到涉及平衡移动的问题时,只要正确运用勒夏特列原理来分析,都可以得出合适的答案的。
三.补充:勒夏特列原理的英文表述:Every system in stable chemical equilibrium submitted to the influence of an exterior force which tends to cause variation either in it s temperature or condensation ( pressure , concent ration , number of molecules in the unit of volume) ,in it s totality or only in some of it s part s , can undergo only those interior modifications change of temperature ,or of condensation ,of a sign cont rary to that resulting f rom the exterior force.此表述可翻译如下:任何稳定化学平衡系统承受外力的影响,无论整体地还是仅仅部分地导致其温度或压缩度(压强、浓度、单位体积的分子数) 发生改变,若它们单独发生的话,系统将只做内在的纠正,使温度或压缩度发生变化,该变化与外力引起的改变是相反的。

勒夏特勒原理勒夏特列原理也称列夏特勒原理简介影响平衡移动的因素只有有浓度、压强和温度三个。
1.浓度对化学平衡的影响在其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
2.压强对化学平衡的影响在有气体参加、有气体生成而且反应前后气体分子数变化的反应中,在其他条件不变时,增大压强(指压缩气体体积使压强增大),平衡向气体体积减小方向移动;减小压强(指增大气体体积使压强减小),平衡向气体体积增大的方向移动。
例如:在反应N2O4(g)---2NO2(g)中,假定开始时N2O4的浓度为1mol/L,NO2的浓度为2mol/L,K=2^2/1=4;体积减半(压强变为原来的2倍)后,N2O4的浓度变为2mol/L,NO2的浓度变为4mol/L,K变为4^2/2=8,K增大了,所以就要向减少反应产物(NO2)的方向反应,即有更多的NO2反应为N2O4,减少了气体体积,压强渐渐与初始状态接近.注意:恒容时,充入不反应的气体如稀有气体导致的压强增大不能影响平衡.3.温度对化学平衡的影响在其他条件不变时,升高温度平衡向吸热反应方向移动。
以上三种因素综合起来就得到了勒夏特列原理(Le Chatelier's principle)即平衡移动原理:如果改变影响平衡的一个条件(如浓度、压强、温度),平衡就向能够减弱这种改变的方向移动。
说明:催化剂只能缩短达到平衡所需时间,而不能改变平衡状态(即百分组成)可用勒夏特列原理定性地说明浓度对化学平衡的影响——增加反应物浓度或减小生成物浓度,平衡向生成物方向移动,增加生成物浓度或减小反应物浓度,平衡向反应物方向移动。
利用化学平衡的概念,对比K和J大小,可以判断系统中的反应混合物是否达到平衡,以及平衡将向哪个方向移动。
即:J 〉K,平衡向左移动;J〈 K,平衡向右移动;J = K,达到平衡状态。
这一关系式被称为化学平衡的质量判据,是与上面的能量判据相对应的。



勒夏特列原理的应用勒夏特列原理不仅适用于化学平衡体系,而且还适用于自然界中的一切动态平衡体系,高中阶段接触到的有四类动态平衡:化学平衡、溶解平衡、电离平衡和水解平衡。
只要理解平衡移动原理的含义,就可以熟练地应用于各平衡中。
这一知识点也是今后理综综合命题的热点。
一、常见四大平衡研究对象1.化学平衡:可逆反应。
如:N2+3H22NH3;△H<0高温不利于氨的生成,增大压强有利于氨的生成。
2.电离平衡:弱电解质。
如:CH3COOH H++CH3COO—;△H >0加热促进电离,稀释电离程度增大。
3.水解平衡:弱酸盐或弱碱盐或弱酸弱碱盐。
如:Fe3++3H2O Fe(OH)3+3H+;△H>0,配制Fe3+溶液应加入少量相应酸防止Fe3+水解。
不断加热FeCl3溶液,蒸干灼烧可得到Fe2O3固体。
4.溶解平衡:气体或固体溶于水形成的饱和溶液(1)气体的溶解平衡如:Cl2+H2O H++Cl—+HClO当加入NaCl、CaCO3等时平衡会发生移动。
当收集Cl2、SO2、CO2、H2S等气体时往往分别通过饱和的NaCl、NaHSO3、NaHCO3、NaHS等溶液以除去可能有的酸性气体,且抑制气体的溶解。
(2)固体的溶解平衡如:NaNO3(s) Na+( ag)+NO3—(ag);△H >0 加热促进溶解Ca(OH)2(s) Ca2+( ag)+2OH—( ag);△H<0加热溶解度降低MgCO3+H2O =Mg(OH)2↓+CO2↑反应的进行是由于MgCO3存在溶解平衡:MgCO3(s) Mg2+( ag)+CO32—( ag),CO32—能水解,加热时促进了CO32—的水解也促进了MgCO3的溶解,最终MgCO3转化成Mg(OH)2。
二、勒夏特列原理在四大平衡中的应用1. 在化学平衡中的应用事例1:对于合成氨工业,采用的适宜条件是(1)增大氢气、氮气浓度,及时将氨气分离出来;(2)温度为500℃的高温;(3)压强为20MPa~50MPa;(4)使用铁作催化剂。

勒夏特列原理及其应用原理:如果改变影响化学平衡的一个条件,平衡就向能够减弱这种改变的方向移动。
适用条件:勒夏特列原理又叫平衡移动原理,只能适用于已达平衡的体系,对未达平衡的体系不能使用。
注意:平衡移动只能减弱这种改变而不能抵消。
一.在一般可逆反应中的应用mA(g)+nB(g)pC(g)+qD(g)(m+n>p+q)∆H<01.温度:升高温度,平衡左移(吸热方向);降低温度,平衡右移(放热方向)。
2.浓度:增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
3.压强:增大压强,平衡向右(体积缩小方向)移动;减小压强,平衡向左(体积增大方向)移动。
【拓展】惰性气体对化学平衡的影响:在一个平衡体系中加入惰性气体,如果保持体积不变(各物质浓度不变,正、逆反应速率不变),平衡不移动;如果保持压强不变(体积增大,各物质浓度都要同等比例的减小,相当于减压),平衡向气体体积增大方向移动。
二.在电离平衡中的应用HA H++A--;∆H>0 或BOH B++OH--;∆H>01.温度:升高温度,平衡右移,弱电解质的电离水准增大,溶液中离子浓度增大;降低温度,平衡左移,弱电解质的电离水准减小,溶液中离子浓度减小。
2.浓度:增大弱电解质的浓度,平衡右移,但弱电解质的电离水准减小,溶液中离子浓度仍然增大;稀释,平衡右移,弱电解质的电离水准增大,但溶液中离子浓度仍然减小。
3.同离子效应:在弱电解质溶液中,加入与该弱电解质有共同离子的强电解质时,弱电解质的电离平衡会向左移动,抑制弱电解质的电离,致使弱电解质的电离水准减小,这种现象叫做同离子效应。
例:在CH3COOH CH3COO--+H+平衡体系中,加入HCl或CH3COONa等,都会使平衡向左移动,抑制CH3COOH的电离。
三.在水解平衡中的应用A n--+H 2O HA(n—1)--+OH--∆H>0B n++nH2O B(OH)n+nH+∆H>01.温度:盐的水解是吸热的,所以,升高温度,可促动盐的水解。
勒夏特勒原理勒夏特列原理也称列夏特勒原理简介影响平衡移动的因素只有有浓度、压强和温度三个。
1.浓度对化学平衡的影响在其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
2.压强对化学平衡的影响在有气体参加、有气体生成而且反应前后气体分子数变化的反应中,在其他条件不变时,增大压强(指压缩气体体积使压强增大),平衡向气体体积减小方向移动;减小压强(指增大气体体积使压强减小),平衡向气体体积增大的方向移动。
例如:在反应N2O4(g)---2NO2(g)中,假定开始时N2O4的浓度为1mol/L,NO2的浓度为2mol/L,K=2^2/1=4;体积减半(压强变为原来的2倍)后,N2O4的浓度变为2mol/L,NO2的浓度变为4mol/L,K变为4^2/2=8,K增大了,所以就要向减少反应产物(NO2)的方向反应,即有更多的NO2反应为N2O4,减少了气体体积,压强渐渐与初始状态接近.注意:恒容时,充入不反应的气体如稀有气体导致的压强增大不能影响平衡.3.温度对化学平衡的影响在其他条件不变时,升高温度平衡向吸热反应方向移动。
以上三种因素综合起来就得到了勒夏特列原理(Le Chatelier's principle)即平衡移动原理:如果改变影响平衡的一个条件(如浓度、压强、温度),平衡就向能够减弱这种改变的方向移动。
说明:催化剂只能缩短达到平衡所需时间,而不能改变平衡状态(即百分组成)可用勒夏特列原理定性地说明浓度对化学平衡的影响——增加反应物浓度或减小生成物浓度,平衡向生成物方向移动,增加生成物浓度或减小反应物浓度,平衡向反应物方向移动。
利用化学平衡的概念,对比K和J大小,可以判断系统中的反应混合物是否达到平衡,以及平衡将向哪个方向移动。
即:J 〉K,平衡向左移动;J〈 K,平衡向右移动;J = K,达到平衡状态。
这一关系式被称为化学平衡的质量判据,是与上面的能量判据相对应的。